ПРАКТИЧЕСКОЕ РУКОВОДСВО ПО ХИМИИ ПОЧВ. Руководство по химии почв учебное пособие
 Скачать 2.43 Mb. Скачать 2.43 Mb.
|
2.1.5. Расчет промывной нормыСельскохозяйственное освоение солончаков и других засоленных почв (в первую очередь их солончаковых и высокосолончаковых разностей) возможно лишь при удалении солей, как правило, за счет промывки. В качестве главного и наиболее надежного способа удаления солей применяется сквозная промывка почв, обеспечивающая вынос солей из всей толщи почвенного профиля. Количество воды, которое требуется для промывки солей, называется промывной нормой. Для ее расчета широко применяется формула, предложенная В.Р.Волобуевым: МПР = 10000 . d . lg(Sh/So), где МПР – промывная норма, м3/га; Sh – содержание солей в слое почвогрунта нуждающемся в промывке, в % от массы почвы; So – допустимое содержание солей в этом слое, в % от массы почвы; d – показатель солеотдачи, устанавливаемый по данным опытно-производственных промывок. Для ориентировочных расчетов можно использовать данные представленные в таблице 20. Таблица 20. Значение показателя солеотдачи d в зависимости от химического и гранулометрического состава промываемых почв (В.Р.Волобуев, 1975)
При проведении промывок засоленных почв обычно используют такой показатель, как средневзвешенное содержание солей в метровой и двухметровой толщах. Этот показатель дает представление об общем содержании солей, которое необходимо удалить из почвы при промывках. Средневзвешенное содержание солей в любом заданном слое рассчитывается следующим образом: содержание сухого остатка умножается на мощность соответствующего горизонта, затем все полученные результаты суммируются и полученная сумма делится на мощность всей толщи. Пример подобного расчета для метрового слоя почвы, из профиля которой были отобраны пять образцов, характеризующихся различной величиной сухого остатка приведен в таблице 21. Аналогичным образом рассчитывается и средневзвешенное содержание отдельных ионов в заданном слое почвы, на основании чего можно установить его тип засоления и с помощью справочных данных (табл. 20) определить показатель солеотдачи. Таблица 21. Расчет средневзвешенного количества солей в заданном слое почвы.
В нашем случае, например, для почвы глинистого гранулометрического состава при хлоридном типе засоления и допустимом содержании солей после промывки на уровне 0,15% промывная норма для метрового слоя составит: Мпр = 10000 . 1,80 . lg (1,05/0,15) = 15200 м3/га. При тех же условиях, но при сульфатном засолении: Мпр = 10000 . 2,40 . lg (1,05/0,15) = 20300 м3/га. Однако необходимо помнить, что средневзвешенное содержание солей дает представление лишь об их общем количестве, которое, например, необходимо удалить из почвы при промывках. В то же время на его основании нельзя судить о степени пригодности почвы для сельскохозяйственного использования. Это связано с тем, что при оценке степени засоления почв только по средневзвешенному содержанию солей в той или иной толще почвы, они могут быть отнесены к другой категории, нежели при оценке степени засоления по верхним солевым горизонтам. 2.2. Катионообменная способность почв 2.2.1. Общие представления о катионообменной способности почв. Ионообменные свойства почвы обусловлены особенностями ее почвенного поглощающего комплекса (ППК) и процессами обмена катионов и анионов, адсорбированных ППК на катионы и анионы почвенного раствора. ППК по К.К. Гедройцу – совокупность органических, минеральных и органо-минеральных соединений обладающих высокой реакционной и ионообменной способностью. Ионообменная способность ППК определяется наличием положительных и отрицательных зарядов на поверхности формирующих его компонентов. Обмен катионов происходит на отрицательно заряженных позициях ППК, анионов – на положительно заряженных. В большинстве почв преобладают отрицательно заряженные коллоиды, сумма положительных зарядов в ППК чаще всего составляет лишь 1-5% от суммы отрицательных зарядов. Среди отрицательно заряженных центров ППК обусловливающих процессы обмена катионов выделяют постоянные и переменные. Постоянные заряды связаны с изоморфными замещениями в кристаллических решетках глинистых минералов. Их количество не зависит от рН и других факторов. Переменные заряды часто называют рН-зависимыми. Их количество зависит от рН среды. С увеличением рН возрастает ионизация функциональных групп глинистых минералов, в реакции обмена помимо карбоксильных групп гумусовых кислот дополнительно включаются их фенольные гидроксилы и поверхностные ОН-группы оксидов и гидроксидов металлов, в результате чего возрастает ионообменная способность почвы. Обменные (поглощенные) катионы в почвах представлены главным образом Na+, K+, NH4+, Ca2+, Mg2+, Al3+, H+. В незначительных количествах обнаруживаются железо, цинк, медь, марганец и другие элементы. Практически все почвы в составе обменных катионов содержат кальций и магний, причем в большинстве случаев кальций преобладает над магнием. Также среди обменных катионов всегда содержатся К+ и NH4+, но доля их в ППК невелика. Количество обменного калия чаще всего не превышает 2-5% от емкости обмена, содержание поглощенного аммония еще меньше. В почвах с кислой реакцией среды наряду с кальцием и магнием важную роль среди обменных катионов играют ионы Н+ и Al3+, на долю которых может приходиться 50% и более от емкости катионного обмена. В почвах с щелочной реакцией среды наряду с кальцием и магнием значительная доля в составе обменных катионов приходится на поглощенный натрий. Общее содержание всех обменных катионов, кроме Н+ и А13+, называют суммой обменных оснований. Исходя из этого, все почвы можно разделить на две большие группы: почвы насыщенные основаниями и почвы ненасыщенные основаниями. Почвы насыщенные основаниями не содержат в ППК ионы Н+ и А13+. Обменные катионы представлены только обменными основаниями — Са2+, Mg2+, Na+, K+, NH4+. Количество их соответствует величине реальной емкости обмена. Почвы ненасыщенные основаниями всегда содержат некоторое количество обменных Н+ и А13+, поэтому сумма обменных оснований у них меньше емкости обмена. Для относительной оценки количества содержащихся в них обменных оснований используется показатель – степень насыщенности почвы основаниями (V). Для характеристики катионообменной способности почвы используют следующие показатели. Емкость катионного обмена (ЕКО) – общее количество катионов, удерживаемых почвой в обменном состоянии и способных к замещению на катионы раствора, взаимодействующего с почвой. Поскольку ЕКО в значительной мере зависит от рН, различают реальную (эффективную) емкость катионного обмена (ЕКОэфф), стандартную емкость катионного обмена (ЕКОст) и дифференциальную емкость катионного обмена (ЕКОдиф). Реальную (эффективную) ЕКО определяют с помощью небуферных растворов нейтральных солей. С определенной долей допущения об ЕКОэфф судят по сумме обменных катионов. Стандартную ЕКО определяют с помощью буферного раствора Ва2+, имеющего рН 6,5 и исключающего влияние реакции среды на величину ЕКО. Дифференциальная (рН-зависящая) ЕКО характеризует приращение емкости катионного обмена с увеличением рН равновесного раствора: ∆ЕКО/∆рН. Ее находят, насыщая почву катионами одного рода из буферных растворов с различными значениями рН (например, 6,5 и 8,2) и рассчитывают или общее приращение ЕКО, или ее увеличение на единицу рН. Катионообменная способность относится к числу фундаментальных свойств почвы. Это вытекает из следующих положений: 1. От состава обменных катионов зависит характер взаимодействия органических веществ с твердой фазой почвы, образование органо-минеральных соединений и формирование органопрофиля почвы. Аккумуляции органических веществ в почвенном профиле, в том числе с образованием устойчивых адсорбционных комплексов способствуют Fe, Al, Ca, Mg. 2. Обменные реакции между катионами почвенного раствора и почвенным поглощающим комплексом влияют на рН и ионный состав почвенного раствора, кислотно-основную и другие виды буферности почв. От количества обменных катионов Н+ и Аl3+ зависит величина потенциальной кислотности почвы, от количества обменного Na+ – величина потенциальной щелочности почвы. 3. От состава обменных катионов зависят водно-физические свойства почвы. Одновалентные катионы, насыщая почвенный поглощающий комплекс, вызывают пептизацию тонкодисперсных частиц и разрушение почвенной структуры. Почвы, обогащенные обменным натрием (солонцы, солонцеватые почвы) сильно набухают при увлажнении и характеризуются крайне низкой фильтрационной способностью. Во влажном состоянии они очень вязкие, а при высыхании становятся очень плотными и твердыми, содержат значительное количество недоступной для растений влаги. Обменный кальций вызывает коагуляцию тонкодисперсных частиц, способствует формированию водопрочной структуры и улучшению водно-физических свойств почвы. 4. Обменные катионы – один из непосредственных источников элементов минерального питания растений. 5. Состав обменных катионов – один из важнейших показателей используемых при диагностике и классификации почв. В практических целях широко используется разделение почв на насыщенные и не насыщенные основаниями; по содержанию обменного натрия устанавливают степень солонцеватости почв. 6. Состав обменных катионов учитывают при составлении проектов промывок засоленных почв и использования для орошения минерализованных вод. 7. Закономерности катионного обмена являются теоретической основой для химической мелиорации почв (известкование, гипсование и др.). 2.2.2. Методы определения катионообменной способности почв Для количественной характеристики катионообменной способности почв определяют: эффективную и стандартную емкость катионного обмена, сумму обменных оснований, гидролитическую кислотность, состав обменных катионов. 2.2.2.1. Оценка эффективной емкости катионного обмена Эффективную (реальную) емкость катионного обмена определяют, обрабатывая навеску почвы небуферным раствором нейтральной соли. При этом допускают, что величина рН почвенной суспензии, получаемой в процессе анализа, обусловлена свойствами анализируемой почвы, и результаты определения ЕКО отражают реальную катионообменную способность почвы. Однако при анализе почв с кислой реакцией среды происходит увеличение рН по мере вытеснения из ППК катионов проявляющих кислотные свойства. Вследствие этого ЕКОэфф установленная экспериментально, по-видимому, отличается от ЕКО почвы в реальных условиях. Поэтому эффективную емкость катионного обмена обычно находят расчетным путем, суммируя результаты определения вытесненных из ППК обменных катионов или результаты определения суммы обменных оснований и величины гидролитической кислотности. 2.2.2.2. Определение стандартной емкости катионного обмена по Бобко-Аскинази в модификации ЦИНАО Анализ некарбонатных почв. В зависимости от предполагаемой ЕКО с точность до 0,01 г отвешивают 1,5-10 г воздушно-сухой почвы, пропущенной через сито с диаметром отверстий 1 мм, и помещают в химический стакан объемом 100-150 мл или фарфоровую чашку. К почве приливают 20-25 мл буферного раствора с рН=6,5 содержащего хлорид и ацетат бария. Суспензию перемешиваю стеклянной палочкой и спустя некоторое время (около 5 мин) после оседания почвенных частиц надосадочную жидкость по стеклянной палочке переносят на фильтр. Обработку почвы методом декантации повторяют многократно, приливая к почве такой объем буферного раствора, чтобы надосадочную жидкость после отстаивания суспензии можно было полностью перенести на фильтр. Каждую последующую порцию надосадочной жидкости переносят на фильтр после того, как полностью профильтруется предыдущая. Обработку почвы раствором бариевых солей проводят до полного вытеснения из почвенного поглощающего комплекса обменных катионов. Обработку почвы буферным раствором считают законченной, когда рН фильтрата перестанет отличаться от рН исходного раствора. Обычно для этого требуется 300-400 мл буферного раствора. Когда в колбе наберется 300-400 мл фильтрата отбирают из под воронки в фарфоровую чашечку 3-5 мл раствора и добавляют 2-3 капли универсального индикатора. В такую же чашечку приливают аналогичное количество буферного раствора и универсального индикатора. Промывание считают законченным, когда окраска исследуемого раствора перестанет отличаться от окраски буферного раствора. Измерение рН можно провести и с помощью рН-метра. После окончания насыщения барием почву необходимо полностью перенести на фильтр с помощью буферного раствора. Дождавшись окончания фильтрации, удаляют избыток бариевых солей, механически задержанных почвой. Для этого тщательно промывают верхнюю часть воронки и почву на фильтре 1 раз дистиллированной водой. Фильтр на воронке оставляют на ночь для подсушивания, чтобы содержащаяся в почве влага не повлияла на концентрацию добавляемой к почве серной кислоты. На следующий день помещают фильтр с почвой в сухую коническую колбу на 250 мл. В колбу из бюретки приливают 100 мл титрованного 0,05 н. раствора H2SO4, взбалтывают содержимое колбы в течение 5 мин и фильтруют через плотный складчатый фильтр в сухую колбу. В коническую колбу на 100-150 мл помещают аликвоту фильтрата (15-25 мл), добавляют 2-3 капли раствора фенолфталеина и титруют 0,02-0,05 н. раствором NаОН до слаборозовой окраски, не исчезающей в течение 1 мин. Параллельно проводят контрольное титрование 0,02-0,05 н. раствором NаОН аналогичного аликвоте фильтрата количества 0,05 н. раствора H2SO4, используемого для вытеснения из почвы Ва2+. Анализ карбонатных, гипссодержащих и засоленных почв. При анализе этой группы почв перед насыщением ППК барием необходимо удалить из почвы карбонаты, гипс и легкорастворимые соли. Навеску почвы, пропущенную через сито с диаметром отверстий 1 мм и взвешенную с точностью до 0,01 г, массой 1,5-10 г в зависимости от предполагаемой величины ЕКО помещают в химический стакан вместимостью 100-150 мл. К почве порциями по 10-15 мл приливают 0,05 н. раствор HCl, для разрушения карбонатов. После отстаивания суспензии надосадочную жидкость переносят по стеклянной палочке на фильтр. Если анализируемая почва содержит большое количество карбонатов и бурно вскипает от HCl (пробу проводят перед анализом, добавляя к комочку почвы 10% раствор HCl) или гипс, то навеску почвы предварительно 2-3 раза обрабатывают 50 мл 0,2 н. раствора HCl, а затем продолжают обработку 0,05 н. раствором HCl. Обработку почвы HCl проводят до исчезновения в фильтрате реакции на кальций. Для установления этого помещают в пробирку примерно 5 мл фильтрата из под воронки, разбавляют таким же объемом дистиллированной воды, добавляют 1 мл хлоридно-аммиачного буферного раствора, гидроксиламин, раствор сульфида натрия и индикатор эриохром черный. Розовая или фиолетовая окраска свидетельствуют о неполном, голубая окраска – о полном удалении из почвы кальция и магния. После удаления из почвы кальция ее обрабатывают буферным раствором бария, как при анализе некарбонатных почв. Емкость катионного обмена находят по формуле: где ЕКОст – стандартная емкость катионного обмена, мг-экв./100 г почвы; V1 – объем раствора NaOH пошедшего на контрольное титрование исходного 0,05 н. раствора Н2SO4, добавленного к почве насыщенной барием, мл; V2 – объем раствора NaOH пошедшего на титрование аликвоты фильтрата; V0 – объем титрованного 0,05 н. раствора Н2SO4 добавленного к насыщенной барием почве, мл; Vал – объем фильтрата, взятого для титрования, мл; н – нормальность NаОН; m – навеска почвы, г. Пример расчета. Для определения ЕКОст каштановой почвы была взята навеска массой 5 г. После насыщения почвы барием к ней прилито 100 мл 0,05 н. раствора Н2SO4. Когда суспензия была отфильтрована, взято 25 мл фильтрата, на его титрование пошло 20,2 мл 0,05 н. раствора NаОН. На контрольное титрование 25 мл исходного 0,05 н. раствора Н2SО4 пошло 24,2 мл 0,05 н. раствора NaOH. Реагенты. 1. Буферный раствор BaCl2–Ba(CH3COO)2 с рН = 6,5. 6,1 г BaCl2 ∙ 2H2O и 6,8 г Ва(СН3СОО)2 помещают в мерную колбу на 1 л и растворяют в дистиллированной воде. Объем раствора в колбе доводят дистиллированной водой до метки и тщательно перемешивают. Раствор должен иметь рН = 6,5. 2. 0,05 н. раствор H2SO4 и 0,02-0,05 н. раствор NaOH готовят из фиксанала. 3. Фенолфталеин. 1 г сухого реактива растворяют в 100 мл 60%-ного этилового спирта. 4. Комбинированный индикатор Алямовского. Смешать 1 часть 0,02%-ного раствора метилового красного с 2-мя частями 0,04%-ного раствора бромтимолового синего. Для приготовления метилового красного 0,1 г индикатора растирают в агатовой ступке и растворяют в 300 мл этилового спирта-ректификата. Добавляют 7,4 мл 0,05 н. раствора NaOH и доводят объем раствора дистиллированной водой до 500 мл. Для приготовления раствора бромтимолового синего 0,4 г индикатора растворяют в 208 мл этилового спирта-ректификата, добавляют 12,8 мл 0,05 н. раствора NaOH и доводят объем жидкости дистиллированной водой до 1 л. 2.2.2.3. Определение суммы обменных оснований методом Каппена-Гильковица Метод основан на вытеснении обменных оснований ионом водорода 0,1 н раствора НСl по схеме: 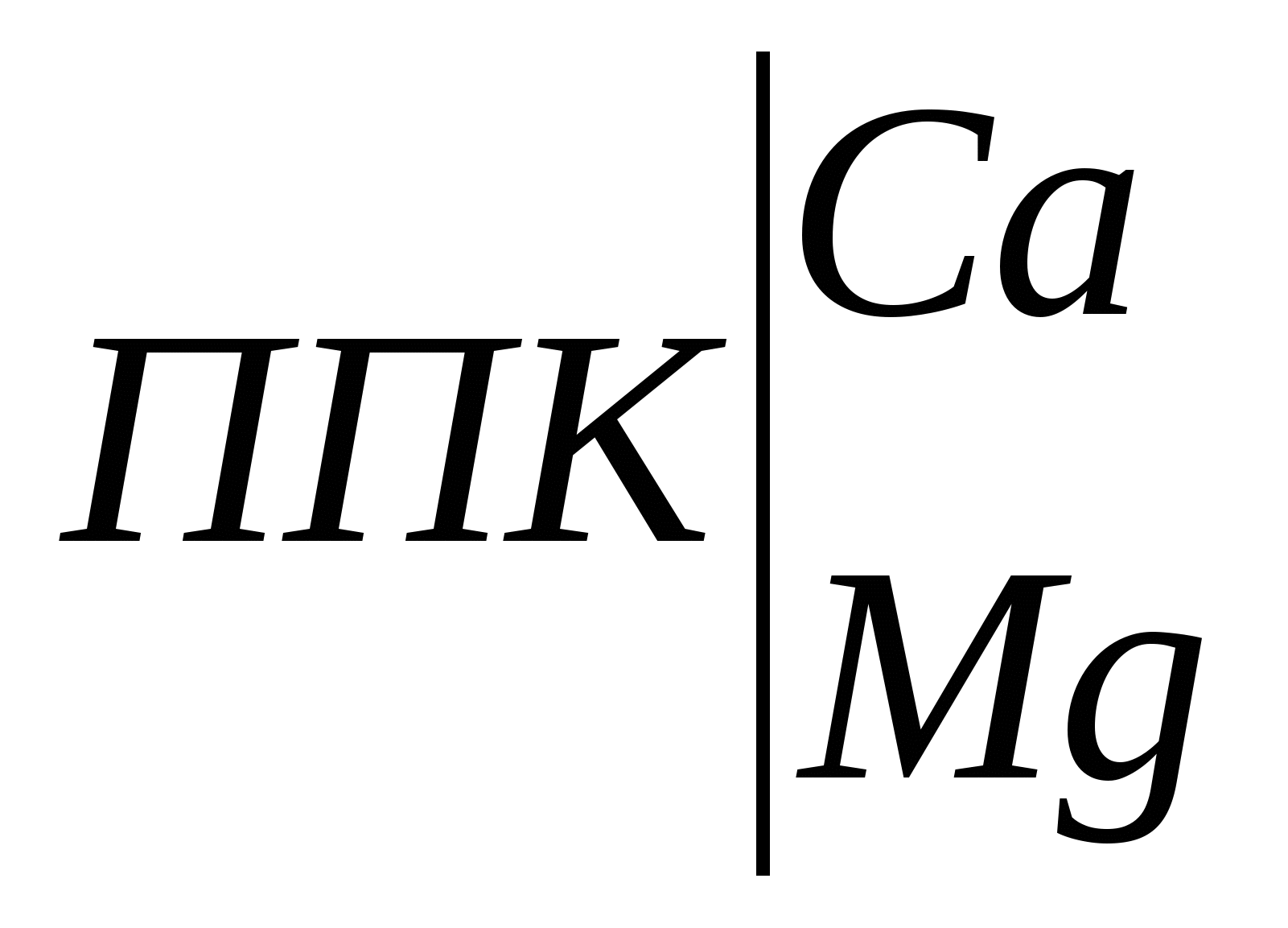 + 4НСl + 4НСl 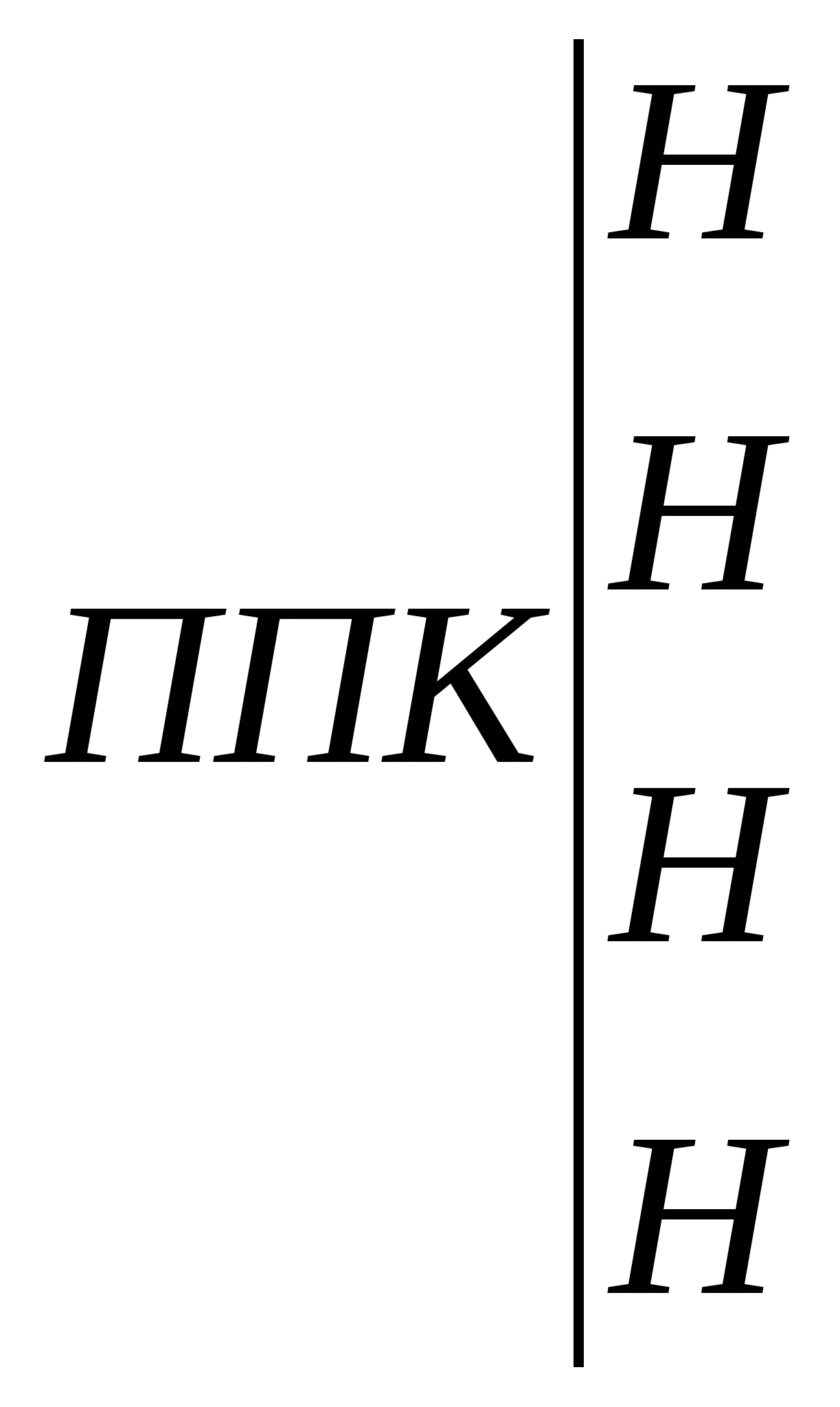 + СаСl2 + MgCl2 + СаСl2 + MgCl2Количество перешедших в раствор обменных оснований определяют по разности между содержанием Н+ в растворе до, и после взаимодействия кислоты с почвой. Однако следует учитывать, что часть кислоты расходуется на побочные реакции и при однократной обработке почвы кислотой вытесняются не все обменные основания. Поэтому для подзолистых и дерново-подзолистых почв обычно получаются завышенные результаты, а для черноземов – заниженные. Ход анализа. 1. Взвешивают на технохимических весах 20 г воздушно-сухой почвы, просеянной через сито с отверстиями диаметром 1 мм. 2. Почву высыпают в колбу на 350-500 мл. 3. Из бюретки приливают 100 мл 0,1 н. раствора НС1, взбалтывают 1 ч на ротаторе и оставляют на сутки. 4. Вытяжку фильтруют через сухой беззольный фильтр. Если первые порции фильтрата окажутся мутными, то их снова выливают на тот же фильтр, а колбу ополаскивают дистиллированной водой. 5. Пипеткой отбирают 25-50 мл прозрачного фильтрата в коническую колбу на 150-200 мл, прибавляют 2-3 капли фенолфталеина, кипятят 1-2 мин, для удаления СО2 и титруют 0,1 н. раствором NаОН до слабо-розовой окраски не исчезающей в течение 1 мин. Сумму обменных оснований вычисляют по формуле: где S – сумма обменных оснований, мг-экв. на 100 г почвы; V1 – количество фильтрата HCl, взятого для титрования, мл; н1 – нормальность НСl; V2– количество раствора NaOH, пошедшего на титрование взятого объема фильтрата, мл; н2 – нормальность NaOH; 100 – коэффициент пересчета на 100 г почвы; V0 – общий объем фильтрата, мл; m– навеска почвы, г; КН2О – коэффициент гигроскопичности. Если сумма обменных оснований в почве ожидается больше 15 мг-экв., то соляной кислоты берут 200 мл или уменьшают навеску почвы до 10 г. Обычно руководствуются следующими придержками: для анализа дерново-подзолистых и светло-серых лесных почв берут 20 г почвы и 100 мл HCl, для анализа серых, темно-серых лесных почв и черноземов – 20 г почвы и 200 мл НС1. Пример расчета. К навеске почвы равной 20,0 г прилито 100 мл 0,108 н. раствора НСl. После взаимодействия почвы с кислотой вытяжка отфильтрована. На титрование 50 мл фильтрата пошло 40 мл 0,106 н. NaOH. Коэффициент гигроскопичности равен 1,05. 2.2.2.4. Определение гидролитической кислотности Определение гидролитической кислотности основано на том, что при взаимодействии раствора СН3СОONa с почвой образуется уксусная кислота, которая оттитровывается щелочью. По количеству щелочи, пошедшей на титрование, и судят о величине гидролитической кислотности. Ход анализа. 1. На технохимических весах отвешивают 20 г воздушно-сухой почвы, просеянной через сито с диаметром отверстий 1 мм, и высыпают в колбу на 200 мл. 2. К почве приливают 50 мл 1,0 н. раствора СН3СОONa и взбалтывают содержимое колбы в течение 1 ч. Часовое взбалтывание можно заменить пятиминутным взбалтыванием рукой с последующим отстаиванием суспензии в течение суток. 3. Суспензию отфильтровывают через сухой складчатый фильтр. Перед фильтрованием жидкость хорошо взбалтывают, чтобы перенести почву на фильтр. Если фильтрат окажется мутным, его следует снова профильтровать через тот же фильтр. 4. Отбирают пипеткой 25 мл прозрачного фильтрата и переносят в коническую колбу на 100 мл.
Гидролитическую кислотность вычисляют по формуле: г де НГ – гидролитическая кислотность, мг-экв. на 100 г почвы; V1 – количество раствора NaОН, пошедшего на титрование взятого объема фильтрата, мл; н. – нормальность NaOH; 100 – коэффициент пересчета на 100 г почвы; V0 –общий объем фильтрата, мл; V2 – объем фильтрата, взятого для титрования, мл; 1,75 – поправка на полноту вытеснения ионов водорода; m – навеска почвы, г. Пример расчета. Для определения величины гидролитической кислотности к навеске воздушно-сухой почвы массой 20,0 г прилито 50 мл 1,0 н. раствора СН3СООNa. После того как суспензия была отфильтрована, взято 25 мл фильтрата, на титрование которого пошло 2,2 мл 0,104 н. раствора NaOH. Коэффициент гигроскопичности равен 1,05. Величина гидролитической кислотности равна: 2.2.2.5. Определение обменных катионов по методу Пфеффера в модификации В.А. Молодцова и И.В. Игнатовой Метод предназначен для определения состава обменных катионов (Са2+, Мg2+, Na+, К+) в почвах с нейтральной и щелочной реакцией среды содержащих водорастворимые соли, свободные карбонаты и гипс (каштановые, солонцы и др.). Ход анализа. Навеску почвы, пропущенную через сито с отверстиями диаметром 1 мм, массой 5 г помещают в центрифужную пробирку вместимостью 50-100 мл. Почву увлажняют дистиллированной водой, добавляя ее по каплям до полного смачивания навески, но с таким расчетом, чтобы на поверхности почвы не появилась свободная вода. Влажность почвы в зависимости от гранулометрического состава будет соответствовать 20-40 %. Пробирку закрывают пробкой и оставляют на ночь. Затем в пробирку приливают 10 мл 70 %-ного (по объему) этилового спирта и содержимое перемешивают стеклянной палочкой. Суспензию центрифугируют 10 мин при 2000 об/мин. Отмывание легкорастворимых солей спиртом повторяют несколько раз до полного удаления хлорид- и сульфат-ионов. Для слабозасоленных почв достаточно трех последовательных обработок почвы спиртом, для очень сильнозасоленных почв требуется 6-кратная обработка. Качественную пробу на Cl- проводят с AgNO3, на SO42- – с BaCl2. Если в процессе отмывания солей происходит пептизация коллоидов и помутнение раствора, то увеличивают время центрифугирования до 20-25 мин и его скорость до 6000-7000 об/мин. Чтобы предотвратить пептизацию коллоидов, рекомендуют отмывание солей прекратить, когда качественные пробы еще показывают крайне незначительные количества хлорид- и сульфат-ионов. После удаления солей вытесняют обменные катионы реактивом Пфеффера. В центрифужную пробирку приливают 25 мл 0,2 М NH4Cl в 70 %-ном этиловом спирте, тщательно перемешивают содержимое стеклянной палочкой и оставляют на 1 час. Затем суспензию центрифугируют (5 мин, 2000 об/мин). Центрифугат сливают в фарфоровую чашку и выпаривают на водяной бане. Операцию повторяют еще 3 раза, но уже при 30-минутном настаивании почвы с раствором. Центрифугаты сливают в ту же чашку и выпаривают. Чашку с осадком прокаливают в муфеле при температуре 350-400 0С до прекращения дымления. В чашку с прокаленным остатком добавляют 2-3 капли концентрированной HCl и около 10 мл горячей дистиллированной воды и смачивают этим раствором весь прокаленный остаток. Затем добавляют еще дистиллированную воду (20-80 мл) и полученный раствор фильтруют по стеклянной палочке в мерную колбу вместимостью 200 мл. Чашку и фильтр промывают горячей дистиллированной водой, количественно перенося содержащиеся в чашке соли в мерную колбу. Объем жидкости в колбе доводят дистиллированной водой до метки и тщательно перемешивают. В полученном растворе определяют концентрацию кальция и магния комплексонометрическим методом, натрия и калия на пламенном фотометре и вычисляют содержание каждого из обменных катионов в мг-экв на 100 г почвы. За емкость обмена принимают сумму всех обменных катионов. 2.2.2.5.1. Определение кальция комплексонометрическим методомХод анализа. Берут пипеткой по 25мл полученного раствора в две конические колбы вместимостью по 250 мл. Приливают в каждую по 75 мл дистиллированной воды, лишенной ионов Са2+ и Сu2+. Добавляют 5-10 капель водного раствора гидроксиламина (для устранения влияния марганца), 2-3 капли 1%-ного раствора сульфида натрия (для устранения влияния меди), 5 мл 10%-ного раствора КОН или NaOH (для доведения рН раствора до 12) и вносят деревянной лопаточкой смесь мурексида с NaCl (30 – 50 мг). Раствор должен окраситься в ярко-розовый цвет. Титруют содержимое одной из колб 0,01-0,05 н. раствором трилона Б до перехода ярко-розовой окраски в фиолетовую (лиловую). Титруют медленно при постоянном перемешивании. Отметив количество трилона Б, пошедшее на титрование, добавляют в колбу избыток трилона и титруют содержимое второй колбы, используя в качестве свидетеля первую колбу с перетитрованным раствором. 2.2.2.5.2. Определение суммы кальция и магния комплексонометрическим методом Ход анализа. В две конические колбы по 250 мл пипеткой вносят по 25 мл полученного раствора и приливают в каждую колбу по 75 мл дистиллированной воды, лишенной ионов кальция, магния и меди. Добавляют по 5-10 капель 1%-ного раствора солянокислого гидроксиламина по 2-3 капли 1%-ного раствора сульфида натрия, по 20 мл хлоридно-аммиачного буфера и вносят 30-50 мг индикаторной смеси хромогена черного с NaCl, раствор окрашивается в вишнево-красный цвет. Титруют содержимое одной из колб 0,01-0,05 н. раствором трилона Б. Вторая колба служит для сравнения окраски. При титровании раствор все время перемешивают. Вишнево-красный цвет жидкости вблизи точки эквивалентности приобретает лиловую окраску, после чего титруют медленно. Конец титрования устанавливают по появлению синего цвета с зеленоватым оттенком (сине-голубого). Повторяют титрование со второй колбой. Содержание Ca2+ и Mg2+ (в мг-экв.) вычисляют по формулам: где: Са2+ и Mg2+ – содержание ионов, мг-экв на 100 почвы; m0 – навеска воздушно-сухой почвы, взятая для приготовления вытяжки; V0 – общий объем фильтрата после разложения солей и растворения прокаленного остатка, мл; V1 – количество фильтрата взятого на титрование, мл; V2 – количество трилона Б пошедшее на титрование кальция, мл; V3 – количество трилона Б пошедшее на титрование суммы кальция и магния, мл; н. – нормальность трилона Б; Kн2о – коэффициент пересчета на сухую почву; 2 – коэффициент перевода атомов в мг-экв. 2.2.2.5.3. Определение натрия и калия методом фотометрии пламени Выполнение определения. Приводят прибор в рабочее состояние и фотометрируют серию эталонных растворов с концентрацией определяемых элементов от 2,5 до 100 мг/л. По показаниям прибора для этих растворов строят калибровочный график в координатах: отсчет по шкале прибора – концентрация элемента. Перед анализом растворов распылитель прибора промывают дистиллированной водой. Эту операцию повторяют после каждого измерения анализируемых проб. Концентрацию натрия и калия в анализируемом растворе находят по калибровочным графикам. Содержание натрия или калия в мг-экв/100 г почвы определяют по формуле: где а концентрация натрия или калия найденная по калибровочному графику, мг/л; V0 – общий объем фильтрата после разложения солей, мл; m – навеска почвы, взятая для приготовления вытяжки, г; 100 – коэффициент пересчета на 100 г почвы; 1000 – коэффициент пересчета в мл; ЭМ – эквивалентная масса Na+ (23) или К+ (39,1); Кн2о – коэффициент пересчета на сухую почву. Пример расчета. Навеска почвы, взятая для вытеснения обменных катионов равна 5 г. Объем фильтрата после разложения солей и растворения прокаленного остатка составил 200 мл. На титрование кальция и суммы кальция и магния взято по 25 мл фильтрата. На титрование кальция пошло 6,6 мл 0,01 н. раствора трилона Б, на титрование суммы кальция и магния – 7,9 мл 0,01 н. раствора трилона Б. Концентрация натрия найденная по калибровочному графику составила 15 мг/л, калия – 5 мг/л. Кн2о = 1,02. Содержание обменных катионов в мг-экв на 100 г почвы равно: Эффективная емкость обмена равна: Ca2+ + Mg2+ + Na+ + K+ = 21,54 + 4,24 + 2,66 + 0,52 = 28,96 мг-экв/100 г почвы. Реагенты: 1. 70%-ный этиловый спирт (этанол). К 730 мл 96%-ного этанола приливают 270 мл дистиллированной воды и перемешивают. 2. Реактив Пфеффера – 0,1 М NH4Cl в 70%-ном этаноле. 5,35 г NH4Cl растворяют в 270 мл дистиллированной воды и к полученному раствору приливают 730 мл 96%-ного этанола. Значение рН раствора доводят до 7, добавляя по каплям концентрированный аммиак. 2.2.3. Использование результатов определения катионообменной способности почв Данные, полученные при изучении катионообменной способности почвы, используют для дальнейших расчетов. С их помощью находят степень насыщенности почвы основаниями и степень солонцеватости почвы, рассчитывают дозы извести и гипса, необходимых для оптимизации реакции среды и состава обменных катионов. 2.2.3.1. Вычисление степени насыщенности почв основаниями Степенью насыщенности почв основаниями называется отношение суммы обменных оснований к емкости поглощения выраженное в процентах. В состав обменных катионов кислых почв наряду с поглощенными основаниями (главным образом Са и Мg) входят поглощенные ионы водорода и алюминия. Степень насыщенности показывает, какая часть от всех поглощенных катионов почвы приходится на поглощенные основания. Степень насыщенности основаниями вычисляют по формуле: где V – степень насыщенности почвы основаниями, %; S – сумма обменных оснований, мг-экв.; H – гидролитическая кислотность, мг-экв.; S+H – емкость поглощения кислых почв; 100 – коэффициент пересчета в проценты. По степени насыщенности основаниями почвы подразделяются на: сильноненасыщенные – V < 30% ненасыщенные – V = 30-50% слабонасыщенные – V = 50-80% насыщенные – V > 80%. Степень насыщенности основаниями используют для определения потребности почв в известковании. При степени насыщенности основаниями > 75% почвы не нуждаются в известковании при насыщенности основаниями < 50% потребность в известковании обычно высокая. Пример расчета. Анализировался пахотный горизонт дерново-подзолистой почвы. Сумма обменных оснований равна 5,0 мг-экв/ 100 г почвы, гидролитическая кислотность – 5,8 мг-экв/ 100 г почвы. Степень насыщенности почвы основаниями равна: Почва ненасыщенна основаниями и нуждается в известковании. 2.2.3.2. Расчет дозы извести Во многих регионах земного шара широко распространены почвы с кислой реакцией среды (подзолистые, дерново-подзолистые, серые лесные и др.). Кислая реакция среды обусловлена как ионами водорода почвенного раствора, так и обменными ионами водорода и алюминия. В кислых почвах создаются неблагоприятные условия для роста и развития большинства сельскохозяйственных культур, что ведет к снижению их урожайности. Негативное влияние повышенной кислотности на растения обусловлено различными причинами. Кислые почвы характеризуются недостатком Са2+ и отчасти Mg2+, элементов, необходимых для нормального развития растений. В тоже время содержание Al3+, Mn2+, Н+ часто достигает токсичных для сельскохозяйственных культур концентраций. Кислая реакция среды угнетающе действует на аммонификацию, нитрификацию и фиксацию азота из воздуха, ухудшая азотный режим почвы, поскольку оптимум рН для развития микрофлоры, определяющей эти процессы, находится в пределах 6,5-8,0. В кислых почвах складывается неблагоприятный фосфатный режим, что обусловлено связыванием фосфора соединениями железа и алюминия, в результате чего он переходит в труднодоступное для растений состояние. При подкислении почв существенно возрастает растворимость и подвижность бора, меди, цинка, кобальта и других микроэлементов. Избыточное количество их подвижных форм оказывает токсичное действие на растения. В тоже время высокая кислотность снижает доступность растениям такого важного микроэлемента как молибден. В кислой среде ухудшаются условия гумусообразования, что ведет к преимущественному накоплению фульвокислот и низкомолекулярных органических соединений, менее ценных с агрономической точки зрения, чем гуминовые кислоты. Низкое содержание и неблагоприятный состав гумуса, наряду с дефицитом кальция, обусловливают неудовлетворительные физические свойства кислых почв. Они часто переуплотнены, плохо оструктурены, склонны к коркообразованию, что неблагоприятно отражается на их водно-воздушном режиме. Эффективное использование сильнокислых и кислых почв возможно только после проведения химической мелиорации. Широко распространенным приемом повышения их плодородия служит известкование, устраняющее избыточную кислотность и способствующее насыщению ППК кальцием. При внесении в почву извести (СаСО3) она реагирует с углекислотой почвенного раствора и переходит в гидрокарбонат кальция, который взаимодействует с почвой:  + 2Сa(HCO3)2 + 2Сa(HCO3)2 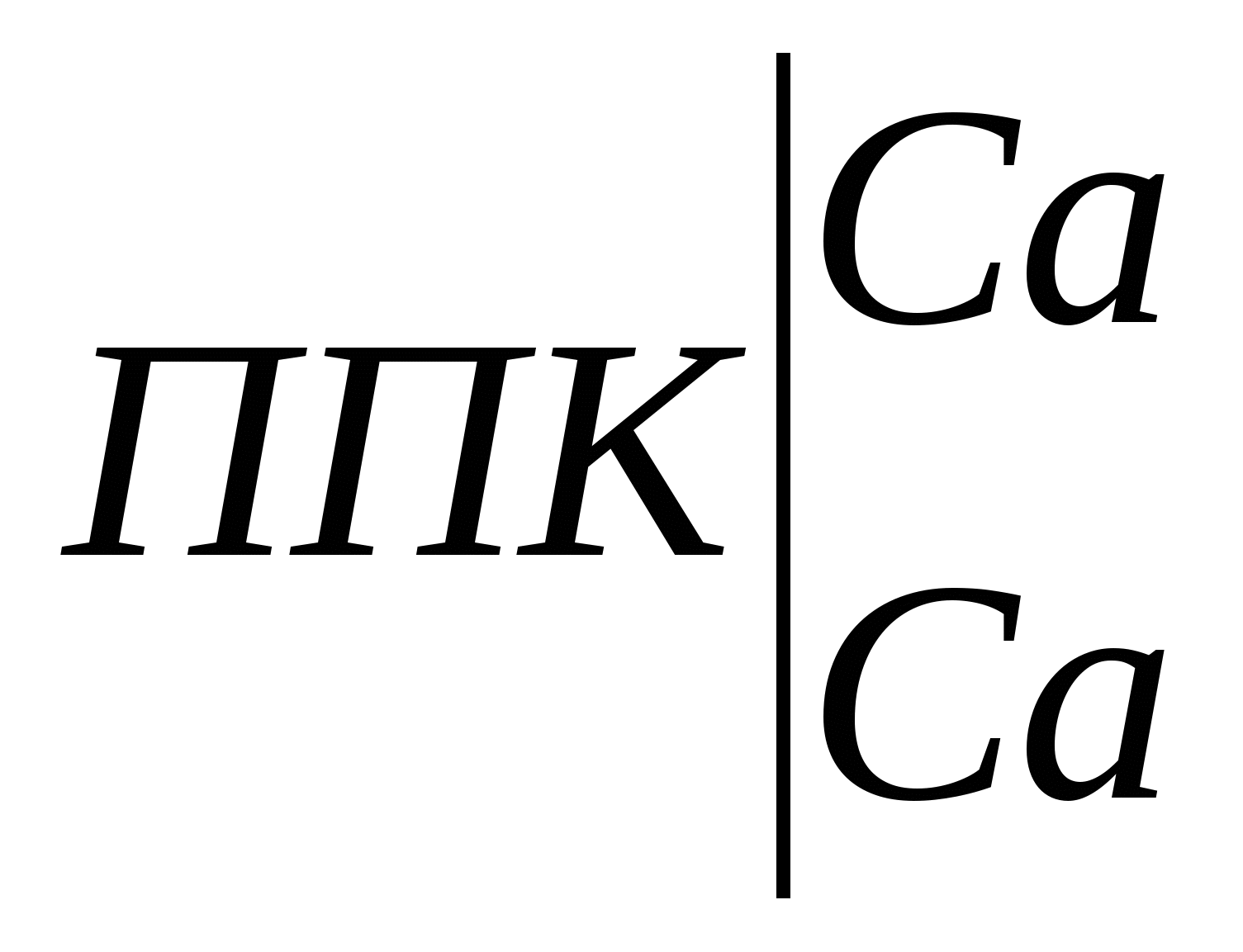 + H2O + 4CO2 + Al(OH)3 + H2O + 4CO2 + Al(OH)3Дозу извести, т/га, необходимую для оптимизации реакции среды, рассчитывают по величине гидролитической кислотности, которая рассматривается как суммарная кислотность почвы, состоящая из актуальной и потенциальной кислотности. Также необходимо знать мощность пахотного слоя и его плотность. Поскольку известь перемешивается со всем пахотным слоем необходимо найти его массу на площади 1 га по формуле: M = dv ∙ h ∙ 100, где M – масса пахотного слоя на площади 1 га, т/га; dv – плотность почвы, г/см3; h – мощность пахотного слоя, см; 100 – коэффициент пересчета. После этого находят количество ионов водорода, содержащихся в пахотном слое, и с учетом уравнения химической реакции нейтрализации рассчитывают дозу извести, т/га. Пример расчета. Мощность пахотного слоя равна 25 см, его плотность – 1,30 г/см3, гидролитическая кислотность – 5,2 мг-экв/100 г почвы. Масса пахотного слоя М = 1,30 ∙ 20 ∙ 100 = 2600 т. Поскольку в 100 г почвы содержится 5,2 мг-экв водорода, что соответствует 5,2 мг, то в 1 кг почвы будет содержаться 52 мг или 0,052 г водорода. Тогда во всем пахотном слое на площади 1 га содержание водорода составит: 0,052 ∙ 2 600 000 = 135 200 г, или 135,2 кг. На нейтрализацию 1 кг водорода требуется 50 кг извести, что вытекает из уравнения химической реакции: 2Н+ + СаСО3 = Са2+ + Н2О + СО2. Следовательно, доза извести составит 135,2 ∙ 50 = 6760 кг, или 6,8 т/га. Если известковые материалы содержат инертные примеси и имеют повышенную влажность, то дозу извести, т/га, находят по формуле: где Д – доза извести, т/га; НГ – гидролитическая кислотность, мг-экв/100 г почвы; dV – плотность почвы, г/см3; h – мощность слоя, см; W – влажность мелиоранта, %; DB – содержание действующего вещества в мелиоранте, %. 2.2.3.3. Вычисление степени солонцеватости почв Почвы, насыщенные основаниями могут содержать избыточное количество обменного натрия, отрицательно влияющего на их плодородие. Степень солонцеватости почв устанавливается по формуле: где А – степень солонцеватости, % от емкости обмена; Na – содержание обменного натрия, мг-экв на 100 г почвы; Е – емкость обмена, мг-экв на 100 г почвы. Различают несолонцеватые почвы, содержащие менее 3 % натрия от емкости обмена; слабосолонцеватые – 3-5 %; среднесолонцеватые – 5-10 %; сильносолонцеватые – 10-15 % и солонцы, которые по содержанию обменного натрия в горизонте В1 подразделяются на: малонатриевые – 10-20 %; средненатриевые – 20-40 %; многонатриевые – > 40 %. Пример расчета. При анализе каштановой почвы получены следующие данные: содержание обменного натрия в пахотном слое мощностью (h) 25 см и плотностью (dV) 1,39 г/см3 составило 2,8 мг-экв на 100 г почвы, емкость обмена – 20 мг-экв на 100 г почвы. Степень солонцеватости равна: Почва относится к сильносолонцеватой и нуждается в химической мелиорации. 2.2.3.4. Расчет дозы гипса В южных регионах широко распространены почвы, содержащие в почвенном поглощающем комплексе обменный натрий (обыкновенные и южные черноземы, каштановые почвы и др.). По мере увеличения доли натрия в составе обменных катионов происходит ухудшение агрономических свойств почв. Наименее благоприятными агрономическими свойствами характеризуются многонатриевые солонцы. Насыщение ППК ионами натрия сопровождается увеличением щелочности и заряда коллоидов, растворением гумусовых веществ и пептизацией тонкодисперсных частиц. Высокая щелочность неблагоприятна для большинства сельскохозяйственных культур. В условиях щелочной среды нарушается обмен веществ в растениях, снижается растворимость и доступность фосфатов, соединений железа, меди, марганца, бора и цинка. При щелочной реакции в почвенном растворе появляется ряд токсичных для растений веществ, в частности, сода и алюминаты натрия (NaAl(OH)4). По мере увеличения доли Na+ в составе обменных катионов усиливается разрушение почвенной структуры, возрастает распыленность почвы, ее набухание и пластичность, уменьшается пористость, особенно некапиллярная. Существенно снижается скорость фильтрации вплоть до полной водонепроницаемости солонцового горизонта. Во влажном состоянии солонцы и сильносолонцеватые почвы отличаются повышенной вязкостью и липкостью, а в сухом состоянии они очень твердые и плотные. Все это в итоге сопровождается заметным ухудшением водно-воздушного режима солонцовых почв и их технологических свойств. Эффективным приемом улучшения свойств солонцов и солонцеватых почв является химическая мелиорация. В качестве химического мелиоранта чаще всего используется гипс (СаSO4 . 2Н2О). При внесении гипса в почву происходит замещение в почвенном поглощающем комплексе обменного натрия на кальций согласно реакции: 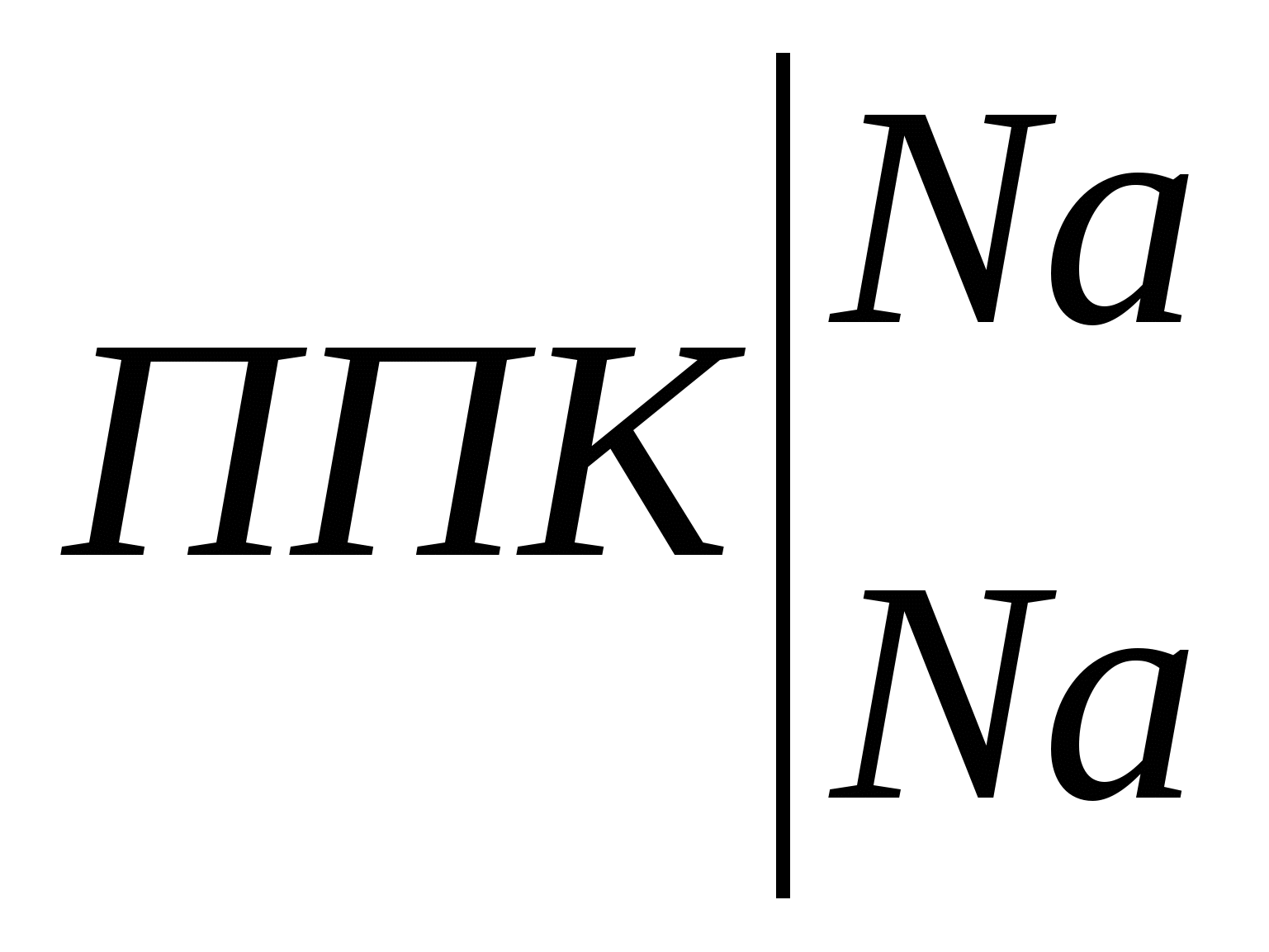 + CaSO4 + CaSO4 Образующийся в результате реакции сульфат натрия удаляют путем влагонакопительных мероприятий или промывок. Дозу гипса находят по формуле: где Д – доза гипса, т/га; 0,086 – значение 1 мг-экв гипса; Na – содержание обменного натрия, мг-экв на 100 г почвы; Е – емкость обмена, мг-экв на 100 г почвы; 0,05 – количество обменного натрия (в % от емкости обмена) не оказывающее отрицательного влияния на свойства почвы и оставляемое в ППК; h – мощность мелиорируемого слоя, см; dV – плотность сложения мелиорируемого слоя, г/см3; DB - содержание CaSO4 . 2Н2О в мелиоранте, %. Пример расчета. Содержание обменного натрия в пахотном слое мощностью 25 см каштановой сильносолонцевотой почвы – 2,8 мг-экв/100 г почвы. Емкость обмена – 20 мг-экв/100 г почвы, плотность почвы – 1,39 г/см3. Содержание гипса в мелиоранте – 75 %. Доза гипса необходимая для мелиорации составит: Контрольные вопросы 1. Что представляет собой ионно-солевой комплекс почв? 2. Какое влияние оказывают водорастворимые соли на культурные растения? 3. Какие показатели определяют при анализе водной вытяжки? 4. Какие методы используют при анализе водной вытяжки? 5. Для каких целей используют данные анализа водной вытяжки? 6. Что представляет собой Катионообменная способность почв? 7. Какие методы используют при изучении катионообменной способности почв? 8. Для каких целей используют данные по катионообменной способности почв? Литература 1. Аринушкина Е.В. Руководство по химическому анализу почв. – М.: Изд-во МГУ, 1970. 2. Базилевич Н.И.. Панкова Е.И. Учет засоленных почв //Методические рекомендации по мелиорации солонцов и учету засоленных почв. – М.: Изд-во Колос, 1970. 3. Боровский В.М., Соколенко Э.А. Теоретические основы процессов засоления-рассоления почв. – Алма-Ата.: Изд-во Наука, 1981. 4. Мамонтов В.Г. Интерпретация данных водной вытяжки из засоленных почв. – М.: Изд-во МСХА, 2002. 5. Мякина М.Б., Аринушкина Е.В. Методическое пособие для чтения результатов химических анализов почв. – М.: Изд-во МГУ, 1979. 6. Руководство по лабораторным методам исследования ионно-солевого состава нейтральных и щелочных минеральных почв. – М.: Изд-во ВАСХНИЛ, 1990. 7. Теория и практика химического анализа почв (под ред. Воробьевой Л.А.). – М.: Изд-во ГЕОС, 2006. РАЗДЕЛ III. ОРГАНИЧЕСКОЕ ВЕЩЕСТВО ПОЧВЫ Органическое вещество почвы – совокупность всех компонентов органической природы, присутствующих в почвенном профиле, за исключением тех, которые входят в состав живых организмов. Важнейшей составной частью органического вещества почвы является гумус – сложный динамический комплекс органических соединений, образующихся при разложении и гумификации органических остатков. В состав гумуса входят специфические гумусовые вещества, промежуточные продукты распада и гумификации и неспецифические органические соединения (рис.3). С содержанием и составом гумуса тесно связаны многие признаки и свойства почв: окраска, оструктуренность, теплоемкость, водоудерживающая и сорбционная способность, а также буферность почв к природным и антропогенным воздействиям. В гумусовых горизонтах более 90% всего азота, значительная часть фосфора, серы и микроэлементов находится в составе органических соединений. Поэтому при интенсивном использовании агроценозов регулирование гумусового состояния почв является важнейшим фактором их устойчиво высокой продуктивности. Содержание и запасы гумуса, его распределение по профилю используются при диагностике и классификации почв и для оценки их потенциального плодородия. Изучение органической части почвы сопряжено с определенными трудностями, что обусловлено гетерогенностью и полидисперсностью системы органических веществ почвы, а также длительностью самого процесса гумификации. Кроме того, в почве преобладающая часть гумусовых веществ связана с катионами металлов, оксидами, гидроксидами и алюмосиликатами, образуя различные органо-минеральные соединения и адсорбционные комплексы, что также затрудняет их изучение. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
