ПРАКТИЧЕСКОЕ РУКОВОДСВО ПО ХИМИИ ПОЧВ. Руководство по химии почв учебное пособие
 Скачать 2.43 Mb. Скачать 2.43 Mb.
|
|
РАЗДЕЛ II. ИОННО-СОЛЕВОЙ КОМПЛЕКС ПОЧВ Ионно-солевой комплекс почв представляет собой всю совокупность ионов и солей, находящихся в разных формах – жидкой (в почвенном растворе), твердой (кристаллические водорастворимые соли), сорбированной почвенным поглощающим комплексом (обменные ионы) и связанных между собой динамическим равновесием (рис. 1). 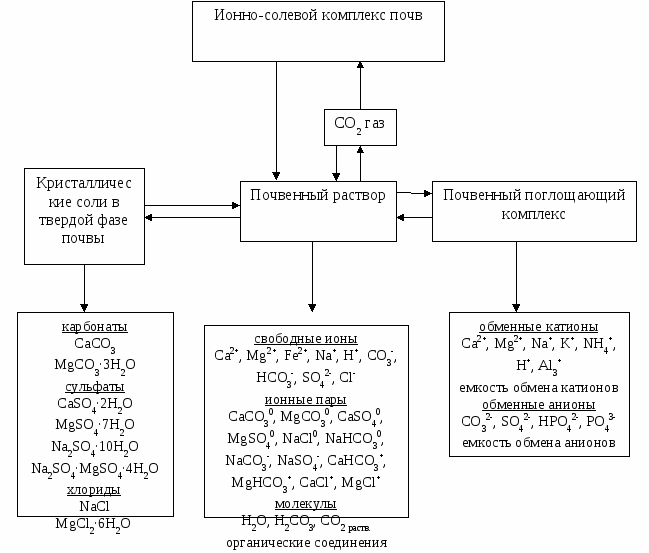 Рис. 1. Схема ионно-солевого комплекса почв Сдвиг равновесия в ту или иную сторону может происходить под влиянием различных факторов: в результате изменения температуры и влажности почвы (физическое испарение, транспирация, выпадение атмосферных осадков, орошение), изменения парциального давления СО2, поглощения и выделения растениями и микроорганизмами химических элементов и соединений, внесения удобрений и химических мелиорантов и др. Количественное соотношение между формами ионно-солевого комплекса зависит от свойств почв. В незасоленных почвах преобладающая часть ионов находится в обменно-поглощенном состоянии. В почвах развитых на сиаллитных корах в обменном состоянии находятся преимущественно катионы, поскольку доля положительных зарядов, в почвенном поглощающем комплексе обусловливающих поглощение и удержание анионов не превышает 5% от суммы отрицательных зарядов определяющих поглощение и удержание катионов. По мере увеличения степени засоления почвы доля катионов находящихся в поглощенном состоянии снижается. В гипотетической модели засоленной почвы полученной американскими исследователями на основании статистического обобщения материалов по засоленным почвам распределение ионов между различными формами ионно-солевого комплекса было следующим: почвенный раствор – 10%, кристаллические соли твердой фазы – 50%, обменные катионы – 40% (Wagenet R.J. e. a., 1980). С ионно-солевым комплексом почв непосредственно связаны реакция среды, концентрация и химизм почвенного раствора, состав обменных катионов, условия произрастания растений. Для изучения ионно-солевого комплекса почв используют различные приемы и методы: выделение и анализ почвенного раствора, метод водной вытяжки, метод насыщенных водой почвенных паст, определение содержания гипса и карбонатов, определение катионообменной способности почвы. 2.1. Метод водной вытяжки Водная вытяжка принадлежит к числу методов, широко используемых в почвенных исследованиях. Она в определенной мере имитирует вещественный состав почвенного раствора, поэтому с помощью водной вытяжки можно получить представление о содержании и составе наиболее подвижных компонентов почвы. Вещества, извлекаемые водной вытяжкой, как правило, способны к миграции. Они могут оказывать прямое влияние на рост и развитие растений. В связи с этим метод водных вытяжек часто используют при исследовании динамики почвенных процессов, изучении режима различных элементов, в том числе и питательных веществ, оценки количества различных токсикантов, могущих накапливаться в почве, включая и колины (вещества органической природы) являющиеся одним из факторов почвоутомления, а также для решения других задач. Однако в первую очередь этот метод применяется для анализа засоленных почв. К засоленным относятся почвы, содержащие в каком-либо горизонте почвенного профиля легкорастворимые соли в количествах токсичных для среднесолеустойчивых культур. К типичным представителям засоленных почв относятся солончаки (автоморфные и гидроморфные), характеризующиеся высоким содержанием солей в пределах всего профиля часто с максимумом их на поверхности, где они образуют солевую корку. Кроме собственно солончаков в засушливых и аридных регионах засолению могут быть подвержены черноземы, каштановые, бурые полупустынные почвы, сероземы и их полугидроморфные аналоги. Особую группу засоленных почв представляют солонцы и солонцеватые почвы, в которых процесс засоления сопряжен с солонцовым процессом. В природных условиях типы засоления образуют определенные географические ареалы. Так содовое засоление характерно в основном для лесостепной зоны и в меньшей степени для степной; сульфатное встречается в степной и сухостепной зонах; хлоридно-сульфатное и сульфатно-хлоридное засоление доминирует в полупустынных и пустынных регионах; хлоридное характерно для приморской части Прикаспийской низменности. Формирование засоленных почв является следствием континентального, приморского и дельтового соленакопления. Континентальное соленакопление связано с движением, перераспределением и аккумуляцией солей, высвобождающихся при выветривании и почвообразовании, во внутриматериковых бессточных областях. Приморское соленакопление происходит в результате аккумуляции морских солей в прибрежно-морских низменностях и по берегам мелководных заливов. Дельтовое соленакопление обусловлено привносом солей с континента рекой и долинно-дельтовым грунтовым потоком, а также поступлением их со стороны моря. В агроландшафтах засоление почв может происходить под влиянием орошения. Источником солей часто являются минерализованные оросительные воды. Кроме того, орошение, особенно при техническом несовершенстве оросительных систем, сопровождается подъемом грунтовых вод выше критического уровня, что приводит к вторичному засолению почв. При этом засолению подвергаются не только орошаемые угодья, но и сопряженные территории. 2.1.1. Влияние солей на сельскохозяйственные культуры Засоление почв сопровождается снижением урожайности сельскохозяйственных культур, вплоть до их гибели. Между количеством солей, аккумулирующихся в почве (степень засоления), и состоянием сельскохозяйственных культур наблюдается отчетливо выраженная зависимость (табл. 9). Таблица 9. Влияние степени засоления почв на состояние сельскохозяйственных культур (В.А.Ковда, В.В.Егоров, В.С.Муратова, Б.П.Строганов, 1960).
Угнетение растений под влиянием солей может быть вызвано следующими причинами: 1) увеличение концентрации и осмотического давления почвенного раствора сверх критических значений; 2) токсичное действие отдельных ионов на растения; 3) нарушение условий питания растений. Осмотические эффекты, как следствие повышения концентрации почвенного раствора является основным фактором угнетения растений на засоленных почвах. В основе поглощения воды корнями растений лежит явление осмоса, в соответствии с которым вода стремится перейти из раствора с меньшей концентрацией вещества в раствор с большей его концентрацией. Если сосущая сила корней равна или меньше осмотического давления почвенного раствора, то растения не могут поглощать почвенную влагу, обезвоживаются и погибают. Согласно исследованиям американских ученых (L.A. Richards, 1968), зависимость между осмотическим давлением и концентрацией почвенного раствора можно выразить следующим приближенным уравнением: Р = 5,6 ∙ 10-5 ∙ С , где Р - осмотическое давление почвенного раствора, МПа; С - суммарное содержание солей в почвенном растворе, мг/л. Осмотическое давление почвенных растворов варьирует в широких пределах, от 0,03-0,05 до 0,1-0,2 МПа в незасоленных черноземах и каштановых почвах до 10,0-30,0 МПа в солончаках. Водоудерживающая способность незасоленных почв возрастает по мере их иссушения и при достижении ею 1-2 МПа наблюдается устойчивое завядание большинства сельскохозяйственных культур. Накопление солей, увеличивающих осмотическое давление почвенного раствора, приводит к "физиологической сухости" почвы. В таких условиях растения, несмотря на достаточную влажность почвы, не могут получить необходимое количество воды (табл. 10). Таблица 10. Зависимость между влажностью, степенью засоления и водоудерживающей способностью почв (В.С. Шардаков, 1953)
Сельскохозяйственные растения проявляют неодинаковую чувствительность к величине осмотического давления почвенного раствора. Как считают D.W. Thorne H.B. Peterson (1954), у чувствительных культур угнетение может наблюдаться уже при значениях осмотического давления в пределах 0,07-0,15 МПа, у менее чувствительных при 0,15-0,30 МПа. Когда значения осмотического давления достигают 0,3-0,6 МПа, урожайность многих культур резко снижается и большинство растений гибнет. Лишь немногие культурные растения устойчивы к осмотическому давлению почвенного раствора свыше 0,61 МПа. Под влиянием высоких концентраций солей в почве изменяется и отношение растений к внешним условиям. Такие, например, факторы, как температура и свет, положительно влияющие на развитие растений в нормальных условиях, при засолении могут действовать отрицательно. Токсичность ионов. Избыток определенных ионов может оказаться токсичным для протекания различных физиологических процессов в растениях. Токсичное действие солей на растения связано с нарушением водного режима и подавлением фотосинтеза, с общим нарушением нормальных физиологических функций растений. Согласно исследованиям Б.П. Строганова (1958), под влиянием солей у растений может изменяться азотный обмен в сторону накопления такого промежуточного продукта, как путресцин. Путресцин - ядовитое органическое вещество, его токсичность в 5-10 раз превышает токсичность хлористого натрия. Б.П. Строгановым установлено, что при хлоридном засолении у растений снижается интенсивность дыхания, фотосинтеза и деятельность ряда ферментов, а также замедляется поглощение и расход воды в процессе транспирации. Когда листья древесных растений накапливают более 0,5 % Cl- или 0,2 % Na+ (в процентах от сухой массы), обычно происходит характерное обгорание края листа или образуются некрозы. Наиболее чувствительные к хлору растения могут повреждаться, если содержание Cl- в почвенном растворе превышает 5-10 мг-экв/л, в то время как наиболее устойчивые к действию хлора растения получают повреждения лишь при концентрации его выше 30 мг-экв/л. Очень токсична для растений сода. При ее появлении в почвенном растворе происходит резкое подщелачивание среды, что негативно сказывается на корневой системе растений. Корни испытывают своеобразный "щелочной ожог", в результате которого корневые волоски теряют тургор, сморщиваются и отмирают. Это нарушает нормальное функционирование корневых систем растений в целом. Нарушение условий питания. Для нормального роста и развития растений требуется, чтобы в почве имелись все необходимые питательные вещества в оптимальных для конкретной культуры соотношениях. Нарушение этого условия устраняется за счет внесения удобрений. Однако при засолении почвы не всегда удается достичь требуемого результата, поскольку водорастворимые соли вносят существенные коррективы в закономерности поступления химических элементов в растения. Например, по данным В.А. Ковды (1961), в растениях, угнетенных под влиянием засоления, по сравнению с нормально развитыми значительно возрастает содержание ряда элементов – SiO2 в 4-5 раз, Al2О3 и P2О5 в 3-5 раз, Cl в 2-3 раза, Mg и Na в 2,6 раза. При этом наблюдается недостаточное поступление таких важных элементов минерального питания растений, как Са, Fe, K, Mn, и сера. На поступление элементов в растения влияет не только общее содержание солей в почве, но и их химизм. Как показали исследования Б.П. Строганова (1962), у растений в условиях сульфатного засоления по сравнению с хлоридным увеличивается содержание P2О5, K, Mg, SiO2, SО4 и снижается количество Na, Fe2О3, Al2О3, Cl. При сульфатно-хлоридном засолении уменьшается поступление фосфора в растения по сравнению с хлоридно-сульфатным, а сильное хлоридное засоление ограничивает поступление в сельскохозяйственные культуры нитратов. В результате снижается эффективность соответствующих минеральных удобрений. Нарушение условий питания сельскохозяйственных растений при аккумуляции в почве легкорастворимых солей может быть обусловлено различными причинами. Например, высокая концентрация солей в почвенном растворе снижает степень диссоциации и способствует выпадению ряда элементов из раствора в осадок в виде труднодоступных соединений. Так, в почвах, с щелочной средой, будет существенно ограничиваться подвижность Са, Fe и многих микроэлементов вследствие образования карбонатов. При засолении почв резче проявляется антагонизм ионов. В частности, избыточное накопление в почвенном растворе иона натрия, будет препятствовать поступлению в растения Са2+, Mg2+, K+ и других катионов. Токсичное влияние солей связано с повреждением цитоплазмы клеток, в результате чего, избирательное поглощение химических элементов сменяется пассивным и приводит к ненормально высокому накоплению солей в органах растения. Солевое отравление растений внешне проявляется в образовании на отдельных участках листьев солевых пятен. Пораженные участки листьев теряют зеленую окраску и приобретают светло-желтый оттенок. Это свидетельствует о глубоком воздействии солей на процессы метаболизма и фотосинтеза зеленого листа. Образование таких своеобразных солевых ожогов у растений сопровождается нарушением связи молекул хлорофилла с белками хлоропластов и последующем разрушением хлорофилла (Б.П. Строганов, Е.Ф. Иваницкая, 1954). 2.1.2. Достоинства и недостатки водной вытяжки как метода изучения засоленных почв Для анализа засоленных почв водная вытяжка имеет исключительное значение, поскольку позволяет оценить наиболее важную их генетико-агро-номическую особенность – содержание и состав водорастворимых солей аккумулирующихся в почвах. Суть метода водной вытяжки заключается в кратковременном (3 мин.) взаимодействии почвы и дистиллированной воды, взятых в соотношении 1 : 5. При этом происходит растворение легкорастворимых солей. Частично растворяются средне- и труднорастворимые соли. Труднорастворимые соли представлены карбонатами кальция и магния (CaCO3, MgCO3 ∙ 3H2O), среднерастворимые соли – гипсом (CaSO4 ∙ 2H2O). Эти соли часто формируют в профиле почв южных регионов довольно мощные аккумулятивные карбонатные и гипсовые горизонты. Из легкорастворимых солей в почвах чаще всего присутствуют карбонат и гидрокарбонат натрия (Na2CO3 и NaHCO3), гидрокарбонаты кальция и магния [Са(НСО3)2, Mg(HCO3)2], хлориды натрия, магния и кальция (NaCl, MgCl2, CaCl2), сульфаты натрия и магния (Na2SO4, MgSO4). В ряде случаев встречаются очаги боратного и нитратного соленакопления. Наиболее детальную характеристику засоленной почвы дает полная водная вытяжка, когда определяются сухой (плотный) остаток, прокаленный остаток, главные анионы - СО32-, НСО3-, SO42-, Cl- и катионы - Са2+, Mg2+, Na+, K+. Следует иметь ввиду, что в почвах с щелочной реакцией среды в водной вытяжке могут обнаруживаться заметные количества кремнекислоты, алюминатов, органических веществ. Кроме того, в нее переходят водорастворимые фосфаты, соединения азота и микроэлементы, что отражается на величине сухого остатка. Иногда ограничиваются сокращенной водной вытяжкой. В этом случае определяют сухой остаток, а также основные анионы и катионы. Например, применительно к провинции хлоридного засоления иногда бывает достаточным ограничить анализ водной вытяжки определением сухого остатка, натрия и хлора. Но необходимо учесть, что в этом случае значительная часть информации, которую можно получить остается за рамками анализа. Результаты анализа водной вытяжки используются, для того чтобы получить ответы на следующие вопросы: 1. Какова величина общего содержания в почве водорастворимых солей и соответственно степень ее засоления? 2. Каков качественный и количественный состав этих солей? 3. Каково содержание и состав токсичных солей? 4. Какой тип засоления присущ анализируемой почве? 5. Какую стадию засоления или рассоления испытывает почва? 6. Как складывается солевой режим почвы, территории, каковы мелиоративные прогнозы? Прежде чем ответить на поставленные вопросы рассмотрим достоинства и недостатки водной вытяжки, как метода исследования засоленных почв. К несомненным достоинствам этого метода следует отнести вид используемого экстрагента. Применение дистиллированной воды по существу имитирует воздействие на почву атмосферных осадков, то есть в какой-то степени воссоздается природная ситуация. Благодаря этому исключается трансформация органической и минеральной части почвы, что наблюдается при использовании в почвенных исследованиях таких экстрагентов как кис-лоты и щелочи. При анализе солончаков и сильнозасоленных почв процесс фильтрации протекает очень быстро. В результате, за весьма короткое время можно получить необходимое для работы количество фильтрата. Этот метод применим для любых почв, независимо от их генезиса и особенностей сельскохозяйственного использования. Для приготовления вытяжки не требуется специальная подготовка почвы и оборудование. При необходимости водная вытяжка может быть получена из почвы, имеющей полевую влажность. Вместе с тем, данный метод имеет и ряд недостатков, которые могут существенно повлиять на адекватность полученных результатов. Главным недостатком водной вытяжки является принятое в методе широкое отношение почва : раствор, которого не бывает в природной обстановке. В результате в фильтрат переходят не только легкорастворимые соли, но и менее растворимые компоненты. Это было показано в свое время еще К.К.Гедройцем (табл. 11). Таблица 11. Извлечение минеральных веществ из различных по составу почв (К.К.Гедройц, 1955).
В случае натриевого солончака уже при соотношении почва : вода равном 1 : 1 в вытяжку переходят все легкорастворимые соли. Увеличение этого отношения вплоть до 1 : 20 лишь снижает концентрацию солей в водной вытяжке, не отражаясь на их содержании в почве. Иная картина наблюдается в случае взаимодействия воды с почвой, содержащей гипс. Количество гипса в растворе лимитируется его растворимостью. Изменение отношения почва : вода не отражается на концентрации гипса в растворе, она остается постоянной. Количество же гипса извлекаемого из почвы будет увеличиваться по мере расширения отношения почва : вода. То есть, чем больший объем воды воздействует на почву, тем больше гипса будет из нее извлекаться. Аналогичная картина будет наблюдаться и в отношении карбонатов кальция и магния. Уже из этого следует, что химический состав водной вытяжки не аналогичен почвенным растворам, циркулирующим в профиле засоленных почв. Следующее обстоятельство связано с тем, что как только в вытяжку переходят легкорастворимые соли, на почву начинает действовать уже не вода, а солевой раствор. В таких условиях растворимость некоторых солей изменяется. В частности, в смеси солей с разноименными ионами повышается растворимость компонента, обладающего более низкой растворимостью. Причина этого – диссоциация солей и образование новых, более растворимых соединений из комбинаций тех же катионов и анионов в результате химической реакции обмена ионами. Как отмечал В.А.Ковда (1968), в воде гипс растворяется в количестве около 2 г/л, в растворе же хлористого натрия содержание его может достигать 7,0 г/л благодаря следующей реакции: CaSO4 + 2NaCl ↔ CaCl2 + Na2SO4 Следовательно, при высоком содержании в почве хлоридов натрия и магния и наличии в твердой фазе гипса, может происходить дополнительное поступление в вытяжку ионов Са2+ и SO42- за счет увеличения растворимости гипса. В то же время присутствие в составе легкорастворимых солей хлористого кальция подавляет растворимость гипса. Следует учитывать и тот факт, что в природной обстановке твердая фаза почвы находится в динамическом равновесии с почвенным раствором, от химизма которого зависит и состав обменных катионов ППК. При получении водной вытяжки создается совершенно иная ситуация. В общих чертах ее можно характеризовать как сильное разбавление почвенного раствора. Это сопровождается заменой обменного натрия на ионы Ca и Mg раствора. Причем, как показывают экспериментальные данные, чем выше степень разбавления почвенного раствора, тем сильнее выражено вытеснение обменного натрия из ППК и соответственно поглощение ионов Са2+ и Mg2+ из раствора. Десорбция обменного натрия сопровождается увеличением рН, общей щелочности и растворимости органического вещества, что отражается на результатах анализа водной вытяжки. Следует отметить так же неадекватность данных водной вытяжки почвенному раствору при естественной влажности в отношении содержания карбонатов. В отличие от хлоридов и сульфатов карбонатная группа более сложная и подвижная и определяется рядом равновесий: CO2 газ ↔ CO2 раствр.+Н2О ↔Н2СО3 ↔ Н+ + НСО3- ↔ Н-+ СО32- ↔ Са2+, Mg2+ <–––––––> СаСО3 тв., MgCO3 . 3H2Oтв. Изменение любого компонента этой системы вызывает перестройку всех карбонатных групп. Для почвенных образцов эта перестройка начинается сразу же после их отбора. Высушивание почвы до воздушно-сухого состояния сопровождается переходом ионов раствора в твердую фазу. Для карбонатных групп этот процесс идет по следующей схеме: Са2+ + СО32- → СаСО3тв; Mg2++ CO32-→ MgCO3 . 3H2Oтв. В результате выхода из раствора СО32- происходит распад гидрокарбонатного иона НСО3- → Н+ + СО32-, а с другой стороны, благодаря избытку водорода и наличия ионов НСО3- – к образованию углекислоты, распадающейся на воду и диоксид углерода: Н+ + НСО3- ↔ Н2СО3 → Н2О + СО2↑ Благодаря этому процессу при высушивании почвы потери СО2 могут доходить до 50% от общего содержания ионов НСО3-, находившихся в почвенном растворе (В.С.Самарина, 1977). В процессе получения водной вытяжки происходит обратный процесс растворения карбонатов, сопровождающийся поглощением СО2 из атмосферы. Количество СО2, поглощенное при этом может быть меньше, больше или равно его количеству выделившемуся при сушке образца. Ошибка будет соответствовать величине поглощенного (потерянного) СО2, оценить которую практически невозможно. В первую очередь это относится к карбонатным почвам, для которых ошибка за счет поглощения (выделения) СО2 может достигать 100% (В.М.Боровский, Э.А.Соколенко, 1981). Вполне очевидно, что в этом случае водная вытяжка будет давать совершенно неверную информацию о содержании почве карбонатных групп. Большие трудности возникают при получении водной вытяжки из солонцеватых почв и особенно солонцов. Это связано с сильной пептизацией почвы и очень медленной фильтрацией, причем фильтрат практически всегда оказывается, загрязнен коллоидными частицами. Поэтому при анализе таких почв необходимо прибегать к центрифугированию вытяжки используя центрифуги со скоростью вращения не менее 6 тыс. об/мин. для отделения коллоидов. В противном случае они существенно завышают величину сухого остатка. Однако, несмотря на отмеченные недостатки, водная вытяжка до настоящего времени остается базовым методом изучения засоленных почв. Данные, полученные с ее помощью, широко используются для генетической диагностики почв, в агрономической и мелиоративной практике. 2.1.3 Анализ водной вытяжки Отвешивают на технохимических весах 50 или 100 г воздушно-сухой почвы, просеянной через сито с диаметром отверстий 1 мм, переносят ее в колбу и приливают 250 или 500 мл дистиллированной воды, лишенной CО2. Закрывают колбу пробкой, взбалтывают содержимое 3 мин и фильтруют вытяжку через плотный складчатый фильтр. Нельзя допускать, что бы фильтр был выше воронки, так как в этом случае по краю фильтра образуется «выцветы» солей, и концентрация их в фильтрате уменьшится. К анализу вытяжки приступают по окончании фильтрации, поскольку состав первой и последующих порций фильтрата может быть различным в отношении некоторых компонентов. Анализ вытяжки начинают с определения карбонатной и общей щелочности, поскольку щелочность при стоянии вытяжки может изменяться. При необходимости сразу же определяют рН вытяжки. 2.1.3.1. Определение величины рН водной вытяжки Определение проводят в фильтрате, или что более правильно, в суспензии до фильтрования вытяжки. Для этого отбирают в химический стаканчик 10-20 мл суспензии (фильтрата) и определяют рН с помощью рН-метра. Это определение следует выполнять в первую очередь, так как при стоянии вытяжки величина рН меняется. 2.1.3.2. Определение величины сухого остатка Ход анализа. Берут пипеткой 50 мл водной вытяжки, переносят в заранее просушенную и взвешенную на аналитических весах небольшую фарфоровую чашку и выпаривают досуха на водяной бане. Чашку снаружи протирают, а затем просушивают в сушильном шкафу при температуре 105°С до постоянной массы. Охлажденную в эксикаторе чашку с остатком взвешивают на аналитических весах. Величину сухого остатка находят по формуле: где: m1 – сухой остаток в % от массы почвы; А – масса чашки с сухим остатком, г; Б – масса пустой чашки, г; V0 – общий объем водной вытяжки, мл; V1 - объем фильтрата, взятый на выпаривание, мл; · m0 – навеска почвы, взятая для приготовления водной вытяжки, г; Kн2о – коэффициент пересчета на абсолютно сухую почву; 100 – коэффициент пересчета на 100 г почвы. Пример расчета. Для приготовления водной вытяжки к 100 г почвы добавлено 500 мл дистиллированной воды. Для выпаривания взято 50 мл водной вытяжки. Масса пустой чашки – 15,0485 г, масса чашки с сухим остатком – 15,1849 г. Kн2о =1,07. Сухой остаток равен: 2.1.3.3. Определение величины прокаленного остатка Прокаленный остаток позволяет судить об общем количестве водорастворимых минеральных компонентов, перешедших в водную вытяжку. Высушенный и взвешенный сухой остаток прокаливают в той же чашке в муфельной печи при температуре 600 оС. Первое прокаливание проводят в течение 10-15 минут, с момента достижения указанной температуры. Если за это время остаток не побелеет, чашку охлаждают и смачивают ее содержимое несколькими каплями дистиллированной воды. Подсушивают остаток на водяной бане и снова ставят в муфельную печь. После полного сгорания органических веществ чашку охлаждают в эксикаторе и взвешивают. Величину прокаленного остатка находят также как и сухого остатка. В темноокрашенных и мутных вытяжках прокаленный остаток используют для определения SO42-, Cl-, Са2+ и Mg2+ (Е.В.Аринушкина, 1970). 2.1.3.4. Определение щелочности от растворимых карбонатов Щелочность от растворимых карбонатов характерна для водных вытяжек из содовых солонцов и содовых солончаков. В карбонатных почвах эта щелочность в какой-то мере может быть обусловлена углекислым магнием. Ход анализа. К 25-50 мл водной вытяжки, помещенным в коническую колбу, прибавляют 2 капли фенолфталеина. Если раствор окрашивается в розовый цвет, то его титруют, в зависимости от интенсивности окраски, 0,01 н. или 0,02 н. раствором H2SO4 до обесцвечивания. Слабоокрашенные вытяжки титруют со «свидетелем», в качестве которого служит колба с таким же количеством вытяжки, как и анализируемая проба, но без фенолфталеина. Титрование ведут до момента, когда цвет вытяжки в обеих колбах станет одинаковым. Нейтрализация Na2CO3 по фенолфталеину идет до гидрокарбоната натрия, то есть Na2CO3 оттитровывается лишь на половину. Поэтому общее количество ионов CO32- равно удвоенному количеству кислоты, затраченной на титрование. После титрования CO32- раствор не выливают, используют для определения общей щелочности. Содержание ионов CO32- находят по формуле: где: CO32- - содержание ионов СО32-, мг/экв на 100 г почвы; 2 · V2 – удвоенное количество серной кислоты, пошедшее на титрование вытяжки, мл; н – нормальность кислоты; V0 – общий объем водной вытяжки, мл; V1 – объем водной вытяжки, взятый для титрования, мл; m0 – навеска почвы, взятая для приготовления водной вытяжки, г; Kн2о коэффициент пересчета на сухую почву; 100 – коэффициент пересчета на 100 г почвы. Пример расчета. Для определения содержания ионов CO32- взято 25 мл водной вытяжки, на титрование которых пошло 0,8 мл 0,0205 н. раствора H2SO4. Навеска почвы равна 100 г, общий объем водной вытяжки 500 мл, Kн2о = 1,07. Содержание ионов СО32- равно: В процентах содержание карбонатной щелочности составит: СО32- = 0,70 · 0,030 = 0,021%. где 0,030 – величина мг-экв CO32- 2.1.3.5. Определение общей щелочности Определяют общую щелочность титрованием водной вытяжки 0,01 н. -0,02 н. раствором H2SO4 в присутствии метилоранжа. Ход анализа. После окончания титрования ионов CO32-, а если они отсутствуют (вытяжка после добавления фенолфталеина не окрашивается), непосредственно после добавления фенолфталеина в те же колбы прибавляют 1-2 капли метилового оранжевого и титруют кислотой до перехода желтой окраски в оранжевую. Изменение окраски обычно трудноуловимо. Поэтому для более точного определения конца титрования берут вторую колбу, в которую добавляют такое же количество водной вытяжки и индикатора. Она служит для сравнения изменения окраски титруемой жидкости (свидетель). Обе колбы ставят на лист белой бумаги. Тщательно следят за изменением окраски в колбе, в которую приливают кислоту. Как только жидкость в ней приобретет окраску аналогичную окраске жидкости в колбе-свидетеле, титрование заканчивают. Поскольку проследить изменение окраски метилового оранжевого довольно трудно, Е.В. Аринушкина (1970) рекомендует использовать для титрования смешанный индикатор, состоящий из равных объемов 0,1% водного раствора метилового оранжевого и 0,1% спиртового (20%) раствора бромкрезолового зеленого. На 20-25 мл водной вытяжки прибавляют 3 капли этого индикатора и титруют до изменения зеленой окраски в желтую. Оттитрованную вытяжку в дальнейшем используют для определения ионов Cl-. Величину общей щелочности в присутствии ионов СО32- находят по суммарному количеству кислоты, затраченному на титрование по фенолфталеину и метиловому оранжевому (или смешанному индикатору). Если растворимых карбонатов нет расчет ведут по количеству кислоты, затраченному на титрование по одному метиловому оранжевому (или смешанному индикатору). Величину общей щелочности в мг-экв на 100 г почвы рассчитывают по формуле: где Щоб – общая щелочность, мг-экв на 100 г почвы; V0 – общий объем водной вытяжки, мл; V1 – объем водной вытяжки взятый для титрования, мл; V2 – объем кислоты пошедший на титрование водной вытяжки по фенолфталеину, мл; V3 – объем кислоты пошедший на титрование водной вытяжки по метиловому оранжевому (или смешанному индикатору), мл; m0 – навеска почвы, взятая для приготовления водной вытяжки, г; 100 - коэффициент пересчета на 100 г почвы; Кн2о – коэффициент пересчета на сухую почву. Пример расчета. Определение общей щелочности проведено в 25 мл водной вытяжки. На титрование щелочности от нормальных карбонатов по фенолфталеину пошло 0,8 мл, на последующее титрование по метиловому оранжевому израсходовано 1,5 мл 0,0205 н H2SO4. Навеска почвы равна 100 г воздушно-сухой почвы, общий объем водной вытяжки – 500 мл, Kн2о = 1,07. Общая щелочность в мг-экв равна: При расчете массовой доли компонентов, обусловливающих щелочность почв, принимают, что общая щелочность связана только с ионами НСО3-. Тогда Щоб = 1,01· 0,061 = 0,062%, где 0,061 – величина мг-экв НСО3-. Щелочность, обусловленную только ионами НСО3-, или гидрокарбонатную щелочность, находят по формуле: НСО3-мг-экв на 100 г почвы = Обозначения приведены в формулах для расчета щелочности от нормальных карбонатов и общей щелочности. Если в почве отсутствует щелочность от нормальных карбонатов, то величина общей щелочности принимается равной гидрокарбонатной щелочности. 2.1.3.6. Определение хлорид-ионов Содержание ионов хлора в водной вытяжке обычно определяют аргентометрическим методом. Метод основан на образовании труднорастворимого хлорида серебра. В качестве индикатора используют K2CrO4. Применение K2CrO4 основано на способности хромат-иона, реагировать с Ag+ с образованием кирпично-красного осадка Ag2CrO4. В условиях проведения анализа образование Ag2CrO4 начинается после того, как хлорид-ионы будут практически полностью связаны в виде AgCl. Ход анализа. В колбы, где определяли HCO3- прибавляют в качестве индикатора по 1 мл 10%-ного раствора хромовокислого калия (К2СrО4) и титруют одну из порций 0,01 н. раствором AgNO3 до красновато-бурого окрашивания. Вторая порция раствора должна находиться рядом, и с ней все время надо сравнивать оттенок титруемой жидкости. При прибавлении к титруемому раствору азотнокислого серебра образуется нерастворимый белый осадок хлорида серебра: NaCl + AgNO3 = AgCl ↓ + NaNO3. Как только все ионы хлора будут связаны ионами серебра, каждая последующая капля AgNO3 будет вступать в реакцию с К2СrО4, и придаст жидкости не исчезающий при взбалтывании красновато-бурый оттенок, обусловленный красным цветом образующегося хромовокислого серебра: 2AgNО3 + K2CrO 4 = Ag2CrО4 + 2KNO3. Начало появления неисчезающей красновато-бурой окраски и показывает окончание титрования. Содержание С1- в мг-экв на 100 г почвы вычисляют по формуле: где V1 – объем водной вытяжки, взятый для титрования, мл; V2 – объем AgNO3, пошедший на титрование, мл; V0 – общий объем водной вытяжки; н – нормальность AgNO3; m0 – навеска воздушно-сухой почвы, взятая для приготовления водной вытяжки; 100 – коэффициент пересчета на 100 г почвы; Kн2о – коэффициент пересчета на сухую почву. Пример расчета. Определение С1- проведено в 25 мл водной вытяжки. На титрование пошло 4,2 мл 0,0108 н AgNO3. Общий объем водной вытяжки равен 500 мл, навеска воздушно-сухой почвы – 100 г, Kн2о = 1,07. Содержание Cl- равно: Содержание С1- в % равно: С1- = 0,97 · 0,0355 = 0,034%, где 0,0355 – величина мг-экв С1- 2.1.3.7. Определение сульфат-ионов При анализе водной вытяжки содержание сульфат-ионов обычно определяют гравиметрическим методом. Метод основан на осаждении сульфат-ионов раствором BaCl2 в виде BaSO4. Ход анализа. Берут пипеткой 50 мл водной вытяжки в стакан на 200 мл добавляют несколько капель индикатора метилового красного и подкисляют ее 10%-ным раствором НС1 до ясно-розовой окраски, после чего добавляют еще 1 мл НС1. Подкисленный фильтрат нагревают до кипения и осаждают SO42-горячим 10%-ным раствором ВаС12, прибавляя его по каплям из пипетки в количестве 5 – 10 мл и тщательно размешивая каждую каплю осадителя. Для укрупнения осадка BaSO4 перед осаждением рекомендуется добавить к горячему раствору 3-5 капель 1% раствора пикриновой кислоты. Закрывают стакан с осадком часовым стеклом, кипятят 2-3 мин и оставляют на 2-3 ч в теплом месте. Осадок отфильтровывают через плотный фильтр, промывают холодной дистиллированной водой, слегка подкисленной 10%-ной НС1, до исчезновения реакции на барий (проба с 10%-ной H2SO4). Фильтр с осадком подсушивают в воронке, помещают во взвешенный фарфоровый тигель и обугливают под тягой на горелке, а затем ставят в горячую муфельную печь и прокаливают при температуре не выше 700-750°С в течение 20-25 мин. При температуре выше 800°С осадок разлагается. Вынимают тигель из муфеля, охлаждают, взвешивают на аналитических весах и по разности между массой осадка с тиглем и массой пустого тигля определяют массу прокаленного осадка BaSO4. Вычисляют результаты анализа по формуле: где m0 – навеска воздушно-сухой почвы, взятая для приготовления водной вытяжки, г; m1 – масса осадка BaSO4; V0 – общий объем водной вытяжки; V1 – объем водной вытяжки, взятый для осаждения SO42-, мл; 96,064 и 233,404 – молекулярные массы SO42- и BaSO4; 100 – коэффициент пересчета на 100 г почвы; Kн2о – коэффициент пересчета на сухую почву. Содержание SO42- в мг-экв на 100 г почвы находят по формуле: где 48,03 – эквивалентная масса сульфат-иона, 1000 – коэффициент пересчета г в мг. Пример расчета. Для осаждения SO42- взято 50 мл водной вытяжки. Масса прокаленного осадка BaSO4 равна 0,0342 г. Навеска воздушно-сухой почвы, взятая для приготовления водной вытяжки равна 100 г, общий объем вытяжки – 500 мл, Kн2о = 1,07. Содержание SO42- равно: В мг-экв это количество SO42- равно: 2.1.3.8. Определение ионов кальция и магния комплексонометрическим методом Комплексонометрическим методом определяют сумму кальция и магния, а затем один кальций, что дает возможность вычислить содержание магния. На ход анализа влияют избыточная щелочность, медь в количестве, превышающем 1 мг на 1 л, марганец и значительное количество железа и алюминия. В растворах, где железа больше 10 мг, а алюминия больше 20 мг на 1 л, необходимо предварительно их отделить. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
