ПРАКТИЧЕСКОЕ РУКОВОДСВО ПО ХИМИИ ПОЧВ. Руководство по химии почв учебное пособие
 Скачать 2.43 Mb. Скачать 2.43 Mb.
|
Пример расчета. Для определения железа взято 20 мл фильтрата от кремниевой кислоты из колбы объемом 250 мл. Количество Fe2O3 найденное по калибровочному графику равно 0,88 мг, навеска прокаленной почвы – 1,0224 г. Содержание Fe2O3 равно:1.5.4. Определение алюминия фотометрическим методом Ход анализа. Из колбы с фильтратом от кремниевой кислоты отбирают 5 мл и в мерной колбе на 50 мл доводят водой до метки. После перемешивания из нее отбирают на определение алюминия 3-5 мл, помещают в мерную колбу на 100 мл, приливают 25 мл воды и перемешивают. Затем прибавляют 0,5 мл 20 % раствора роданида калия и для связывания и восстановления Fe3+ в Fe2+ прибавляют 5 мл 10 % раствора HCl-гидроксиламина. После обесцвечивания раствора (через 3-5 мин) приливают 1 мл 10 % ацетата аммония, перемешивают и для создания рН среды 4,7 прибавляют 5 мл ацетатного буферного раствора с рН 7,0 (126 г уксуснокислого натрия растворяют в воде, доводят до 800 мл; 25 мл ледяной уксусной кислоты доводят водой до 200 мл и оба раствора сливают вместе). После перемешивания добавляют 3 мл 0,3 % водного раствора алюминона. Колбу с содержимым ставят на электроплиту, доводят до кипения и после охлаждения под краном, доливают дистиллированной водой до метки и измеряют оптическую плотность при длине волны 525 нм. Калибровочный график готовят из стандартного раствора алюминия, содержащего 0,04 мг Al2O3 в 1 мл. В мерные колбы на 100 мл отбирают от 1 до 6 мл этого стандартного раствора, прибавляют по 1 мл раствора железа, содержащего 0,1 мг Fe2O3 в 1 мл, и далее добавляют все реагенты в той же последовательности, как и в испытуемые растворы. Оптическую плотность измеряют в тех же кюветах. По полученным отсчетам строят график зависимости оптической плотности от концентрации Al2O3 и находят содержание алюминия в испытуемой пробе. Содержание Al2O3 находят по формуле: где а – содержание алюминия, найденное по калибровочному графику, мг; V0 – общий объем фильтрата от кремниевой кислоты, мл; V1 – объем фильтрата от кремниевой кислоты, взятый для разведения, мл; V2 – объем разведенного фильтрата от кремниевой кислоты, мл; V3 – объем разведенного фильтрата от кремниевой кислоты взятый для окрашивания алюминоном, мл; m0 – навеска прокаленной почвы, взятая для спекания, г; 100 – коэффициент пересчета на 100 г почвы; 1000 – коэффициент перевода мг в г. Пример расчета. 5 мл фильтрата от кремниевой кислоты, общий объем которого 250 мл разведено в мерной колбе на 50 мл. На окрашивание взято 10 мл разведенного фильтрата. Количество Al2O3 найденное по калибровочному графику равно 0,20 мг, навеска прокаленной почвы – 1,0224 г. Содержание Al2O3 равно: 1.5.5. Вычисленное содержание алюминия по разности При определении содержания Al2O3 по разности из количества R2O3 вычитают содержание Fe2O3, TiO2 и P2O5. Результаты такого определения содержания Al2O3 обычно несколько выше данных, полученных прямым методом, поскольку в этом случае к содержанию Al2O3 приплюсовывается и содержание других элементов, выпадающих в осадок вместе с R2O3 в виде примеси. Кроме того, ошибки, допущенные при определении суммы полуторных оксидов, Fe2O3, TiO2 и P2O5 будут отражаться на величине Al2O3. Пример расчета. Содержание полуторных оксидов равно 7,24%. Содержание Fe2O3 – 1,08%, TiO2 – 0,58%, P2O5 – 0,16%. Содержание Al2O3 по разности будет равно: 7,24 – (1,08 + 0,58 + 0,16) = 5,42%. 1.5.6. Определение кальция и магния комплексонометрическим методом Определение кальция и магния проводят в фильтрате от полуторных оксидов. Для этого берут две аликвоты. В одной определяют содержание кальция, в другой – сумму кальция и магния, количество магния находят по разности между вторым и первым определениями. 1.5.6.1. Определение кальция Ход анализа. Из фильтрата после выделения полуторных оксидов отбирают пипеткой 25-50 мл и переносят в коническую колбу на 250 мл и доводят дистиллированной водой до 100 мл. Прибавляют 2-3 капли 1 % раствора Na2S и 1-2 мл 5 % раствора гидроксиламина, 15 мл 2 н. раствора NaOH (рН раствора становится около 13), перемешивают, вносят на кончике шпателя сухой порошок индикатора флуорексона и медленно титруют при постоянном помешивании 0,01 М раствором трилона Б до перехода окраски из зелено-оранжевой с сильной флюоресценцией в пурпурно-розовую с очень заметным понижением флюоресценции. Вместо флуорексона в качестве индикатора можно использовать мурексид в смеси с NaCl. Титрование ведут до перехода розовой окраски раствора в фиолетовую. Титрование рекомендуется проводить в присутствии перетитрованной пробы. Содержание СаО находят по формуле: 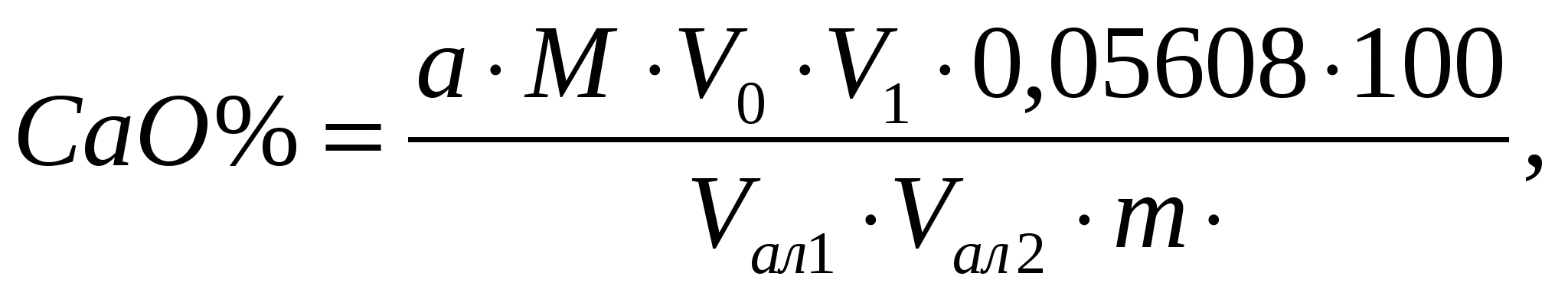 где а – количество трилона Б пошедшее на титрование, мл; М – молярность трилона Б; V0 – общий объем фильтрата от кремниевой кислоты, мл;V1 – общий объем фильтрата от полуторных оксидов, мл; Vал1 – объем фильтрата от кремниевой кислоты взятый для осаждения полуторных оксидов, мл; Vал2 – объем фильтрата от полуторных оксидов взятый для определения кальция, мл; 0,05608 – г/ммоль СаО; 100 – коэффициент пересчета на 100 г почвы. 1.5.6.2. Определение суммы кальция и магния Для определения магния в другой аликвотной части фильтрата от выделения полуторных оксидов трилоном Б титруют сумму Са + Mg в щелочной среде (рН 10) в присутствии индикатора хромогена черного Т. Индикатор образует с Са и Mg внутрикомплексное соединение, которое при титровании разрушается, а оставшиеся Са и Mg связываются трилоном Б в более прочный комплекс. При этом, вначале связывается Са, а затем Mg. Изменение окраски индикатора наступает в момент полного связывания Ca и Mg трилоном Б. Ход анализа. В коническую колбу на 250 мл отбирают такое же количество фильтрата после выделения полуторных оксидов, как и на определение Са. Фильтрат в колбе разбавляют дистиллированной водой до 100 мл, прибавляют 1-2 мл 5 % раствора гидроксиламина, 2-3 капли 1 % раствора Na2S, приливают 10 мл хлоридноаммиачного буферного раствора с рН около 10,5 (70 г хлористого аммония и 570 мл аммиака разводят водой до 1 л), хорошо перемешивают. Затем прибавляют на кончике шпателя индикатор хромоген черный. Раствор окрашивается в розово-фиолетовый цвет. После этого титруют 0,01 М раствором трилона Б сумму кальция и магния до перехода окраски раствора в четкую сине-голубую без розового оттенка. Переход окраски в эквивалентной точке очень отчетливый. Из количества миллилитров трилона Б, пошедшего на титрование суммы Са и Mg, вычитают количество мл трилона Б, пошедшее на титрование одного кальция и по разности вычисляют количество магния в пробе почвы. 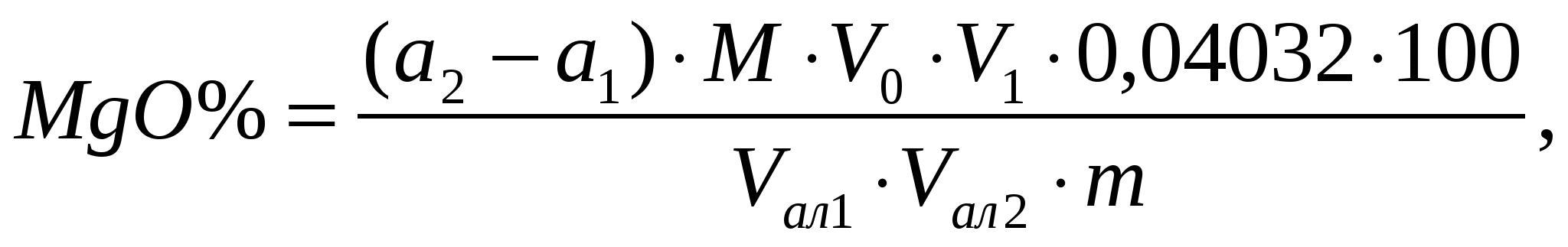 где а2 – объем трилона Б пошедший на титрование суммы кальция и магния, мл; а1 – объем трилона Б пошедший на титрование кальция, мл; V0 – общий объем фильтрата от кремниевой кислоты, мл; V1 – общий объем фильтрата от полуторных оксидов, мл; Vал1 – объем фильтрата от кремниевой кислоты взятый для осаждения полуторных оксидов, мл; Vал2 – объем фильтрата от полуторных оксидов взятый для определения кальция, мл; 0,04032 – г/ммоль MgО; 100 – коэффициент пересчета на 100 г почвы. |
