ПРАКТИЧЕСКОЕ РУКОВОДСВО ПО ХИМИИ ПОЧВ. Руководство по химии почв учебное пособие
 Скачать 2.43 Mb. Скачать 2.43 Mb.
|
2.1.3.8.1. Определение кальцияХод анализа. Берут пипеткой по 25мл водной вытяжки в две конические колбы вместимостью по 250 мл. Приливают в каждую по 75 мл дистиллированной воды, лишенной ионов Са2+ и Сu2+. Добавляют 5 – 10 капель водного раствора гидроксиламина (для устранения влияния марганца), 2 – 3 капли 1%-ного раствора сульфида натрия (для устранения влияния меди), 5 мл 10%-ного раствора КОН или NaOH (для доведения рН раствора до 12) и вносят деревянной лопаточкой смесь мурексида с NaCl (30 – 50 мг). Раствор должен окраситься в ярко-розовый цвет. Титруют содержимое одной из колб 0,05 н. раствором трилона Б до перехода ярко-розовой окраски в фиолетовую (лиловую). Титруют медленно при постоянном перемешивании. Отметив количество трилона Б, пошедшее на титрование, добавляют в колбу избыток трилона Б и титруют содержимое второй колбы, используя в качестве свидетеля первую колбу с перетитрованным раствором. 2.1.3.8.2. Определение суммы кальция и магния Ход анализа. В две конические колбы по 250 мл пипеткой вносят по 25 мл водной вытяжки и приливают в каждую колбу по 75 мл дистиллированной воды, лишенной ионов кальция, магния и меди. Добавляют по 5 – 10 капель 1%-ного раствора солянокислого гидроксиламина по 2 – 3 капли 1%-ного раствора сульфида натрия, по 20 мл хлоридно-аммиачного буфера и вносят 30-50 мг индикаторной смеси хромогена черного с NaCl, раствор окрашивается в вишнево-красный цвет. Титруют содержимое одной из колб 0,05 н. раствором трилона Б. Вторая колба служит для сравнения окраски. При титровании раствор все время перемешивают. Вишнево-красный цвет жидкости вблизи точки эквивалентности приобретает лиловую окраску, после чего титруют медленно. Конец титрования устанавливают по появлению синего цвета с зеленоватым оттенком (сине-голубого). Повторяют титрование со второй колбой. Содержание Ca2+ и Mg2+ (в мг-экв.) вычисляют по формулам: где: Са2+ и Mg2+ – содержание ионов, мг-экв на 100 почвы; m0 – навеска воздушно-сухой почвы, взятая для приготовления водной вытяжки; V0 – общий объем водной вытяжки, мл; V1 – количество фильтрата взятого на титрование, мл; V2 – количество трилона Б пошедшее на титрование кальция, мл; V3 – количество трилона Б пошедшее на титрование суммы кальция и магния, мл; н. – нормальность трилона Б; 100 – коэффициент пересчета на 100 г почвы; Kн2о – коэффициент пересчета на сухую почву; 2 – коэффициент перевода атомов в мг-экв. Содержание Са2+ и Mg2+ в процентах находят по формулам: где: Са2+ и Mg2+ – содержание ионов, мг-экв на 100 почвы; 20,04 – эквивалентная масса Са2+; 12,16 – эквивалентная масса Mg2+, 1000 – коэффициент пересчета мг в г. Пример расчета. Для приготовления водной вытяжки к навеске воздушно-сухой почвы массой 100 г добавлено 500 мл дистиллированной воды. На титрование Са2+ и суммы Са2+ и Mg2+ взято по 25 мл фильтрата. Количество 0,05 н. трилона Б пошедшее на титрование ионов Са2+ равно 8,4 мл, суммы Са2+ и Mg2+ – 12,2 мл, Kн2о = 1,07. Содержание ионов Са2+ в мг-экв равно: В процентах это составит: Содержание ионов Mg2+ в мг-экв равно: В процентах это составит: 2.1.3.9. Определение натрия и калия При анализе водной вытяжки Na и К определяют методом фотометрии пламени или атомно-абсорбционным методом. Примерное представление о содержании натрия и калия в водной вытяжке можно получить, используя расчетный метод. 2.1.3.9.1. Определение натрия и калия методом фотометрии пламени Определение содержания натрия и калия в водных вытяжках на пламенном фотометре возможно лишь при их содержании не меньше 1 мг на 100 г почвы. При высоком содержании калия и натрия в водной вытяжке ее перед измерением целесообразно разбавить. Содержание калия в водных вытяжках из почв, как правило, невелико. Поэтому обычно его содержание определяют в неразбавленных водных вытяжках. При определении натрия водные вытяжки в большинстве случаев приходится разбавлять. Степень разбавления примерно устанавливают по содержанию хлорид-ионов. При содержании Cl- 1,5-10 мг-экв/100 г почвы вытяжку разбавляют в 5 раз, 10-20 мг-экв/100 г почвы – в 10 раз, при содержании хлорид-ионов более 20 мг-экв/100 г почвы вытяжку разбавляют в 20 и более раз. При высоком содержании кальция в водной вытяжке результаты определения натрия и калия на пламенном фотометре получаются завышенными. В этом случае необходимо проводить компенсацию или удалять кальций из раствора. На точность определения элементов влияют и водорастворимые органические вещества, значительное количество которых переходит в водные вытяжки из почв, имеющих щелочную реакцию. Для получения надежных результатов такие вытяжки рекомендуется разбавлять насколько это возможно или удаляют органическое вещество. Выполнение определения. Приводят прибор в рабочее состояние и фотометрируют серию эталонных растворов с концентрацией определяемых элементов от 2,5 до 100 мг/л. По показаниям прибора для этих растворов строят калибровочный график в координатах: отсчет по шкале прибора – концентрация элемента. Перед анализом растворов водных вытяжек распылитель прибора промывают дистиллированной водой. Эту операцию повторяют после каждого измерения. Фотометрируют анализируемые растворы, записывая показания прибора. Концентрацию натрия и калия в водных вытяжках находят по калибровочным графикам. Содержание натрия или калия в процентах от массы почвы определяют по формуле: где а – концентрация натрия или калия найденная по калибровочному графику, мг/л; V0 – общий объем водной вытяжки, мл; m – навеска почвы, взятая для приготовления водной вытяжки, г; 100 – коэффициент пересчета на 100 г почвы; 1000 – коэффициенты пересчета мг в г и мл в л; Кн2о – коэффициент пересчета на сухую почву. Пересчет содержания ионов выраженного в процентах в мг-экв производят по формулам: где 23 и 39,1 эквивалентная масса натрия и калия соответственно, 1000 – коэффициент пересчета г в мг. Пример расчета. Для приготовления водной вытяжки к навеске воздушно-сухой почвы массой 100 г добавлено 500 мл дистиллированной воды. Концентрация натрия найденная по калибровочному графику составила 55 мг/л. Kн2о = 1,07. Содержание натрия равно: 2.1.3.9.2. Определение содержания натрия и калия по разности В ряде случаев общее количество натрия и калия в водной вытяжке находят методом вычитания. Такой способ определения их количества основан на том предположении, что растворы водной вытяжки электронейтральны и сумма анионов эквивалентна сумме катионов. В этом случае в водной вытяжке определяют анионы (СО2-, НСО3-, С1- SO2-) и катионы (Са2+ и Mg2+). Разницу между суммой эквивалентов анионов СО2-, НСО3-, С1- и SO2- и катионов Са2+ и Mg2+ принимают как эквивалентное количество Na+ + К+. В этих расчетах допускают, что всех других анионов и катионов в водной вытяжке мало, и ими можно пренебречь. В некоторых засоленных почвах такие анионы, как NO- и SiO2-, иногда встречаются в значительных количествах, поэтому определение Na + K по разности не всегда дает хорошие результаты и имеет относительное значение. Результаты анализа водной вытяжки записывают по форме 4. Форма 4. Данные анализа водной вытяжки
Для проверки точности результатов анализа водной вытяжки сравнивают сумму катионов и анионов (%) с сухим остатком, при этом берут половину найденного количества НСО-, так как при получении сухого остатка половина диоксида углерода гидрокарбонатов теряется, как это следует из уравнения: Са(НСО3)2 → СаСО3 + СО2↑ + Н2О При таком подсчете сухой остаток должен быть немного больше суммы катионов и анионов. Допустимое расхождение составляет 3-5% величины сухого остатка. В засоленных почвах распределение анионов и катионов по профилю почвы изображают в виде графика (рис. 2). 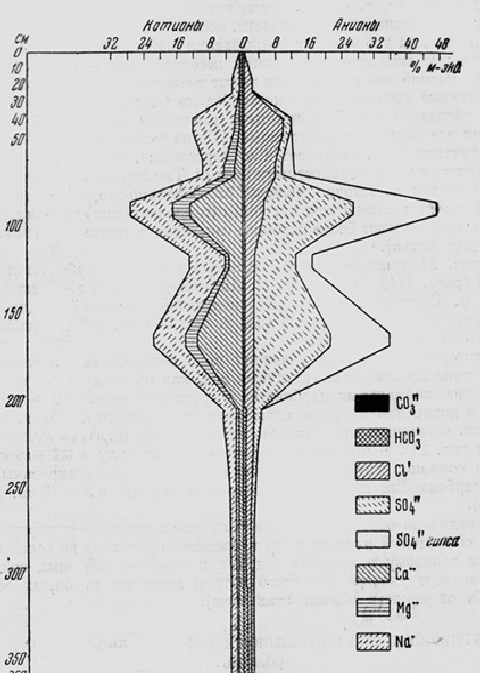 Рис. 2. Солевой профиль солонца 2.1.4. Интерпретация данных водной вытяжки Результаты анализа водной вытяжки используют для выявления глубины залегания солевых горизонтов, оценки степени и типа засоления почвы, преимущественной направленности миграции солей в почвенном профиле. 2.1.4.1. Характеристика солевого режима почв по величине сухого остатка По данным водной вытяжки можно оценить общее количество водорастворимых солей аккумулирующихся в пределах любого почвенного горизонта или части почвенного профиля, то есть найти их степень засоления. Для этого используют величину сухого остатка и группировку почв по степени засоления (С.А.Владыченский, 1964): степень засоления почвы содержание солей, % незасоленные <0,25 слабозасоленные 0,25-0,5 среднезасоленные 0,5-1,0 сильнозасоленные 1,0-2,0 солончаки >2,0 В зависимости от глубины залегания первого солевого максимума, засоленные почвы на уровне рода подразделяются на солончаковые – соли в слое 0-30 см, высокосолончаковатые 30-50 см, солончаковатые – 50-100 см, глубокосолончаковатые – 100-150 см, глубокозасоленные – 150-200 см, потенциальнозасоленные – 200-300 см. По величине сухого остатка можно судить о характере миграции солей в почвенном профиле. Если максимум солей приурочен непосредственно к поверхности, а ниже по профилю величина сухого остатка существенно уменьшается, то такой характер солевого профиля свидетельствует о том, что почва находится на первой стадии засоления. В том случае, когда величина сухого остатка наибольшая в верхней части почвы, а соли содержаться в значительных количествах (>1%) в пределах всего профиля, имеет место прогрессивное засоление. Такие почвы представляют собой мощные солончаки. Если соли содержатся в значительных количествах во всем профиле, а величина сухого остатка самая высокая в его нижней части, то это свидетельствует о начавшемся процессе рассоления почвы. В качестве примера рассмотрим данные таблицы 12. Таблица 12. Распределение величины сухого остатка по профилю почв
Солончаковое пятно на орошаемом участке и приморский солончак характеризуются высокой величиной сухого остатка непосредственно с поверхности – 15,09 и 2,04% соответственно, что свойственно солончакам. Максимум солей в профиле каштановой солонцеватой почвы (1,962%) находится на глубине 150-160 см. Это позволяет классифицировать данную почву как глубокосильнозасоленную. По величине сухого остатка можно судить и о характере миграции солей в почвенном профиле. У солончакового пятна на орошаемом участке максимум солей приурочен непосредственно к поверхности. В пахотном горизонте наблюдается сильная степень засоления. В слое 0-2 см сухой остаток равен 15,09%, в слое 2-10 см – 1,72%, в слое 10-25 см – 1,57%. Ниже по профилю величина сухого остатка существенно уменьшается и на глубине 100-120 см содержание солей уже незначительное. Такой характер солевого профиля свидетельствует о том, что почва находится на начальной стадии засоления. Каштановая слабосолонцеватая почва когда-то имела иной солевой профиль, причем водорастворимые соли оказывали заметное влияние на ее свойства, являясь в частности поставщиком ионов натрия, с которым было связано развитие солонцового процесса. В дальнейшем, в связи с усилением дренированности территории, получил активное развитие процесс рассоления почвы. Как видно из данных таблицы 12 верхняя часть профиля практически отмыта от водорастворимых солей. Слабая степень засоления обнаруживается лишь на глубине 70-80 см. Основная масса солей сосредоточена на глубине 150-200 см, куда они удалены промачивающими профиль атмосферными осадками. Почва может иметь и более сложный солевой профиль, как например приморский солончак. В данном случае на фоне высокого засоления всего почвенного профиля отчетливо выделяются три солевых максимума приуроченных к слоям 0-4 см (2,04%), 70-80 см (2,98%) и 150-180 см (1,74%). Почва, несомненно, испытывает прогрессивное засоление, однако оно протекает с периодической сменой процессов засоления и рассоления. О нисходящем движении солей, которое происходило в профиле почвы, свидетельствуют максимумы на глубинах 70-80 и 150-180 см, то есть здесь происходила неоднократная смена процессов рассоления и засоления. Установленное при помощи водной вытяжки чередование процессов засоления и рассоления свидетельствует о том, что на данной территории опускание базиса эрозии, начало расчленения и дренирования района и последующего снижения уровня грунтовых вод на каком-то этапе сменилось их подъемом. В последнем случае процесс рассоления территории замедлялся или сменялся засолением. Можно также предположить, что процесс засоления протекал в несколько стадий, в соответствии с изменением уровня грунтовых вод. При этом отложение солей происходило на границе капиллярной каймы. В первом случае на глубине 150-180 см, затем, после подъема, на глубине 70-80 см и, наконец, при последнем повышении их уровня произошло засоление всего почвенного профиля. 2.1.4.2. Оценка химизма (типа) засоления почв. 2.1.4.2.1. Общие принципы оценки химизма засоления почв Химизм засоления устанавливается по соотношению ионов в характеризуемом слое или горизонте максимальной аккумуляции водорастворимых солей. При незначительном варьировании химизма засоления в пределах почвенного профиля тип засоления устанавливается по средним показателям для расчетного слоя. Если химизм засоления подвержен значительному варьированию, то тип засоления устанавливается по соотношению ионов в первом верхнем горизонте максимальной аккумуляции водорастворимых солей с указанием химизма засоления более глубоких горизонтов. Особо следует отмечать присутствие соды в любой части профиля. При определении типа засоления почв принимаются во внимание в первую очередь анионы. В наименование типа засоления включаются те анионы, содержание которых превышает 20% от суммы мг-экв анионов. При этом преобладающий анион в названии ставится на последнее место. В отношении оценки возможного участия соды в составе солей рекомендуется пользоваться следующими придержками. Если в водной вытяжке при значительном преобладании SО42- и Cl- присутствуют (хотя бы в одном из горизонтов почвы) ионы СОз2- в количестве менее 20% от суммы мг-экв анионов, но более 0,03 мг-экв на 100 г почвы, то в названии химизма засоления следует отразить возможное присутствие соды. В таких случаях засоление определяется по соотношению преобладающих ионов с добавлением в названии «с участием соды». То же самое касается и ионов НСО3-, если количество их в водной вытяжке превышает 1,4 мг-экв на 100 г почвы, а НСО3- > Са2++Мg2+ (в эквивалентах); при этом необходимо произвести расчет токсичных солей и убедиться в наличии ионов НСО3- в количестве, превышающем порог токсичности (0,8 мг-экв НСО3-, связанной с Na + Mg) (см. ниже). Иногда повышенное содержание НСО3- может быть обусловлено присутствием Мg(НСО3)2. В этих случаях тип засоления определяется как гидрокарбонатный. При определении химизма засоления почв удобно пользоваться величинами отношений мг-экв анионов (табл. 13). Таблица 13. Химизм (тип) засоления почв по анионному составу (Н.И. Базилевич, Е.И. Панкова, 1970)
*СаSО4 < 1% (Са<12,5 мг-экв). **СаSО4 > 1% (Са 12,5 мг-экв). Почвы, содержащие наряду с нейтральными солями некоторое количество соды и относящиеся к типам засоления с участием соды, в таблицу 13 не включены. Принцип выделения их рассмотрен в начале раздела. Определение химизма засоления почв по анионному составу дополняются сведениями по составу катионов (табл. 14). | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
