Пример расчета. Навеска почвы взятая для определения гумуса равна 0,305 г. На титрование холостой пробы пошло 25,8 мл раствора соли Мора, на титрование анализируемого образца затрачено 22,3 мл раствора соли Мора. Нормальность раствора соли Мора – 0,204. Коэффициент пересчета на абсолютно сухую почву равен 1,072. Содержание органического углерода равно:
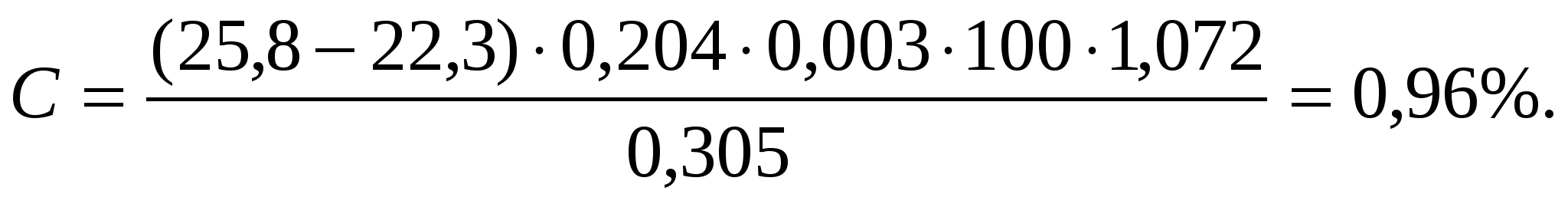
Содержание гумуса равно:
Гумус = 0,96 ∙ 1,724 = 1,66%.
Для анализа используют следующие реактивы:
1. 0,4 н. раствор K2Cr2O7 в разбавленной (1:1) серной кислоте. 40 г K2Cr2O7 растворяют в 500-600 мл дистиллированной воды и фильтруют через бумажный фильтр в мерную колбу емкостью 1 л. Раствор доводят до метки дистиллированной водой и переливают в термостойкую посуду емкостью 2,5-5 л. К раствору K2Cr2O7 в вытяжном шкафу приливают небольшими порциями (примерно по 100 мл) при осторожном и многократном перемешивании 1 л концентрированной H2SO4 (пл. 1,84). При смешивании раствора с серной кислотой происходит сильное разогревание жидкости, поэтому выполнять операции нужно очень аккуратно и пользоваться только термостойкой посудой.
Приготовленный раствор закрывают воронкой или стеклом и оставляют стоять для полного охлаждения до следующего дня, затем переливают в бутыль с притертой пробкой и хранят в темном месте.
2.0,2 н. раствор соли Мора. Берут 80 г соли (NH4)2SO4 ∙ FeSO4 ∙ 6H2O (используют только голубые кристаллы, побуревшие отбрасывают) помещают в колбу, заполненную 650-700 мл 1 н раствора H2SO4 и взбалтывают раствор до полного растворения соли. Затем раствор отфильтровывают в мерную колбу на 1 л и доводят до метки дистиллированной водой. Раствор соли Мора хранят в бутыли изолированной от воздуха склянкой Тищенко с щелочным раствором пирогаллола или трубкой с кристаллами соли Мора.
Нормальность раствора соли Мора устанавливают и проверяют по 0,1 н. раствору KMnO4. В связи с тем, что нормальность соли Мора быстро изменяется, проверять ее нужно через 1-2 дня. Для этого в коническую колбу на 250 мл мерным цилиндром приливают 1 мл H2SO4 (плотность 1,84), отмеряют бюреткой 10 мл раствора соли Мора, приливают 50 мл дистиллированной воды и титруют 0,1 н. раствором КМnО4 (приготовленным из фиксонала) до слабо-розовой окраски, не исчезающей в течении 1 мин. Титрование повторяют и берут среднее значение. Нормальность раствора соли Мора находят по формуле:
V1 ∙ N1 = V2 ∙ N2
где V1 и N1 - объем и нормальность раствора соли Мора, V2 и N2 - объем и нормальность раствора КМnО4.
3. 0,2% раствор фенилантраниловой кислоты C13H11O2N. Фенилатраниловая кислота нерастворима в воде, поэтому индикатор готовят в содовом растворе, для чего 0,2 г фенилантраниловой кислоты растворяют в 100 мл 0,2% раствора безводной соды (Na2CO3). Для лучшего растворения навеску фенилантраниловой кислоты предварительно увлажняют в фарфоровой чашке 0,2% раствором соды до сметанообразного состояния и в таком виде тщательно перемешивают стеклянной палочкой. После этого приливают остальной объем раствора соды.
4. 1 н. раствор H2SO4. В мерную колбу на 1 л, заполненную
500 мл дистиллированной воды, добавляют отмеренные цилиндром 28 мл концентрированной H2SO4 и перемешивают. Дают колбе остыть до комнатной температуры, доводят дистиллированной водой до метки и тщательно перемешивают.
3.2.2.2. Другие модификации метода И.В. Тюрина.
Хотя, усовершенствованный В.Н. Симаковым, метод объемного определения гумуса по И.В. Тюрину достаточно точен при значительной простоте и скорости определения, предложены различные его модификации. Они не вносят в метод ничего принципиально нового, но позволяют упростить и стандартизировать ход анализа, что делает метод более производительным.
3.2.2.2.1. Спектрофотометрический метод определения содержания гумуса (Д.С. Орлов, Н.М. Гриндель)
Сущность метода заключается в следующем. При окислении гумуса раствором дихромата калия шестивалентный хром восстанавливается до трехвалентного (Cr2O72-→ 2Сr3+), количество которого будет эквивалентно содержанию углерода органических соединений и других восстановителей в навеске почвы. Поэтому, если нет ограничений (присутствие ионов хлора, закисного железа и марганца), содержание углерода органических соединений можно определить по количеству образовавшегося в процессе реакции окисления Сr3+, используя для этого фотометрический метод.
В пределах видимой части спектра раствор дихромата калия имеет только один четко выраженный максимум поглощения с λmax = 447 нм. По мере увеличения длины волны оптическая плотность быстро падает, достигая нулевого значения при 570-580 нм. Спектр поглощения раствора восстановленного трехвалентного хрома выглядит иначе. При переходе от ультрафиолетовой области к видимой оптическая плотность резко падает, достигая минимума при 490-500 нм, а затем вновь увеличивается, достигая максимума поглощения при 584-594 нм, то есть в той области, где поглощение дихромата калия (Cr2O72-) практически равно нулю. Таким образом, имеется реальная возможность, измерив оптическую плотность раствора при 590 нм, узнать количество восстановленного хрома, эквивалентное общему количеству гумуса (окислителя) в анализируемом образце.
Ход анализа. Навеску почвы около 0,3 г, взятую на аналитических или торзионных весах (такая навеска, по мнению авторов метода, пригодна для определения при содержании гумуса от 0,6-0,8 до 12 - 13%; при большем или меньшем содержании гумуса навеску изменяют), переносят в коническую колбу на 100 мл и приливают мерным цилиндром 20 мл хромовой смеси. Колбы должны быть проградуированы на объем 100 мл. Осторожно перемешивают содержимое, закрывают горло колбы маленькой воронкой и кипятят ровно 5 мин, как принято в методе Тюрина.
После окончания сжигания колбу охлаждают, ополаскивают дистиллированной водой воронку и стенки колбы и доводят общий объем в колбе до 100 мл. Колбу закрывают пробкой, смесь хорошо перемешивают и оставляют на ночь. Отстоявшийся раствор осторожно, чтобы не взмутить осадок, сливают в кювету и определяют оптическую плотность при длине волны 590 нм. «Нуль» прибора устанавливают по холостому раствору.
При содержании гумуса до 6-7% пользуются кюветой 5 см, при большем содержании – кюветой 3 см. Холостым раствором служат 20 мл дихромата калия прокипяченные и разбавленные до 100 мл.
Общая расчетная формула имеет вид:
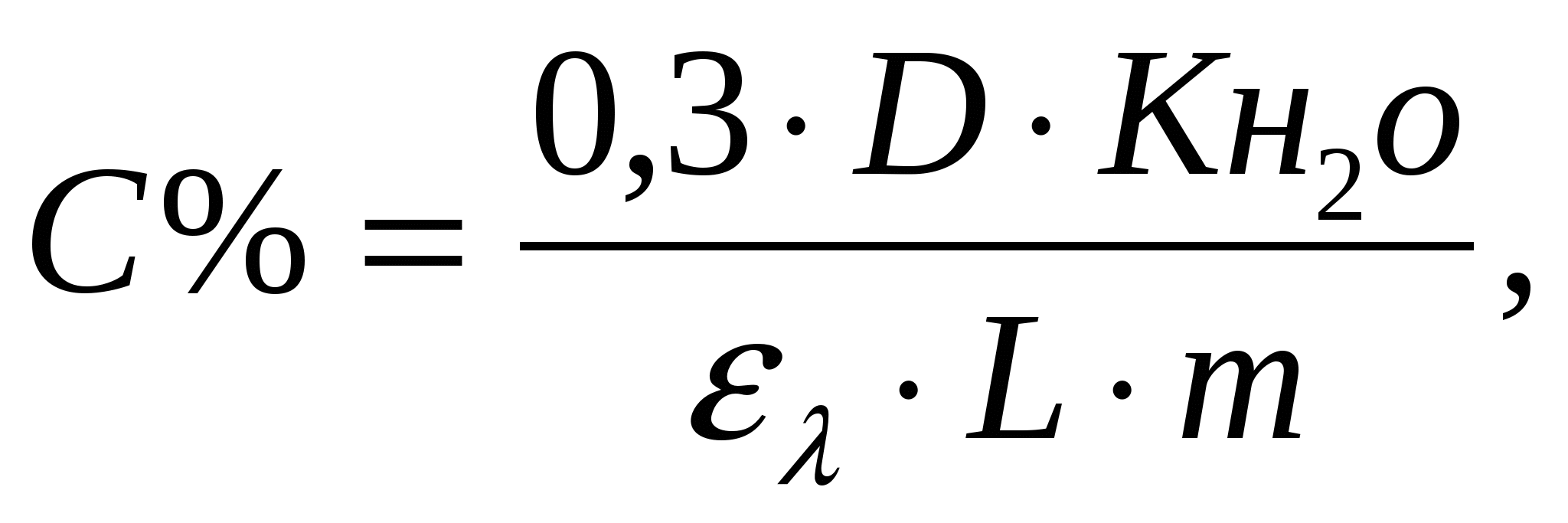
где С – содержание углерода, %; D – оптическая плотность; ελ – коэффициент погашения; L – длина кюветы, см; m – навеска почвы, г; Кн2о – коэффициент пересчета на абсолютно сухую почву.
Подставляя численные значения ελ (при λ= 590, ελ=0,06983) и размер
кюветы получим: для кюветы 3 см, 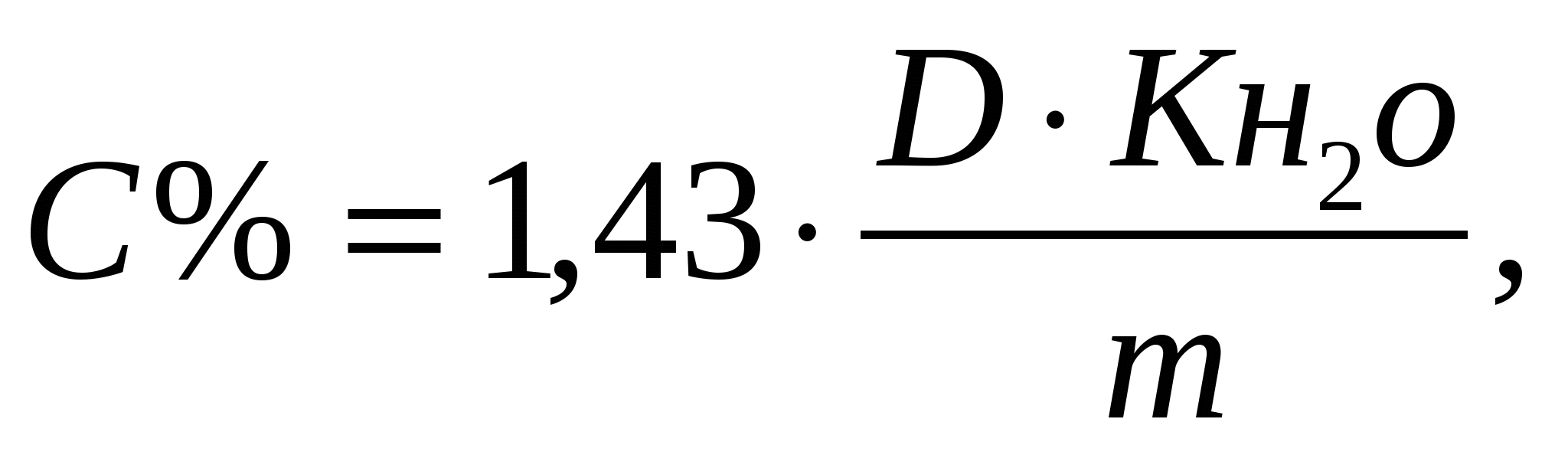
для кюветы 5 см, 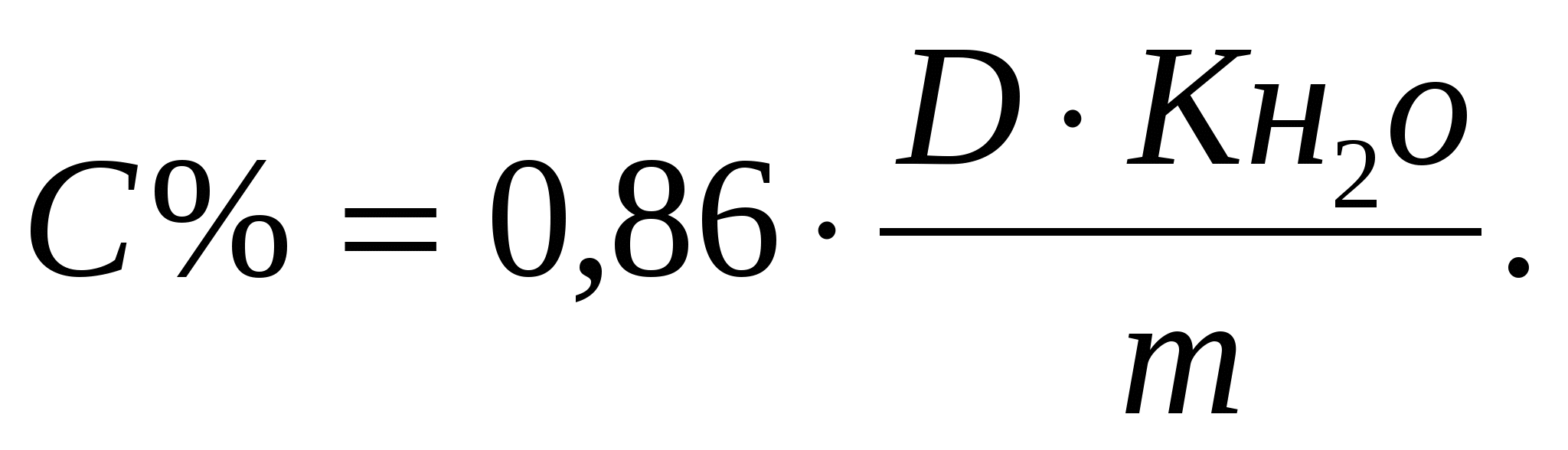
Пример расчета. Определения оптической плотности после окисления органического углерода проведено в кювете размером 5 см. Величина оптической плотности равна 0,15. Коэффициент пересчета на абсолютно сухую почву – 1,02, навеска почвы – 0,228 г. Содержание органического углерода равно: 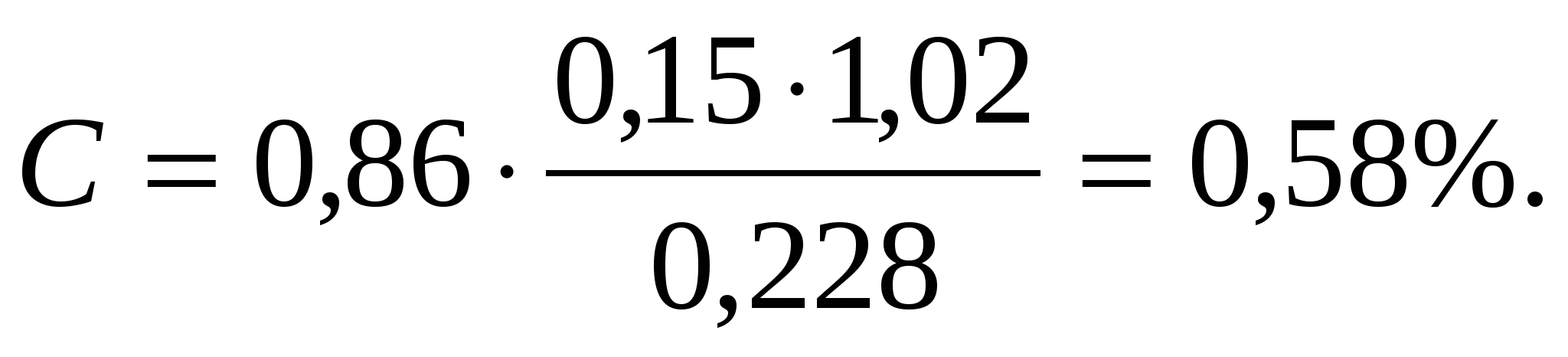 Содержание гумуса составило: Содержание гумуса составило:
Гумус = 0,58 ∙ 1,724 = 1,00%.
При работе с другой длиной волны значения коэффициентов погашения находятся по стандартному раствору соли Мора. Для этого в серию колб берут по 20 мл 0,4 н раствора дихромата калия (точно бюреткой), кипятят 5 мин. и по охлаждении в колбы приливают последовательно 1, 2, 5, 10, 25 мл 0,2 н (титрованного) раствора соли Мора. Объем раствора доводят в мерных колбах до 100 мл и измеряют оптические плотности растворов при длине волны, которая будет использована для определения гумуса. Коэффициент погашения определяют по формуле:
D = ελ ∙ C ∙ L,
где D – оптическая плотность, С – концентрация Сr3+ - иона, L – длина кюветы в см, ελ – коэффициент погашения при выбранной длине волны. Если концентрацию восстановителя выразить в мг-экв на 100 мл раствора, то можно найти коэффициент погашения ελ = D/( C ∙ L) мг-экв-1 см-1 100 мл.
Коэффициент погашения находят для каждого раствора в отдельности, а потом вычисляют среднее значение.
3.2.2.2.2. Определение содержания органического углерода почвы методом И.В.Тюрина в модификации Б.А.Никитина.
Одним из главных недостатков оригинального варианта и последующих модификаций метода И.В.Тюрина является нестабильность температуры окисления гумуса при нагревании. Кипение хромовой смеси при окислении гумуса почвы может происходить в интервале от 138 до 160оС, в тоже время хромовая смесь без почвы начинает кипеть при 172°С, кипение делается постоянным при 182оС (Никитин Б.А.,1967). Придержки, касающиеся интенсивности кипения смеси, оговоренные в прописи метода И.В. Тюрина, довольно условны, и это вносит заметную неопределенность в проведение самой ответственной операции при определении гумуса.
Для устранения этого недостатка Б.А.Никитин (1967) предложил проводить сжигание гумуса в сушильном шкафу при температуре 150° С.
Ход анализа. Из подготовленной к анализу почвы (просеянной через сито с диаметром отверстий ≤0,25 мм) на аналитических или торзионных весах берут навеску почвы в зависимости от предполагаемого содержания углерода и переносят в коническую колбу на100 мл. Приливают 20 мл 0,4 н раствора дихромата калия, осторожно перемешивают содержимое колбы, закрывают маленькой воронкой и ставят в сушильный шкаф, предварительно нагретый до 160 градусов. В шкаф ставят 10-15 колб, в том числе две колбы с 20 мл хромовой смеси (холостая проба). Колбы нагревают в сушильном шкафу 20 мин при температуре 150°, отсчитывая время нагревания не с момента постановки колб в шкаф, а с момента достижения температуры 150о. Колбы ставят в удалении от стенок шкафа на 3-4 см для обеспечения более равномерного нагрева. После нагревания колбы охлаждают, ополаскивают стенки и воронки небольшим количеством дистиллированной воды, добавляют 5-6 капель фенилантраниловой кислоты и титруют 0,2 н раствором соли Мора. Содержание углерода находятся так же, как и по методу И.В.Тюрина.
В случае, когда применяется спектрофотометрическое окончание, содержимое колб после охлаждения разбавляют дистиллированной водой точно до 50 мл и дают отстоятся в течение суток. Осторожно отбирают пипеткой раствор над осадком и измеряют его оптическую плотность при длине волны 590 нм. Для сравнения в качестве оптического нуля используют раствор холостой пробы. Лучшие результаты получаются в том случае, когда оптическая плотность лежит в пределах 0,2-0,6.
Содержание углерода находят по калибровочному графику. Для его построения берут 2,5022 г глюкозы или 2,3771 г сахарозы и растворяют в мерной колбе на 1 л; в одном мл такого раствора содержится 1 мг С. В пять колб приливают последовательно 2,5; 5,0; 10,0; 15,0; 20,0 мл стандартного раствора глюкозы или сахарозы. Содержимое колб выпаривают досуха на водяной бане и приливают по 20 мл хромовой смеси. Одновременно готовят холостую пробу. Все колбы помещают в сушильный шкаф на 20 мин при температуре 150°. После сжигания содержимое колб разбавляют дистиллированной водой точно до 50 мл и через сутки фотометрируют. По найденным значениям оптической плотности и известному содержанию углерода строят калибровочный график, который проверяют не реже одного раза в месяц.
С
а
m
одержание углерода находят по формуле:
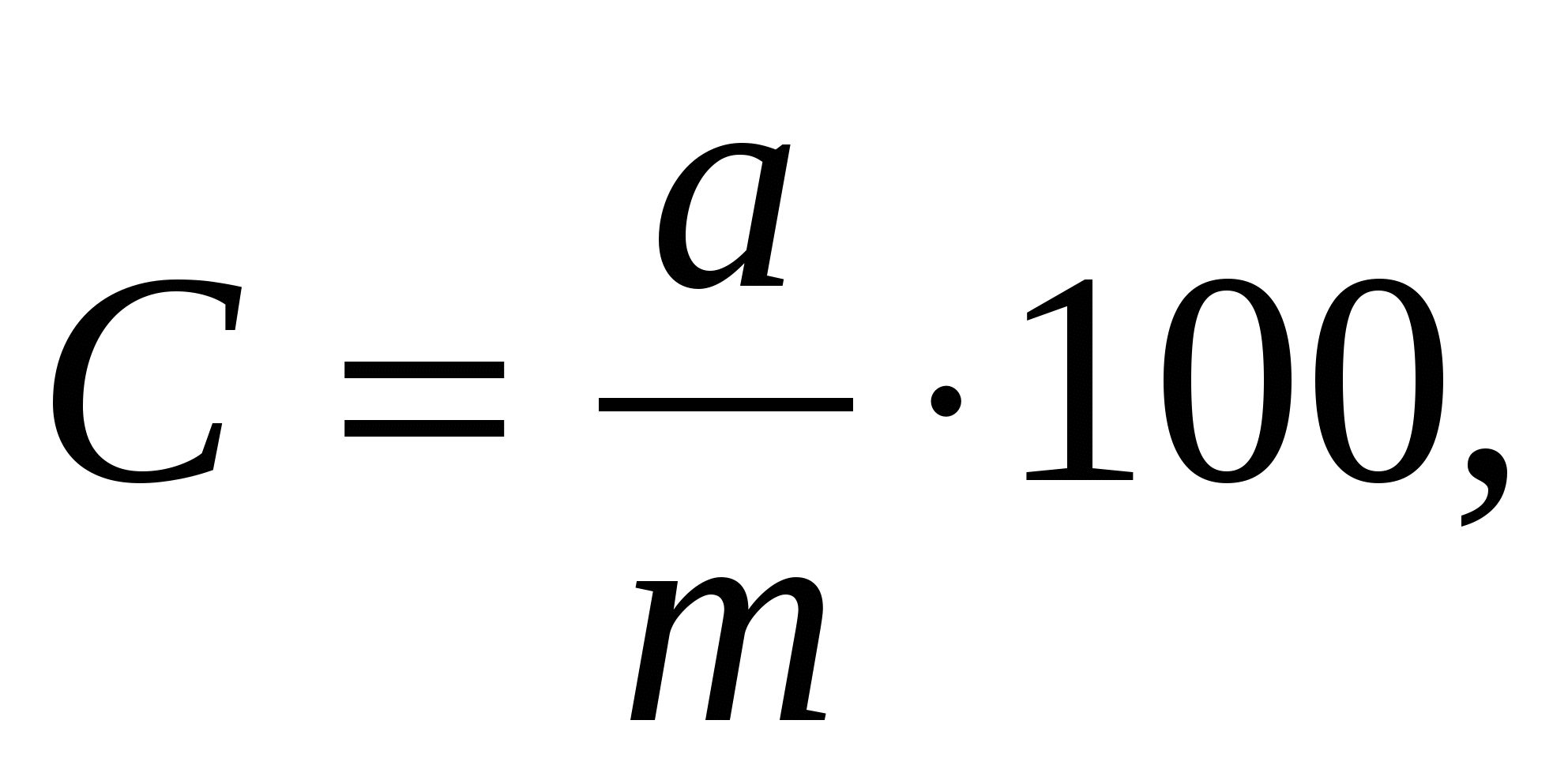
где С – содержание углерода в почве, %; а - содержание углерода, найденное по графику (г); m - навеска почвы (г).
При определении углерода в вытяжках формула имеет вид:
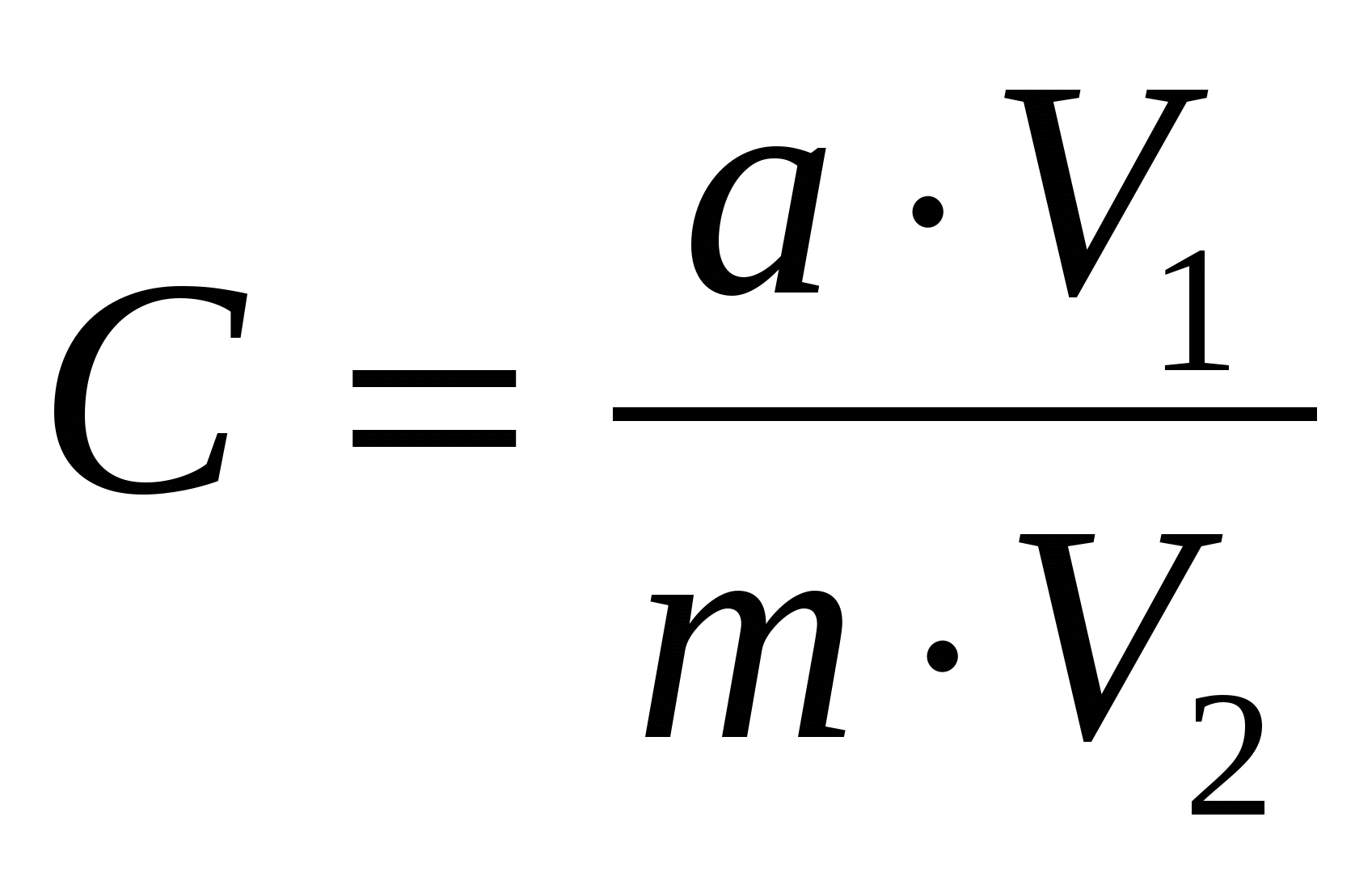
∙ 100 , где
V1 – общий объем вытяжки, мл; V2 – объем вытяжки, взятый для анализа, мл. Остальные обозначения, как и в предыдущей формуле.
3.3. Методы определения общего содержания азота почвы.
Азот относится к числу важнейших элементов питания растений, поэтому общий запас азота в почве является одним из показателей ее потенциального плодородия. Общее содержание азота варьирует от 0,03-0,05% в песчаных по гранулометрическому составу почвах, до 0,6-0,8% в тучных глинистых черноземах.
В почве азот находится преимущественно в органическом веществе. В гумусовых горизонтах почв на долю азота органических соединений приходится 93 – 97 % от его общего содержания, при этом до 70 – 90 % азота входит в состав специфических гумусовых веществ (табл. 22).
Таблица 22. Распределение запасов азота по группам гумусовых веществ (по данным Д.С. Орлова, 1992)
Почва
|
Всего азота, кг/га
|
Азот гуминовых кислот
|
Азот фульвокислот
|
Азот гумина
|
Азот декальцината и неспецифических веществ
|
кг/га
|
в % от общего
|
кг/га
|
в % от общего
|
кг/га
|
в % от общего
|
кг/га
|
в % от общего
|
Дерново-среднеподзолистая
|
3560
|
341
|
9,6
|
620
|
17,4
|
1628
|
45,7
|
625
|
17,6
|
Типичный чернозем
|
9890
|
1720
|
17,4
|
864
|
8,7
|
5158
|
52,1
|
1224
|
12,4
|
Серозем
|
3420
|
348
|
10,2
|
326
|
9,5
|
1824
|
53,3
|
555
|
16,2
|
Поскольку преобладающая часть азота почвы связана с органическим веществом, то его содержание и запасы, а так же распределение по почвенному профилю в основном повторяют закономерности профильного накопления и распределения органических веществ.
Для определения общего содержания азота в почве, чаще всего используют либо газоволюмометрические методы, основанные на термическом разложении органического вещества и измерении объема выделившегося азота, либо методы, предусматривающие мокрое озоление органического вещества. Среди последних методов наиболее широкое применение нашли методы Кьельдаля и Тюрина. Определение азота этими методами включает три этапа: озоление органического вещества, отгонку аммиака, количественное определение азота.
3.3.1. Определение общего содержания азота методом
Кьельдаля.
Метод основан на разложении (озолении) органического вещества почвы концентрированной серной кислотой при кипячении и последующем количественном учете образующегося азота.
При взаимодействии органического вещества с кипящей серной кислотой углерод и водород органических соединений окисляются до CO2 и H2O, а окислению азота препятствует образующийся в процессе реакции диоксид серы, поэтому он остается в восстановленной форме и превращается в сульфат аммония. Схематично, на примере аланина, являющегося одним из компонентов гумуса почвы, реакция будет протекать следующим образом:
2CH3CHNH2COOH + 13H2SO4 (NH4)2SO4 + 6CO2 + 16H2O + 12SO2
Раствор, содержащий сульфат аммония переносят в перегонную колбу, в которой аммиак вытесняется из сернокислой соли щелочью:
(NH4)2SO4 + 2NaOH 2NH3 + 2H2O + Na2SO4
Выделяющийся аммиак отгоняют в приемник, где он улавливается определенным объемом титрованного раствора серной кислоты:
2NH3 + H2SO4 (NH4)2SO4
По оставшемуся свободным и определенному титрованием раствором щелочи, количеству серной кислоты, находят количество поглощенного аммиака.
Для ускорения сжигания органического вещества прибавляют катализаторы – медь, ртуть или селен, а для повышения температуры кипения – сернокислый калий. Чтобы диоксид серы не улетучивался, колбу закрывают особой стеклянной пробкой с шарообразным расширением на одном конце и суженной на другом.
Метод Кьельдаля достаточно точен и широко применяется в исследованиях. Однако нитратный азот этим методом не определяется, и при его высоком содержании в почве можно получить заниженные результаты.
В этом случае рекомендуется метод Иодльбауэра, отличающийся от метода Кьельдаля тем, что почву обрабатывают не серной, а фенолсерной кислотой. Фенолсерную кислоту приготавливают растворением 40 г чистого фенола в 1 л концентрированной H2SO4.
|
 Скачать 2.43 Mb.
Скачать 2.43 Mb.