Сборник тестов по общей химии для студентов лечебнопрофилактического, педиатрического, медикопсихологического и медикодиагностического факультетов
 Скачать 201.82 Kb. Скачать 201.82 Kb.
|
|
Строение атома. Химическая связь. Массовое число атома равно: а) числу электронов; б) числу протонов; в) числу нейтронов; г) числу нуклонов. Изотопы – это разновидности атомов одного и того же элемента, которые отличаются друг от друга: а) числом протонов; б) числом электронов; в) числом электронных слоёв; г) атомной массой. Изотопы одного элемента содержат одинаковое количество: а) электронов; б) нейтронов; в) нуклонов; г) протонов Какие из перечисленных нуклидов являются изотопами по отношению друг к другу? а) 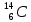 ; ; б) 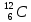 ; ;в) 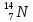 ; ;г) 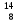 О. О.Для радиоактивного нуклида период полураспада – это время, за которое разрушается: а) один его атом; б) половина имеющихся атомов; в) четвертая часть имеющихся атомов; г) все имеющиеся атомы. Сколько в сумме протонов, электронов и нейтронов содержится в атоме нуклида 40К? а) 52; б) 56; в) 59; г) 61. Изотопами являются: а) нуклиды, имеющие одинаковые массовые, но разные протонные числа; б) нуклиды, имеющие одинаковые протонные, но разные массовые числа; в) нуклиды, содержащие одинаковое число нейтронов в ядре; г) нуклиды, содержащие одинаковое число нейтронов и электронов. Период полураспада радиоактивного нуклида – это время, за которое распадается: а) 10% имеющихся атомов; б) 25% имеющихся атомов; в) 50% имеющихся атомов; г) 75% имеющихся атомов. Укажите относительную массу атома, содержащего 19 электронов и 21 нейтрон: а) 38; б) 39; в) 40; г) 42. 10.Главное квантовое число всегда указывает на: а) количество электронных слоев в атоме; б) номер электронного слоя в атоме по мере удаления от ядра; в) номер периода, в котором данный атом расположен в таблице элементов Д.И.Менделеева; г) номер группы, в которой данный атом расположен в таблице элементов Д.И.Менделеева. 11.Орбитальное квантовое число l для электронов, расположенных на f-подуровне 5-го энергетического уровня, равно: а) 2; б) 3; в) 4; г) 5. 12.Возможное значение магнитного квантового числа ml для электрона, расположенного на d-подуровне 4 энергетического уровня, равно: а) –3; б) –2; в) +1; г) +4. 13.Возможное значение магнитного квантового числа ml для электрона, расположенного на 7р-подуровне, равно: а) –3; б) 0; в) +2; г) +7. 14.Число электронных орбиталей на внешнем электронном слое у атома элемента, расположенного в 3 периоде таблицы Д.И. Менделеева, равно: а) 3; б) 6; в) 8; г) 9. 15.Наибольшее число атомных орбиталей содержится на: а) р-подуровне; б) s-подуровне; в) f-подуровне; г) d-подуровне. 16.Порядок заполнения электронами орбиталей с одинаковым значением главного и орбитального квантовых чисел определяется: а) правилами Клечковского; б) правилом Вант – Гоффа; в) правилом Хунда; г) правилом Ле – Шателье. 17.Порядок заполнения электронами подуровней с разными значениями суммы главного и орбитального квантовых чисел определяется: а) первым правилом Клечковского; б) вторым правилом Клечковского; в) правилом Хунда; г) правилом Панета – Фаянса. 18.Порядок заполнения электронами подуровней с одинаковыми значениями суммы главного и орбитального квантовых чисел определяется: а) принципом Паули; б) первым правилом Клечковского; в) вторым правилом Клечковского; г) правилом Ле – Шателье. 19.Общее число электронов в молекуле серы равно 128. Сколько атомов серы входит в состав ее молекулы: а) 6; б) 8; в) 9; г) 10. 20.Какие частицы имеют такую же электронную конфигурацию, как и атом Кr? а) Вr-; б) Cl-; в) Rb+; г) Sr2+. 21.Какие из приведенных электронных конфигураций атомов или ионов невозможны в принципе? а) 1s22s22p42d1; б) 1s22s22p63s13p33d4; в) 1s22s23s13p73d104s1; г) 1s22s22p63s23p63d9. 22.На какой орбитали электрон будет обладать наибольшей энергией? а) 4f; б) 5s; в) 5р; г) 4d. 23.Какое максимальное число электронов может содержаться на четвертом энергетическом уровне? а) 24; б) 32; в) 48; г) 56. 24.Анион Э2- некоторого элемента имеет электронную конфигурацию 1s22s22p63s23p6. Сколько протонов содержат ядра атомов этого элемента? а) 15; б) 16; в) 17; г) 18. 25.На какой орбитали электрон будет обладать наименьшей энергией: а) 5s; б) 4d; в) 4f; г) 5р. 26.Энергетическим уровнем называется совокупность электронов в атоме, имеющих: а) одинаковые главные квантовые числа; б) близкое значение энергии; в) одинаковое значение спинового квантового числа; г) одинаковое значение орбитального квантового числа. 27.Атому какого элемента соответствует данная электронная конфигурация 1s22s22p63s13p3? а) фосфора; б) кремния; в) серы; г) азота. 28.Электронная формула иона Ве2+ выглядит следующим образом: а) 1s22s2; б) 1s22s22p2; в) 1s2; г) 1s22s1. 29.Электронная конфигурация хлорид-иона имеет вид: а) 1s22s22p5; б) 1s22s22p63s23p4; в) 1s22s22p63s23p5; г) 1s22s22p63s23p6. 30.Электронная формула иона S2– имеет вид: а)…3s23p4; б) …3s23p6; в) …3s23p2; г) …3s23p1. 31.Какие электронные формулы принадлежат элементам-металлам? а) 1s22s1; б) …3s13p1; в) 1s22s22p3; г) …3s23p4. 32.Какие из перечисленных элементов являются s-элементами? а) калий; б) серебро; в) бериллий; г) цинк. 33.Какие электронные формулы принадлежат р-элементам? а) 1s22s22p3; б)… 3s23p4; в) …3s23p33d1; г) …3s13p1. 34.Какие электронные формулы принадлежат s-элементам: а) 1s22s1; б) 1s22s22p63s13p1; в) 1s22s22p1; г) 1s22s22p5. 35.Какие электронные формулы соответствуют невозбужденному состоянию атома? а) …3s23p43d1; б) …3s23p63d14s2; в) … 3s23p6; г) …3s23p63d24s14p1. 36.Возбужденному состоянию атома хлора соответствует электронная конфигурация: а) 1s22s22p63s23p43d1; б) 1s22s22p63s23p5; в) 1s22s22p63s23p33d2; г) 1s22s22p63s13p33d3. 37.Возбужденному состоянию атома серы соответствует электронная конфигурация: а) 1s22s22p63s23p4; б) 1s22s22p63s23p33d1; в) 1s22s22p63s13p33d2; г) 1s22s22p63s23p6. 38.Какие электронные формулы соответствуют возбужденному состоянию атома? а) …3s23p43d1; б) …3s23p63d14s2; в) … 3s13p2; г) …3s2 3p63d24s14p1. 39.Порядковый номер элемента в таблице Менделеева соответствует: а) высшей валентности элемента; б) числу электронов в его атомах; в) числу нейтронов в ядрах его атомов; г) числу протонов в ядрах его атомов. 40.Электроотрицательность элементов в периодической системе Д.И. Менделеева: а) возрастает в периоде слева направо; б) уменьшается в периоде слева направо; в) возрастает в группе сверху вниз; г) уменьшается в группе сверху вниз. 41.В периодах слева направо: а) увеличивается энергия ионизации атомов; б) уменьшается энергия ионизации атомов; в) атомные радиусы увеличиваются; г) атомные радиусы уменьшаются. 42.Энергия сродства к электрону увеличивается: а) в периодах слева направо; б) в группах сверху вниз; в) в периодах справа налево; г) в группах снизу вверх. 43.У элементов, входящих в состав одной и той же А группы одинаково: а) число энергетических уровней; б) число электронов на внешнем электронном слое; в) величина заряда атомного ядра; г) низшая степень окисления. 44.Основные свойства сильнее всего выражены у гидроксида: а) Ве (ОН)2; б)Mg (ОН)2; в) Са (ОН)2; г) Ва (ОН)2. 45.Наиболее сильно кислотные свойства выражены у: а) H2SiO3; б) H3PO4; в) H2SO4; г) HClO4. 46.Номер периода всегда указывает для расположенных в нем элементов на: а) число электронов на внешнем электронном слое их атомов; б) число электронных слоев в их атомах; в) число подуровней на внешнем электронном слое их атомов; г) число вакантных орбиталей на внешнем электронном слое их атомов. 47.Номера А-групп в таблице Д.И. Менделеева указывают для расположенных в них элементов на: а) число электронных слоев в атоме; б) число электронов на внешнем слое атома; в) число электронов в атоме; г) число протонов в ядре атома. 48.Химические элементы, образующие летучие водородные соединения состава H2R, входят в: а) II A группу; б) III A группу; в) V A группу; г) VI A группу. 49.Химические элементы, образующие высшие оксиды состава R2O7, могут входить в: а) VB группу; б) VIIA группу; в) VIIB группу; г) VIB группу. 50.Элемент, образующий оксид состава R2O3, может входить в: а) VA группу; б) VIA группу; в) IIIA группу; г) IIIB группу. 51.Радиусы атомов в А группах сверху вниз: а) закономерно уменьшаются; б) закономерно увеличиваются; в) сначала уменьшаются, а потом увеличиваются; г) не изменяются. 52.Период в таблице Д.И.Менделеева образуют элементы: а) проявляющие одинаковые химические свойства; б) проявляющие в соединениях одинаковую высшую в валентность, равную номеру периода; в) имеющие одинаковое число энергетических уровней у своих атомов; г) содержащие на внешнем электронном слое одинаковое число электронов, равное номеру периода. 53.А-группы в полудлинном варианте таблицы Д.И. Менделеева объединяют элементы: а) имеющие одинаковые значения электроотрицательности; б) заполняющие электронами s- или р-подуровень внешнего слоя; в) принадлежащие только к неметаллам; г) валентные электроны которых расположены только на внешнем электронном слое. 54.В-группы в полудлинном варианте таблицы Д.И. Менделеева объединяют элементы: а) имеющие одинаковые значения энергии ионизации; б) принадлежащие как к металлам, так и к неметаллам; в) заполняющие электронами d-подуровень предвнешнего электронного слоя; г) валентные электроны которых расположены как на внешнем, так и на предвнешнем слое. 55.У d- и f-элементов с увеличением порядкового номера: а) не увеличивается величина заряда ядра атома; б) на внешнем электронном слое атомов не изменяется число электронов; в) на внешнем электронном слое атомов уменьшается число электронов; г) не изменяется атомная масса. 56.В периоде с увеличением порядкового номера элемента наблюдается: а) увеличение атомного радиуса и уменьшение энергии сродства к электрону; б) увеличение энергии ионизации и энергии сродства к электрону; в) уменьшение атомного радиуса и уменьшение значения электроотрицательности; г) увеличение значения электроотрицательности и увеличение энергии сродства к электрону. 57.В группе с увеличением порядкового номера элемента наблюдается: а) уменьшение энергии ионизации и уменьшение атомного радиуса; б) уменьшение энергии сродства к электрону и уменьшение электроотрицательности; в) увеличение атомного радиуса и увеличение энергии ионизации; г) увеличение значения электроотрицательности и энергии сродства к электрону. 58.Элемент, образующий твердое водородное соединение вида ЭН2, может входить в: а) VI А группу; б) VI В группу; в) II А группу; г) III В группу. 59.По номеру группы, в которой находится химический элемент, можно определить: а) число энергетических уровней в его атоме; б) число энергетических подуровней на внешнем электронном слое его атома; в) возможные значения валентности и степени окисления его атомов в соединениях; г) формулу его высшего оксида. 60.Какой период в таблице Д.И. Менделеева образован только s-элементами? а) седьмой; б) первый; в) второй; г) никакой. 61.В состав каких периодов могут входить d-элементы? а) первого; б) третьего; в) пятого; г) седьмого. 62.Электронная формула внешнего электронного слоя у атома элемента, образующего оксид состава R2О, может иметь следующий вид: а) ns1; б) ns2nр5; в) 2s22р3; г) ns2nр4. 63.Электронная формула внешнего электронного слоя у атома элемента, образующего оксид состава R2О3, может иметь следующий вид: а) ns2; б) ns2nр1; в) ns2nр3; г) ns2nр4. 64.Элементы какой группы проявляют одинаковую валентность в летучих водородных соединениях и высших оксидах? а) II А; б) IV А; в) V А; г) III В. 65.Высший оксид элемента имеет формулу RО2. Какова будет формула его летучего водородного соединения? а) Н2R; б) RН2; в) RН4; г) RН. 66.Формула летучего водородного соединения, которое образует данный элемент RН2. Какова будет формула его высшего оксида? а) RО2; б) R2О; в) RО3; г) RО4. 67.Электроотрицательность элемента – это: а) энергия, которую необходимо затратить, чтобы присоединить к внешнему электронному слою его атома 1 электрон; б) условная величина, характеризующая способность его атомов притягивать к себе электроны в химических соединениях от других атомов; в) энергия, которая выделяется при образовании атомом ковалентной химической связи; г) энергия, которая выделяется при отрыве от атома одного электрона. 68.Атомы элемента в возбужденном состоянии имеют следующую электронную конфигурацию 1s22s22p63s23p63d104s14p34d1. Формула летучего водородного соединения этого элемента: а) RH2; б) RH; в) RH3; г) RH4. 69.Суммарное количество электронов у атома элемента, находящегося в возбужденном состоянии, равно 53. Формула высшего оксида, который образует данный элемент: а)R2О3; б) R2О5; в) R2О7; г) RО4. 70.Отметьте верные характеристики для химического элемента с атомным номером 33: а) данный элемент является неметаллом; б) его электронная формула в возбужденном состоянии 1s22s22p63s23p63d104s24p3; в) формула его высшего оксида R2О5; г) в соединениях он может проявлять только положительную степень окисления. 71.К какой группе относится элемент, катион которого Э2+ имеет электронную конфигурацию 1s22s22p63s23p63d9? а) II A; б) V B; в) I В; г) VIII В. 72.К какому периоду относится элемент, катион которого Э3+ имеет следующую электронную конфигурацию 1s22s22p63s23p63d104s24p6? а) 3; б) 4; в) 5; г) 6. 73.Масса всех электронов у атома элемента равна 2,639∙10-26 г. В какой группе находится данный элемент, если известно, что масса одного электрона равна 9,1∙10-31 кг? а) II A; б) V B; в) I В; г) III A. 74.Масса всех электронов у аниона элемента вида Э-2 равна 4,914∙10-26 г. В какой группе находится данный элемент, если известно, что масса одного электрона равна 9,1∙10-31 кг? а) V B; б) VI А; в) III A; г) IV B. 75.В какой массе меди содержится 1 г электронов, если известно, что масса одного электрона равна 9,1·10-31кг? а)3,26кг; б) 4,002 кг; в) 4,032 кг; г) 4,324 кг. 76.В каком ионе степень окисления фосфора равна «+5»? а) Н2Р2О72-; б) НРО32-; в) РО3-; г) НРО42-. 77.В каком ионе хром проявляет максимальную степень окисления? а) СrО42-; б) НСr2О7-; в) Сr(ОН)2+; г) Сr3+. 78.Отметьте формулы молекул, в которых атом неметалла находится в состоянии sр3 - гибридизации: а) NН3; б)Н2О; в)ВF3; г) С2Н4. 79.В молекулах каких веществ имеются атомы, находящиеся в состоянии sр-гибридизации? а) ВеСl2; б) ССl4; в)С2Н4; г) С6Н6. 80.Атомы каких элементов могут являться акцепторами электронных пар? а) Nе; б) Аl; в) F; г) Сu. 81.Атомы каких элементов могут являться донорами электронных пар? а) Не; б) Li; в) О; г) Nа. 82.Механизм образования химической связи за счет неподеленной пары электронов одного атома и свободной орбитали другого атома называется: а) обменным; б) ионным; в) донорно-акцепторным; г) диполь – дипольным. 83.Связи какого типа присутствуют в кристаллической решетке вещества, образованного атомами, имеющими следующие электронные конфигурации – 1s22s22p63s1 и 1s22s22p63s23p5? а) ионные; б) ковалентные полярные; в) ковалентные неполярные; г) водородные. 84.Минимальная степень окисления в соединениях атома, имеющего следующую электронную конфигурацию – 1s22s22p63s23p4? а) +2; б) -1; в) -2; г) -4. 85.Сколько ковалентных связей по обменному механизму может образовать атом, имеющий следующую электронную конфигурацию 1s22s2 2p3: а) 3; б) 6; в) 4; г) 5. 86.Сколько ковалентных связей по обменному механизму может образовать атом, имеющий следующую электронную конфигурацию 1s22s22p4? а) 2; б) 3; в) 4; г) 7. 87.Какую высшую степень окисления может проявлять атом, имеющий следующую электронную формулу 1s22s22p63s23p1? а) +5; б) +4; в) +3; г) +2. 88.Какую высшую степень окисления может проявлять атом, имеющий следующую электронную конфигурацию 1s22s22p63s23p4? а) +2; б) +4; в) +6; г) +7. 89.Какое минимальное число ковалентных связей по обменному механизму может образовать атом, имеющий следующую электронную конфигурацию 1s22s22p63s23p5? а) 5; б) 3; в) 7; г) 1. 90.Какую максимальную степень окисления может проявлять атом, имеющий следующую электронную конфигурацию 1s22s22p3? а) +3; б) +4; в) +5; г) +6. 91.Сколько ковалентных связей по обменному механизму может образовывать атом, имеющий следующую электронную конфигурацию 1s22s22p63s23p2? а) 2; б) 5; в) 4; г) 7. 92.Какую высшую степень окисления может проявлять атом, имеющий следующую электронную конфигурацию 1s22s22p4? а) +4; б) –4; в) +2; г) –2. 93.Какое максимальное число ковалентных связей по обменному механизму может образовать атом, имеющий следующую электронную конфигурацию 1s22s22p63s23p4? а) 5; б) 6; в) 7; г) 8. 94.Какую высшую степень окисления может проявлять атом, имеющий следующую электронную конфигурацию 1s22s22p63s23p5? а) +5; б) +3; в) +1; г) +7. 95.Сколько ковалентных связей по обменному механизму может образовать атом, имеющий следующую электронную конфигурацию …3s23p63d104s24p2? а) 4; б) 6; в) 3; г) 5. 96.Атомы каких элементов в соединениях с другими атомами всегда проявляют постоянную валентность? а) О; б) Н; в)N; г) S. 97.Атомы каких элементов проявляют в соединениях с другими элементами постоянную степень окисления? а) N; б) H; в) Ca; г) Na. 98.Валентность азота в ионе аммония NH4+ равна: а) 3; б) 4; в) 5; г) 6. 99.Степень окисления кислорода в ионе гидроксония равна: а) –3; б) –2; в) +2; г) +3. 100.Образование -связи происходит за счет: а) перекрывания двух s-электронных облаков; б) бокового перекрывания двух р-электронных облаков; в) перекрывания s- и р- электронных облаков; г) осевого перекрывания двух р- электронных облаков. 101.-связь образуется за счет: а) перекрывания двух s-электронных облаков; б) бокового перекрывания двух р-электронных облаков; в) перекрывания одного s-электронного и одного р-электронного облаков; г) бокового перекрывания двух р-электронных облаков, имеющих одинаковое значение ms (спинового квантового числа). 102.Длина связи – это: а) удвоенная сумма радиусов взаимодействующих атомов; б) расстояние между ядрами связанных атомов; в) длина области перекрывания электронных облаков; г) сумма радиусов взаимодействующих атомов. 103.Энергия связи – это: а) энергия, выделяющаяся при образовании связи; б) энергия, необходимая для разрыва связи; в) энергия, необходимая для отрыва одного электрона с внешнего слоя атома; г) энергия, необходимая для перевода молекулы в активное состояние. 104.Ионная связь характеризуется: а) длиной; б) энергией; в) направленностью; г) насыщаемостью. 105.Между атомами, имеющими следующую электронную конфигурацию 1s22s22p63s23p1, образуется химическая связь: а) ковалентная полярная; б) ковалентная неполярная; в) водородная; г) металлическая. 106.Между атомами, имеющими электронную конфигурацию 1s22s22p5, образуется химическая связь: а) ковалентная полярная; б) ковалентная неполярная; в) водородная; г) металлическая. 107.Между атомами, имеющими электронную конфигурацию 1s22s22p3 и 1s22s22p5, образуется химическая связь: а) ковалентная полярная; б) ковалентная неполярная; в) водородная; г) металлическая. 108.В какой молекуле, из перечисленных ниже, длина связи наименьшая? а) F2; б) Cl2; в) Вr2; г) H2. 109.Молекулы каких перечисленных ниже веществ не могут образовать водородные связи с молекулами воды? а)метан; б) аммиак; в) азот; г) метиламин. 110.В каком из перечисленных ниже соединений наибольшая длина связи? а) HF; б) HCl; в) HBr; г) HI. 111.В каких парах веществ между молекулами могут образоваться водородные связи? а) Н2О и NH3; б) HF и H2O; в)СH4иN2; г) N2 и H2O. 112.Какая связь между атомами в молекуле NH3? а) ковалентная полярная; б) водородная; в) - связь; г) ковалентная неполярная. 113.Между молекулами воды образуются: а) ковалентные полярные связи; б) ковалентные неполярные связи; в)-связи; г) водородные связи. 114.В какой из перечисленных ниже молекул длина связи наименьшая? а) Br2; б) Cl2; в) I2; г) HCl. 115.Самая большая длина связи между атомами в молекуле: а) СН4; б) SiH4; в) GeH4; г) SnH4. 116.Ядра всех атомов лежат на одной прямой в молекуле: а) воды; б) этина; в) аммиака; г) бериллий хлорида. 117.Молекула аммиака и ион аммония различаются между собой: а) степенью окисления атома азота; б) суммарным числом электронов; в) валентностью атома азота; г) суммарным числом протонов. 118.Сколько электронов участвует в образовании химических связей в молекуле SО2? а)2; б) 4; в) 6; г) 8. 119.Укажите число σ-связей в молекуле высшего оксида элемента, атом которого в возбужденном состоянии имеет электронную конфигурацию внешнего слоя 2s12р3: а) 0; б) 4; в) 3; г) 2. 120.Укажите число π-связей в молекуле высшего оксида элемента, атом которого в возбужденном состоянии имеет электронную конфигурацию внешнего электронного слоя 3s13р33d2: а)0; б) 1; в) 2; г) 3. 121.В каком ряду угол связи между атомами в молекулах последовательно возрастает? а) Н2О, NН3, СН4, ВеСl2; б) NН3, ССl4, ВF3, С2Н2; в) ВСl3, СН4, ВеF2, С2Н4; г) С2Н4, СН4, С2Н2, С6Н6. 122.В каком ряду молекулы всех веществ могут образовывать водородные связи с молекулами Н2О: а)СН4,СF4,NН3,РН3? б) NН2ОН, СН3ОН, НF, N2Н4; в) Н2, О2, N2, F2; г) СН2О, РСl5, F2O, СН4. 123.Полярной является молекула: а) СО2; б) Н2О; в) ВF3; г) NН3. 124.Неполярной является молекула: а) N2; б) Р4; в) НCl; г) СCl4 125.В молекулах каких веществ все атомы лежат в одной плоскости? а) ВF3; б) CF4; в) NH3; г) С2Н4. 126.Молекулы каких веществ могут образовывать ковалентные связи по донорно-акцепторному механизму, выступая при этом только в роли донора электронной пары? а) Н2О; б) NН3; в) СО; г) ВF3. 127.Молекулы каких веществ могут образовывать ковалентные связи по донорно-акцепторному механизму, выступая в роли акцептора электронной пары? а) F2; б) BCl3; в) СО2; г) СН3NН2. 128.В каком ряду молекулы всех веществ могут образовать водородные связи с молекулами Н2О? а) NH3, CH3OH, CH3−C(O)−CH3, HCOOH; б) CH3NH2, C6H5OH, C6H5NH2, НF; в) COCl2, CBr4, NF3, NH2ОН; г) Н2, СО2, СН4, C6Н5Cl. 129.Гибридизация – это: а) перекрывание более двух электронных облаков при образовании химической связи; б) самопроизвольное изменение формы и взаимного расположения в пространстве атомных орбиталей; в) процесс образования между двумя атомами кратных связей; г) процесс выравнивания в молекуле длин связей между атомами. 130.Гибридные электронные облака в отличие от электронных облаков, не подвергнувшихся гибридизации, способны: а) образовывать более прочные ковалентные связи; б) образовывать, наряду с σ−связями, и π−связи; в) участвовать в образовании сопряженных связей; г) участвовать в образовании неполярных ковалентных связей. 131.В образовании π−связей могут принимать участие: а) электронные облака, подвергнувшиеся гибридизации; б) s−электронные облака; в) р–электронные облака; г) d−электронные облака. 132.Выберите верные утверждения: а) межмолекулярные взаимодействия наиболее сильные между полярными молекулами; б) межмолекулярные взаимодействия между неполярными молекулами не могут иметь электростатическую природу; в) гибридные электронные облака не способны образовать между собой π−связи; г) энергия образования химической связи и энергия ее разрыва численно совпадают. 133.Ненаправленной является: а) ковалентная полярная и ковалентная неполярная связи; б) ионная связь; в) металлическая связь; г) водородная связь. 134.Длины связей в молекулах НF и НВr равны, соответственно, 0,092 и 0,141 нм. Укажите длины связей (нм) в молекулах НСl и НI, соответственно: а) 0,082 и 0,134; б)0,128и0,160; в) 0,151 и 0,172; г) 0,092 и 0,145. 135.Энергия связи Э–Н в молекулах SbН3 и РН3 равна, соответственно. 256 и 323 кДж/моль. Укажите энергию связи Э–Н в молекулах NH3 и AsН3, соответственно: а)310и240; б) 280 и 320; в) 380 и 281; г) 190 и 450. 136.Максимальный угол между гибридными орбиталями атомов углерода в молекулах: а) С2Н6; б) С6Н6; в) С2Н4; г) С2Н2. |
