Сборник тестов по общей химии для студентов лечебнопрофилактического, педиатрического, медикопсихологического и медикодиагностического факультетов
 Скачать 201.82 Kb. Скачать 201.82 Kb.
|
|
Катализ 1. Катализаторы – это вещества, которые: ускоряют химическую реакцию, но сами в ней не расходуются; ускоряют химическую реакцию и расходуются в результате ее протекания; замедляют химическую реакцию и сами в ней не расходуются; замедляют химическую реакцию и расходуются при ее протекании. 2. Катализатор в случае обратимой реакции: изменяет скорость только прямой реакции; изменяет скорость только обратной реакции; в одинаковой мере изменяет скорость как прямой, так и обратной реакции; не влияет на скорость прямой и обратной реакции. 3. Скорость реакции в случае гомогенного катализа: не зависит от концентрации катализатора; уменьшается при повышении концентрации катализатора; возрастает при повышении концентрации катализатора; зависит от концентрации активных центров на поверхности катализатора. 4. Скорость реакции в случае гетерогенного катализа: зависит от площади катализатора; зависит от концентрации катализатора; зависит от числа активных центров на поверхности катализатора; зависит от цвета катализатора. 5. Каталитической не может быть реакция: разложения; соединения; ионного обмена, протекающая в водном растворе между сильными электролитами; окислительно−восстановительная. 6. Укажите схемы каталитических реакций: NaOH(р-р) + НCl(р-р) →; 2SО2 + О2 →; 2Н2 + О2 →; СН3−С(О)−О−СН3 + Н2О → . 7. Скорость реакции при гетерогенном катализе зависит от: площади поверхности твердого катализатора; количества активных центров на поверхности катализатора; цвета и формы катализатора; концентрации твердого катализатора. 8. При гомогенном катализе: исходные вещества адсорбируются на поверхности катализатора; молекулы катализатора взаимодействуют с молекулами одного из исходных веществ, образуя нестойкое промежуточное соединение; скорость реакции зависит от концентрации катализатора в реакционной системе; катализатор расходуется ко времени окончания реакции. 9. Ингибиторы – это: вещества, уменьшающие скорость химической реакции; каталитические яды; вещества, не влияющие на скорость химической реакции; вещества, увеличивающие время протекания химической реакции до наступления равновесия. 10. Вещества, усиливающие действие катализаторов, называются: ингибиторами; активаторами; стабилизаторами; промоторами. 11. Антиоксидантами называются: вещества, уменьшающие скорость процесса окисления; вещества, способствующие интенсификации процессов окисления; ингибиторы, влияющие на протекание процессов окисления; вещества, не способные взаимодействовать с кислородом. 12. Автокаталитическими называются такие реакции, в которых: в роли катализатора выступает один из реагентов; в роли катализатора выступает один из продуктов реакции; скорость реакции возрастает за счет действия какого – нибудь внешнего фактора; скорость реакции все время находится на высоком уровне и не зависит от действия внешних и внутренних факторов. 13. Соответствующим образом подобранный катализатор может ускорить: любую химическую реакцию; как прямую, так и обратную реакцию, способную протекать при данных условиях; только термодинамически возможные, при данных условиях, реакции, которые сопровождаются уменьшением свободной энергии Гиббса (ΔG<0); только те реакции которые сопровождаются возрастанием при данных условиях свободной энергии Гиббса (ΔG>0). 14. Характерной особенностью катализа является то что: содержание катализатора в реакционной смеси по сравнению с количествами исходных веществ должно быть во много раз больше; химическое количество катализатора в реакционной смеси должно быть примерно одинаковыми с химическим количеством исходных веществ; содержание катализатора в реакционной смеси должно быть значительно меньше, чем химические количества исходных веществ; скорость каталитической реакции всегда не зависит от количества катализатора, присутствующего в реакционной смеси. 15. Селективные катализаторы, в отличие от обычных: могут изменять скорость реакции только при строго определённых условиях; могут изменять скорость реакции только в том случае, если их содержание в системе становится больше строго определённой величины; могут изменять не только скорость реакции, но и направление её протекания; действую на сложную реакцию, увеличивают скорость только одной из нескольких параллельно протекающих реакций. 16. Из нескольких возможных реакций катализатор обычно: всегда ускоряет только ту, которая сопровождается наибольшей убылью свободной энергии Гиббса; ускоряет только какую то определённую реакцию, протекающую между строго конкретными веществами; в одинаковой мере ускоряет все реакции; всегда ускоряет только ту реакцию, которая сопровождается наименьшей убылью свободной энергии Гиббса. 17. Катализатор: участвует в элементарном акте реакции; не участвует в образовании промежуточного соединения с каким - либо участником реакции в случае протекания многостадийного процесса; образует активированный комплекс со всеми реагирующими веществами в случае протекания одностадийного процесса; постепенно расходуется в ходе химической реакции. 18. В результате протекания каталитической реакции катализатор: претерпевает химическое превращения; остаётся химически неизменным; сохраняет своё количество постоянным (если не учитывать механического уноса и возможности протекания побочных процессов, в которых он выступает в роли реагента); всегда уменьшает своё изначальное химическое количество. 19. Природные катализаторы, имеющие белковую природу и ускоряющие протекание биохимических реакций в животных и растительных клетках называются: ферментами; антиоксидантами; витаминами; антиглобулинами. 20. Отличительной особенностью ферментов от других катализаторов является то, что они: способны ускорять любую биохимическую реакцию; обладают более высокой каталитической активностью; являются строго специфичными; проявляют свою максимальную активность в строго определённых внешних условиях. 21. Субстратной специфичностью фермента является: его способность ускорять только прямую реакцию до наступления в системе химического равновесия; его способность проявлять каталитическую активность только по отношению к какому- нибудь одному исходному веществу (субстрату); его способность проявлять каталитическую активность по отношению в разным субстратам, имеющим определённые структурные фрагменты; его способность ускорять как прямую, так и обратную реакцию до наступления в системе химического равновесия 22. Способность фрагмента проявлять каталитическую активность только по отношению к одному из стереоизомеров исходного вещества называется его: стереоспецифичностью; субстратной специфичностью; групповой специфичностью; селективностью. 23. В пищевой промышленности антиоксиданты используются для: увеличения сроков хранения жиров и жиросодержащих продуктов; уменьшения скорости протекания процессов окисления; увеличения скорости протекания процессов окисления; подавления действия ферментов на продукты при их употреблении в пищу. 24. Ферментом с групповой специфичностью является: пепсин; амилаза; алкогольдегидрогеназа; трипсин. 25. Ферментом с субстратной специфичностью является: пепсин; амилаза; уреаза; трипсин. Электрохимия. Электропроводимость растворов. 1. К проводникам первого рода относятся: золото; бронза; латунь; расплав хлорида натрия. 2. К проводникам второго рода относятся: чугун; расплав оксида алюминия; раствор глюкозы; раствор формиата натрия. 3. Диэлектриком является: алмаз; графит; эбонит; резина. 4. К проводникам второго рода относятся: раствор гексана в бензоле; раствор ацетона в воде; раствор хлороводорода в воде; раствор серы в гексане. 5. Электропроводность – это: количественная характеристика способности вещества проводить электрический ток; суммарный электрический заряд, проходящий через вещество за единицу времени при приложении к нему разности потенциалов в 1 В; суммарный электрический заряд всех частиц вещества, содержащихся в 1 моле вещества и способных перемещаться под действием электрического тока; качественная характеристика подвижности частиц вещества, способных перемещаться под действием внешнего электрического поля. 6. Единицей измерения электропроводимости в системе СИ является: См (Сименс); Ом-1; В; А. 7. Под удельной электропроводностью раствора электролита в системе СИ подразумевают: скорость перемещения (м/с) ионов в нем при наложении внешнего электрического поля с разностью потенциалов 1 В; электропроводность объема раствора, заключенного между двумя параллельными электродами, имеющими площадь поверхности в 1 м2 каждый и расположенными на расстоянии 1м друг от друга; силу тока, возникающего в 1 м3 раствора, расположенного между двумя параллельными электродами площадью 1 м2 каждый, при наложении разности потенциалов 1 В; суммарный электрический заряд проходящий за 1 сек. через 1 м3 раствора, при наложении разности потенциалов 1 В. 8. Удельная электропроводность раствора в системе СИ измеряется в: В · 1 м3.; См · м-1; Ом-1 · м-1; В · м. 9. Удельная электропроводность растворов зависит от: концентрации электролита в растворе; природы растворенного в нем электролита; приложенной разности потенциалов; температуры. 10. Удельная электропроводность раствора слабого электролита зависит от : степени диссоциации электролита; внешнего давления над раствором; приложенной разности потенциалов; концентрации электролита. 11. Удельная электропроводность растворов сильных электролитов при увеличении их концентрации: всегда возрастает; всегда уменьшается; сначала уменьшается, а затем возрастает; сначала возрастает, а затем уменьшается. 12. На величину удельной электропроводности раствора оказывают влияние такие свойства ионов, как: их окраска в растворе; величина заряда; радиус; степень гидратации. 13. Удельная электропроводность растворов слабых электролитов в отличие от сильных: с увеличением концентрации возрастает в меньшей степени; не зависит от температуры; сначала возрастает, а затем уменьшается; при одной и той же молярной концентрации всегда будет значительно меньше. 14. Уменьшение удельной электропроводности сильных электролитов в концентрированных растворах по сравнению с разбавленными связано с: уменьшением степени диссоциации электролита; увеличением сил электростатического взаимодействия между ионами; образованием ассоциатов (ионных двойников, тройников и т.д.); интенсификацией процесса образования ионных атмосфер. 15. Значительно большая скорость движения ионов Н+ и ОН- в водной среде по сравнению с другими ионами объясняется: малыми размерами этих ионов; отсутствием у этих ионов гидратной оболочки; эстафетным механизмом перемещения данных ионов; большой плотностью электрического заряда у данных ионов. 16. Удельная электропроводность растворов электролитов по сравнению с металлическими проводниками: значительно выше; во много раз меньше; находится примерно на одинаковом уровне; в зависимости от природы электролита может иметь как большее, так и меньшее значение. 17. Эквивалентная электропроводность в системе СИ характеризует: электрическую проводимость раствора, содержащего 1 моль химического эквивалента растворенного вещества; электрическую проводимость 1 м3 раствора электролита; электрическую проводимость 1 м3 раствора, содержащего 1 моль электролита; электрическую проводимость раствора, содержащего 1 моль растворенного вещества. 18. Для сильных и слабых электролитов эквивалентная электропроводность: возрастает с увеличением концентрации раствора; возрастает с уменьшением концентрации раствора; зависит от их природы; возрастает с увеличением температуры. 19. Эквивалентная электропроводность достигает максимального значения: в насыщенных растворах электролитов; в сильно разбавленных растворах электролитов; в растворах, содержащих 1 моль растворенного вещества; в растворах, содержащих 1 г растворенного вещества. 20. В сильно-разбавленных растворах электролитов λ∞ приобретает наибольшее значение, т.к.: в этом случае количество ионов электролита достигает своей максимальной величины; взаимодействия между ионами в растворе отсутствуют; степень диссоциации как сильных так и слабых электролитов приближается к 1; образование ионных атмосфер не происходит. 21.Согласно закона Кольрауша: λ∞ = λк + λа; λ∞ = F ∙ (uк + ua); λV = С· 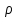 ∙ V ∙ VλV = Uk + Ua. 22. Абсолютная подвижность иона Uk или Ua равна: скорости движения катиона или аниона в насыщенном растворе электролита; скорости теплового движения катионов или анионов электролита в бесконечно-разбавленном растворе; скорости движения катионов или анионов электролита в сильно-разбавленном растворе при приложенной разности потенциалов 1 В/м; скорости движения катионов или анионов электролита в растворе объемом 1 м3. 23. Кондуктометрический метод анализа основан: на измерении эквивалентной электропроводности раствора λV; на измерении эквивалентной электропроводности раствора при бесконечном разбавлении; на измерении удельной электропроводности раствора при разных концентрациях растворенного вещества; на измерении оптической плотности раствора. 24. Точку эквивалентности при кондуктометрическом титровании определяют: с помощью индикатора; с помощью вспомогательного вещества; визуально, на основании изменения внешнего вида раствора; графическим путем на основании резкого изменения измеренной электропроводности раствора по мере добавления титранта. 25. На основании измерения эквивалентной электропроводности при данной концентрации вещества (λV ) и в сильно разбавленных растворах ( λ∞) можно определить: степень диссоциации слабого электролита; константу диссоциации слабого электролита в растворе; концентрацию электролита в растворе; массу и заряд иона электролита в растворе. 26. Предельная электрическая проводимость электролита (λ∞ ) достигается: в насыщенном растворе; в растворе, содержащем 1 моль вещества; в сильно разбавленном растворе; при температуре, близкой к температуре кипения раствора. 27. Предельная электрическая проводимость электролита (λ∞ ) зависит от: концентрации раствора; скорости движения ионов электролита в растворе; взаимодействия между ионами электролита в растворе; размеров и прочности «ионных атмосфер». 28. Повышение удельной электропроводности растворов при увеличении температуры связано с: уменьшением вязкости раствора; увеличением скорости движения ионов; с возрастанием степени диссоциации слабого электролита; с уменьшением степени диссоциации молекул растворителя. 29. В системе СИ эквивалентная электропроводность измеряется в : См · моль · см; Ом-1· моль · см3; См · моль-1· м2; Ом-1· моль-1 · м2. 30. При кондуктометрическом титровании сильной кислоты щелочью: удельная электропроводность раствора в точке эквивалентности достигает своего максимального значения; удельная электропроводность раствора в точке эквивалентности достигает своего минимального значения; в обязательном порядке необходимо присутствие кислотно-основного индикатора; исходные растворы могут быть мутными или окрашенными. 31.Величина электрического заряда, возникающего на единице площади металлической пластинки, опущенной в дистиллированную воду, зависит от: природы металла, из которого выполнена пластинка; температуры системы; объема воды; формы металлической пластинки. 32. На поверхности металлической пластинки, опущенной в дистиллированную, воду всегда возникает: положительный заряд; заряд равный 0; отрицательный заряд; на одной части пластинки – положительный заряд, на другой – отрицательный. 33. Переход катионов металла с поверхности металлической пластинки в воду обусловлен: тепловым движением ионов в металлическом образце; действием молекул растворителя на кристаллическую решетку металла; процессами диффузии; гидратацией катионов металла, расположенных на поверхности кристаллической решетки. 34. Отрицательный заряд, возникающий на поверхности металлической пластинки, опущенной в дистиллированную воду, обусловлен: переходом анионов из жидкой фазы на пластинку; присоединением атомами и ионами металлов, расположенных в узлах кристаллической решетки, электронов, высвобождающихся в ходе окисления молекул воды; избыточным содержанием в кристаллической решетке металла свободных электронов, образующихся после перехода части катионов Меn+ в жидкую фазу; переходом части свободных электронов из кристаллической решетки металла в воду. 35. Пластинки, выполненные из активных металлов (Mg, Zn, Fe) в растворе собственной соли, как правило: заряжаются отрицательно; заряжаются положительно; не заряжаются; меняют знак заряда со временем. 36. Пластинки, выполненные из малоактивных металлов(Cu, Ag, Hg, Pt, Au), в растворе собственной соли, как правило: заряжаются отрицательно; не заряжаются; заряжаются положительно; в течение длительного времени периодически меняют знак заряда. 37. Металлическим электродом называется: система, состоящая из металлической пластинки, опущенной в расплав собственного металла; система, состоящая из растворов двух солей, контактирующих друг с другом через пористую перегородку; система, состоящая из контактирующих друг с другом двух пластинок, разнородных металлов; система, состоящая из металлической пластинки, опущенной в раствор собственной соли; 38.Цинковая пластинка, опущенная в раствор сульфата цинка, является: металлическим электродом первого рода; металлическим электродом второго рода; обратимым электродом; необратимым электродом; 39.Стандартным электродным потенциалом Е0 для металлического электрода называется: потенциал, условно принятый за стандарт; потенциал, который возникает на электроде при определённых стандартных значениях температуры и внешнего давления системы; потенциал, который возникает на электроде при активности ионов металла соли в растворе равной 1моль/дм³ и температура 250С; потенциал, который возникает на электроде при активности ионов металла соли в растворе большей, чем 1моль/дм³. 40.Величина электродного потенциала для металлического электрода рассчитывается по уравнению: 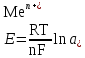 ; ;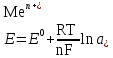 ; ;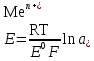 ; ;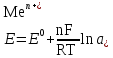 . .41.Серебрянная пластинка, покрытая слоем хлорида серебра и опущенная в насыщенный раствор хлорида калия, является: электродом первого рода; электродом второго рода; редокс-электродом; необратимым электродом. 42.В каком ряду металлы расположены по возрастанию их восстановительной активности в реакциях протекающих в водной среде: Ag, Fe, Li, Na; Zn, Al, Mg, K; Na, Zn, Fe, Cu; Na, Ca, K, Li; 43.В каком ряду ионы металлов расположены по возрастанию их окислительной активности в реакциях протекающих в водной среде? Li+, K+, Ca2+, Mg2+; K+, Cu2+, Ag+, Au3+; Hg2+, Ag+, Cu2+, Fe2+; Mg2+, Pb2+, Al3+, Cr3+. 44.По отношению к растворам солей Mg будет выступать в роли восстановителя в случае протекания между ними реакции? K2SO4; FeSO4; CuSO4; Na2SO4. 45.По отношению, к каким металлам ионы Cu2+ в водном растворе будут выступать в роли окислителя? Ag; Pt; Pb; Fe; 46.Величина электродного потенциала для электрода второго рода зависит: от концентрации ионов металла труднорастворимой соли в растворе; от концентрации аниона, общего для труднорастворимой и хорошо растворимой солей; от концентрации катионов металла хорошо растворимой соли; от общей концентрации всех ионов в растворе. 47. Примером электродов второго рода могут служить: цинковый электрод; водородный электрод; каломельный электрод; стеклянный электрод. 48. Потенциал хлорсеребряного электрода при t=250С можно рассчитать по уравнению:  ; ; ; ; ; ;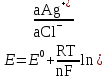 . .49. Экспериментально измеренная величина электродного потенциала показывает: во сколько раз она больше величины потенциала стандартного водородного электрода; во сколько раз она меньше величины потенциала стандартного водородного электрода; на сколько она меньше или больше величины потенциала стандартного водородного электрода; абсолютное значение. 50.Потенциал Е2 определяемого электрода равен измеренной разности потенциалов Е2 –Е1 = ΔЕ, если: его величина больше, чем величина электрода сравнения Е1; его величина меньше, чем величина электрода сравнения Е1; его величина равна величине электрода сравнения Е1; его величина равна нулю. 51.Потенциал Е2 определяемого электрода равен Е1- ΔЕ , если: его величина больше, чем величина электрода сравнения Е1; его величина меньше, чем величина электрода сравнения Е1; его величина равна величине электрода сравнения Е1; его величина равна нулю. 52.При измерении электродных потенциалов равным нулю принимают: стандартный потенциал водородного электрода; стандартный потенциал хлорсеребряного электрода; стандартный потенциал каломельного электрода; потенциал водородного электрода, независимо от концентрации кислоты в растворе. 53.Стандартным или нормальным электродным потенциалом металла называют разность потенциалов: между металлом, погружённым в дистиллированную воду и стандартным водородным электродом; между металлом, погружённым в раствор своей соли и водородным электродом; между металлом, погружённым в раствор своей соли с активностью ионов Меn+ равной 1моль/дм3 и стандартным водородным электродом; между раствором соли с активностью ионов одноименного металла Меn+ равной 1моль/дм3, и водородным электродом. 54.Редокс-системами называются растворы, содержащие в своём составе: не менее двух веществ; любые два вещества, одно из которых может выступать в роли окислителя, а второе – в роли восстановителя; два вещества, в которых атомы одного и того же элемента находятся в разной степени окисления; более двух веществ, обладающих окислительно-восстановительной двойственностью. 55.Окисленной формой редокс-системы всегда называется то вещество, в котором: атомы элемента имеют большую степень окисления; атомы элемента имеют положительную степень окисления; атомы элемента имеют отрицательную степень окисления; атомы элемента имеют меньшую степень окисления. 56. Восстановленной формой редокс-ситемы всегда называется то вещество, в котором: атомы элемента имеют большую степень окисления; атомы элемента имеют положительную степень окисления; атомы элемента имеют отрицательную степень окисления; атомы элемента имеют меньшую степень окисления. 57. Переход окисленной формы в восстановленную и наоборот заключается только в обмене между ними электронами для следующих редокс-систем: Fe3+/ Fe2+; MnO4-/Mn2+; [Fe3+(CN)6]3–/[Fe2+(CN)6]4–; Sn4+/Sn2+; 58.Переход окисленной формы в восстановленную и наоборот кроме обмена электронами сопровождается участием в этом процессе других частиц для следующих редокс-систем: Cl2/2Cl- ; BrO-/Br-; ClO3-/Cl-; Cu2+/Cu+. 59.Металлическая пластинка в редокс-электроде заряжается положительно в случае: избыточного содержания в растворе восстановленной формы; избыточного содержания в растворе окисленной формы; одинакового содержания в растворе восстановленной и окисленной форм; при содержании окисленной и восстановленной форм в растворе, равном 1моль/дм3. 60.Mеталлическая пластинка в редокс-электроде заряжается отрицательно в случае: избыточного содержания в растворе восстановленной формы; избыточного содержания в растворе окисленной формы; содержания в растворе восстановленной и окисленной форм; при содержании окисленной и восстановленной форм в растворе, равном 1моль/дм3. 61.Cтандартный или нормальный редокс-потенциал возникает в системе: при t=2980 C; при Т=298 К и активности окисленной и восстановленной форм равной 1моль/дм3 ; при Т=298 К и любой одинаковой активности окисленной и восстановленной форм в растворе; при t=2980 С и активности окисленной и восстановленной форм в растворе равной 1моль/дм3. 62. В уравнении Нернста-Петерса для расчета величины потенциала редокс-электрода |
