Сборник тестов по общей химии для студентов лечебнопрофилактического, педиатрического, медикопсихологического и медикодиагностического факультетов
 Скачать 201.82 Kb. Скачать 201.82 Kb.
|
|
. К2 . К3 . … . Кn; Ксумм = (К1+ К2)/К3; Ксумм = К1+К2/2+К3/3+… Кn/n. 182. Диссоциация СН3СООН в растворе подавляется при внесении в него: СН3СООNa; СН3СН2СООNa; HCl; NaOH. 183. Образующиеся при диссоциации электролита положительно заряженные частицы называются: протоны; катионы; анионы; нейтроны. 184. Образующиеся при диссоциации электролита отрицательно заряженные частицы называются: протоны; катионы; анионы; нейтроны. 185. При пропускании через раствор электролита электрического тока положительно заряженные ионы электролита двигаются: хаотически; к катоду; к аноду ; не двигаются. 186. Электролиты являются проводниками: первого рода; второго рода; третьего рода; четвертого рода. 187. Процесс электролитической диссоциации обратим: всегда; при повышенной температуре; только в кислой среде; только в щелочной среде. 188. Сильными электролитами являются: H2S; HCl; KOH; CH3COOH. 189. Слабыми электролитами являются: H2S; HCl; KOH; CH3COOH. 190. Вещества, в которых частицы связаны различными видами химической связи, распадаются на ионы: по всем связям одновременно; сначала по ковалентным полярным связям, потом по ионным; сначала по ионным связям, потом по ковалентным полярным ; не распадаются на ионы. 191. Степень диссоциации слабого электролита увеличивается при: повышении температуры; понижении температуры; уменьшении концентрации раствора; увеличении концентрации раствора. 192. Степень диссоциации слабого электролита уменьшается при: повышении температуры; понижении температуры; уменьшении концентрации раствора; увеличении концентрации раствора. 193. При ступенчатой диссоциации электролита константа диссоциации по каждой последующей ступени: увеличивается; уменьшается; не изменяется; изменяется различным образом у разных электролитов. 194. Закон разбавления Оствальда: Кдисс = (С . α2) / (1-α) ; Кдисс = (1-α) / (С . α2) ; Кдисс = (С . α) – 1; Кдисс = 1 – (С . α). 195. Активность – это: способность вещества к отдаче протонов; отношение числа распавшихся на ионы молекул электролита к общему числу его молекул растворе; эффективная концентрация ионов электролита, соответственно которой они количественно проявляют себя в растворах; произведение молярной концентрации иона на коэффициент активности. 196. В разбавленных растворах коэффициент активности иона зависит от: заряда иона; ионной силы раствора; вязкости среды; температуры кипения растворителя. 197. Ионная сила плазмы крови человека равна: 0,15; 1,5; 15; 150. 198. Самым слабым из перечисленных электролитов является: СН3СООН (Кдисс = 1,85 . 10 -5) ; HCN (Кдисс = 4,8 . 10-10) ; НСООН (Кдисс = 1,8 . 10-4) ; H2S (Кдисс = 6 . 10-8). 199. Самым сильным из перечисленных электролитов является: СН3СООН (Кдисс = 1,85 . 10 -5) ; HCN (Кдисс = 4,8 . 10-10) ; НСООН (Кдисс = 1,8 . 10-4) ; H2S (К1дисс = 6 . 10-8). 200. При пропускании через раствор электролита электрического тока отрицательно заряженные ионы электролита двигаются: хаотически; к катоду; к аноду ; не двигаются. Комплексные соединения. 1. В роли комплексообразователя могут выступать: атом Н; ион Н–; атом Fe; ион Fe2+. 2. При образовании координационной связи комплексообразователь выступает в роли: донора электронной пары; акцептора электронной пары; носителя отрицательного заряда; источника неспаренных электронов. 3. При образовании координационной связи лиганд всегда выступает в роли: донора электронной пары; акцептора электронной пары; носителя отрицательного заряда; источника неспаренных электронов. 4. Дентантность лигандов – это: число двухэлектронных σ-связей, образованных ими с комплексообразователем; численное значение величины их заряда; общее число атомов химических элементов, входящих в их состав; число атомов, выделяемых ими для образования координационных связей с комплексообразователем. 5. Монодентантными лигандами являются молекулы: этилендиамина; этилендиаминтетрауксусной кислоты; глицина; аммиака. 6. Бидентантными лигандами являются: гидроксильные ионы; цианид-ионы; оксалат-ионы; сульфат-ионы. 7. Координационное число равно: количеству вакантных орбиталей, расположенных на внешнем электронном слое комплексообразователя; общему числу двухэлектронных связей, которые лиганды образуют с комплексообразователем; числу лигандов во внутренней сфере комплекса; произведению числа лигандов, связанных с комплексообразователем, на их дентантность. 8. Координационное число в комплексных соединениях: может принимать любое целочисленное значение; варьирует в пределах от 1 до 12; не может быть больше числа лигандов во внутренней сфере; может быть больше числа лигандов во внутренней сфере. 9. Во внешней сфере комплексного соединения могут присутствовать: нейтральные молекулы; положительно заряженные ионы; отрицательно заряженные ионы; только положительно заряженные ионы. 10. Заряд внешней координационной сферы: имеет тот же знак, что и заряд комплексного иона; совпадает с зарядом внутренней сферы как по знаку, так и по абсолютной величине; совпадает с зарядом внутренней сферы по абсолютной величине, но противоположен по знаку; всегда равен нулю. 11. Заряд внутренней координационной сферы: всегда равен нулю; может быть равен нулю; равен алгебраической сумме заряда комплексообразователя и лигандов; по абсолютной величине всегда больше заряда внешней сферы. 12. Ионы внешней сферы: непосредственно связаны с комплексообразователем; непосредственно не связаны с комплексообразователем; образуют с комплексообразователем координационные связи; связаны с внутренней сферой за счет электростатического взаимодействия. 13. Катионными комплексами являются: Na[Al(OH)4]; K3[Fe(CN)6]; [Co(NH3)6]Cl3; [Co(NH3)3(NO2)2]. 14. Анионными комплексами являются: Na3[Al(OH)6]; [Ag(NH3)2]Cl; K4[Fe(CN)6]; Na2[Cu(OH)4]. 15. Нейтральными комплексами являются: [Fe(H2O)6]Cl3; [Fe(CO)5]; [Fe(NH3)4Cl2]Cl; Na2[Zn(OH)4]. 16. Аквакомплексами являются: [Co(H2O)6]SO4; Na2[Zn(OH)4]; Na[AlH4]; NaAlO2. 17. Гидроксокомплексами являются: Li[BH4]; Na3[Al(OH)6]; [Cu(H2O)4]Cl2; [Ag(NH3)2]Cl. 18. Ацидокомплексами являются: K4[Fe(CN)6]; [Cu(NH3)4]Cl2; Na3[Fe(C2O4)3]; K3[Co(NO2)6]. 19. Аммиакатами являются комплексы: Na3[Co(NO2)6]; K[Ag(CN)2]; [Cu(NH3)4]Cl2; Na2[Cu(OH)4]. 20. Смешанными комплексами являются: Na[Co(NH3)4Cl2]; Na[Al(OH)4(H2O)2]; [Ag(NH3)2]Cl; Na3[Fe(CN)6]. 21. Комплексное соединение Na3[Al(OH)6] является: одноядерным; анионным; гидроксокомплексом; катионным. 22. Комплексное соединение [Cu(NH3)4]SO4 является: многоядерным; аммиакатом; катионным; нейтральным. 23. Комплексное соединение [Fe(CO)5] является: одноядерным; нейтральным; катионным; анионным. 24. Комплексное соединение Na[Al(H2O)2(OH)4] является: многоядерным; комплексом смешанного типа; ацидокомплексом; анионным. 25. Комплексное соединение [Fe(H2O)6]SO4 является: одноядерным; гидроксокомплексом; аквакомплексом; катионным. 26. Укажите правильное название комплексного соединения [Ag(NH3)2]Cl : диаминоаргентата (I) хлорид; хлорид диаммиакат серебра (I); хлорид диамминсеребра (I); хлородиамминоаргентат (I). 27. Укажите правильное название комплексного соединения K4[Fe(CN)6] : тетракалийгексацианид железа (II); гексацианоферрат (II) калия; гексацианидожелеза (II) калий; гексацианидоферрат (II) калия. 28. Укажите правильное название комплексного соединения Na[Cr(H2O)3F2] : триаквадифторохромат(III) натрия; дифторотриаквахромат (III) натрия; дифторотригидроксохромат (III) натрия; тригидроксодифторонатрийхромат (III). 29. Укажите правильное название комплексного соединения [Co(NH3)3Cl3] : трихлоротриамминкобальт; триамминотрихлорокобальтат; трихлоротриаммиакат кобальта; трихлоридтриамминокобальт. 30. Укажите правильное название комплексного соединения [Al(H2O)5OH]SO4 гидридопентааквасульфат алюминия; сульфат пентааквагидридоалюмината; сульфат гидроксопентаакваалюминия; пентааквагидроксоалюмината сульфат. 31. Заряд комплексообразователя в соединении [ Pt(NH3)3NO2 ] Br равен: а) +2; б) +3; в) +4; г) +6. 32. Заряд комплексообразователя в соединении [ Cr(Н2О)4Cl2 ] Cl 2Н2О равен: а) +2; б) +3; в) +4; г) +6. 33. Заряд комплексообразователя в соединении [Co(NH3)3(NO2)3] равен: а) +2; б) +3; в) +4; г) +5. 34. Константа нестойкости комплексного иона [Ag (СN)2 ]- определяется по формуле: а) 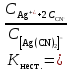 б) Кнест.= 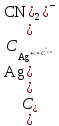 в) 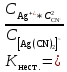 г) Кнест.= 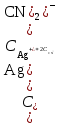 35. Константа устойчивости комплексного иона [Ag (СN)2 ]- определяется по формуле: а) 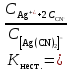 ; ;б) Кнест.= 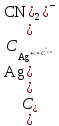 ; ;в) 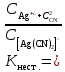 ; ;г) Кнест.= 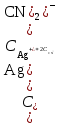 . .36. Константа нестойкости комплексного иона [Cu(OH)4]2- определяется по формуле: а) Кнест.= К1+К2+К3+К4; б) Кнест.= 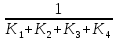 ; ;в) Кнест.= 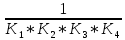 ; ;г) Кнест.= К1·К2·К3·К4. где К1,К2,К3,К4- константы нестойкости для каждой из стадии диссоциации комплексного иона. 37. При диссоциации комплексного иона: а) каждая последующая стадия протекает хуже предыдущей; б) каждая из его стадий протекает обратимо; в) каждая последующая стадия протекает лучше предыдущей; г) каждая из его стадий протекает необратимо. 38. Чем меньше величина константы устойчивости тем: а) лучше диссоциирует комплексный ион; б) хуже диссоциирует комплексный ион; в) диссоциация комплексного иона не зависит от величины константы устойчивости; г) менее устойчивым является комплексный ион. 39. Комплексные соединения хелатного типа образованы: а) монодентантными лигандами; б) полидентантными лигандами; в) только нейтральными лигандами независимо от их дентантности; г) только отрицательно заряженными полидентантными лигандами. 40. Какие из перечисленных комплексов относятся к соединениям хелатного типа: а) аммиакаты; б) аквакомлексы; в) гемоглобин; г) хлорофилл. 41. Определите координационное число комплексообразователя в следующем соединении Na2[Cu(С2О4)2]: а) 2; б) 3; в) 4; г) 6. 42. Определите координационное число комплексообразователя в следующем соединении Na[Cо(NH3)2(SCN)2(C2O4)]: а) 3; б) 4; в) 5; г) 6. 43. Определите координационное число комплексообразователя в соединении [Co(En)3]Cl3, где En:NH2–СН2 –СН2 – NH2 : а) 2; б) 3; в) 4; г) 6. 44. Линейную пространственную конфигурацию имеет ион: а) [Cu(OH)4]2-; б) [Au(CN)2]-; в) [PtCl6]4-; г) [Al(OH)6]3–. 45. Октаэдрическую пространственную конфигурацию имеет ион: а) [Cu (NH3)4 ]2+; б) [Pt F6]2-; в) [Ag(NH3)2]+; г) [Zn(OH)4]2-. 46. Тетраэдрическую пространственную конфигурацию имеет ион: а) [Cu (NH3)2 ]+; б) [Со F6]3-; в) [Zn (NH3)4 ]2+; г) [Cо(С2О4)3]3-. 47. Определите тип изомерии в следующей паре комплексных соединений [Pt(NH3)3 Br] NO2 и [Pt(NH3)3 NO2] Br : а) координационная изомерия; б) геометрическая изомерия; в) оптическая изомерия; г) ионизационная изомерия. 48. Определите тип изомерии в следующей паре комплексных соединений [Co(NH3)6] [Cr(C2O4)3] и [Cr (NH3)6] [Co (C2O4)3] : а) координационная изомерия; б) геометрическая изомерия; в) оптическая изомерия; г) ионизационная изомерия. 49. К нейтральным лигандам относятся: а) Еn; б) СО; в) С2О4; г) NН3. 50. К анионным лигандам относятся: а) NO; б) NO3; в) СN; г) Н2О. |
