Биохимия слюны. Слюна. Слюна ее значение и роль в развитии заболеваний полости рта
 Скачать 5.73 Mb. Скачать 5.73 Mb.
|
|
Часть воды и ионов поступают в состав первичной слюны по околоклеточному пространству. Образовавшаяся первичная слюна изотонична плазме крови и близка к ней по составу электролитов (рис. 9). Биосинтез белкового секрета В ацинарных клетках и клетках выводных протоков слюнных желёз осуществляется биосинтез белкового секрета. Аминокислоты поступают в клетку при помощи натрийзависимых мембранных транспортеров. Синтез секреторных белков происходит на рибосомах. Рибосомы, связанные с эндоплазматической сетью (ретикулум), синтезируют белки, которые затем гликозируются. Перенос олигосахаридов на растущую полипептидную цепь происходит на внутренней стороне мембраны эндоплазматической сети. Переносчиками липидов служит долихолфосфат – липид, содержащий около 20 изопреновых остатков. К долихолфосфатам присоединяется олигосахаридный блок, состоящий из 2 остатков N-ацетилглюкозамина, 9 остатков маннозы и 3 остатков глюкозы. Его образование идет путем последовательного присоединения углеводов из УДФ - и ГДФ - производных. В переносе участвуют специфические гликозилтрансферазы. Затем углеводный компонент целиком переносится на определенный остаток аспарагина растущей полипептидной цепи. При переносе олигосахарида на белок высвобождается долихолдифосфат, который под действием фосфатазы превращается в долихолфосфат. Синтезируемый начальный продукт накапливается в щелях и лакунах эндоплазматической сети, откуда перемещается в комплекс Гольджи, где заканчивается созревание секрета и упаковка гликопротеинов в везикулы (рис. 10). 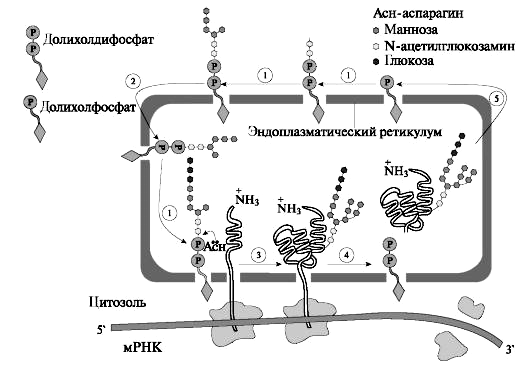 Рис. 10. Биосинтез гликопротеинов слюнных желёз. 1 - образование олигосахаридного ядра в молекуле долихолфосфата с участием гликозилтрансфераз; 2 - перемещение долихолфосфата, содержащего олигосахарид, во внутреннюю полость эндоплазматического ретикулума; 3 - перенос олигосахаридного ядра на остаток аспарагина растущей полипептидной цепи; 4 - освобождение долихолдифосфата; 5 - рециклизация долихолфосфата. В перемещении и выведении секрета из клетки принимают участие фибриллярные белки и белок синексин. Образовавшаяся секреторная гранула соприкасается с плазматической мембраной и образуется плотный контакт. Далее на плазмолемме возникают межмембранные глобулы и формируются «гибридные» мембраны. В мембране образуются отверстия, через которые содержимое секреторных гранул переходит во внеклеточное пространство ацинуса. Материал мембран секреторных гранул затем используется для построения мембран органелл клетки. В аппарате Гольджи мукоцитов поднижнечелюстной и подъязычной слюнных желёз синтезируются гликопротеины, содержащие большое количество сиаловых кислот, аминосахаров, которые способны связывать воду с образованием слизи. Для этих клеток характерны менее выраженная плазматическая сеть и выраженный аппарат Гольджи. Синтезируемые гликопротеины оформляются в секреторные гранулы, которые выделяются в просвет выводных протоков. Формирование слюны в выводных протоках Протоковые клетки синтезируют и содержат биологически активные вещества, которые выводятся в апикальном и базолатеральном направлениях. Клетки протоков образуют стенки выводящих каналов и регулируют водный и минеральный состав слюны. Из просвета выводных протоков, где проходит изотоничная слюна, происходит реабсорбция в клетке ионов Na+ и Cl-. В клетках исчерченных протоков, где имеется большое количество митохондрий, образуется множество молекул СО2 и Н2О. При участии карбоангидразы угольная кислота диссоциирует на Н+ и НСО3-. Затем ионы H+ выводятся в обмен на ионы Na+, а НСО3- на Cl-. На базолатеральной мембране локализуются транспортные белки Na+/K+АТФ-аза и Cl- - канал, через которые ионы Na+ и Cl- поступают из клетки в кровь (рис. 11). 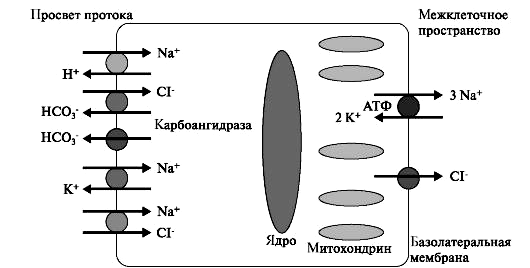 Рис. 11. Формирование слюны в исчерченных клетках выводных протоков слюнных желёз. Процесс реабсорбции регулируется альдостероном. Ток воды в выводных протоках обеспечивается белками-аквапоринами. В результате формируется гипотоничная слюна, в которой содержится большое количество ионов НСО3-, К+ и мало Na+ и Cl-. В ходе секреции из клеток выводных протоков кроме ионов секретируются различные белки, синтезируемые также в этих клетках. Поступившие секреты из малых и больших слюнных желёз смешиваются с клеточными элементами (лейкоциты, микроорганизмы, слущенный эпителий), остатками пищи, метаболитами микроорганизмов, что приводит к формированию смешанной слюны. 5. Функции смешанной слюны 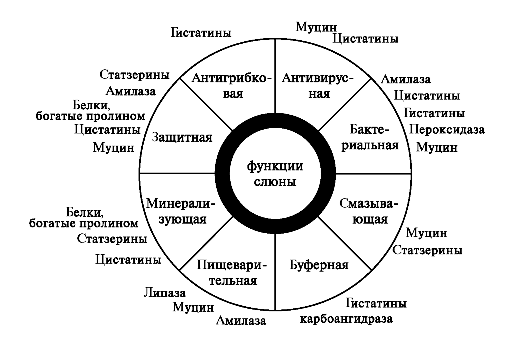 Рис. 12. Функции слюны. 1. Пищеварительная функция слюны. Смачивая и размягчая твердую пищу, слюна облегчает проглатывание пищи. При жевании пища смешивается со слюной, которая составляет 10 – 20 % от количества пищи. В формировании пищевого комка участвуют слюнные муцины, а в расщеплении гомополисахаридов — секреторный фермент α-амилаза. α-Амилаза общей слюны синтезируется главным образом в околоушных слюнных железах. α -Амилаза развивает свою активность в широком диапазоне рН 3.8-9.4 с оптимальным действием при нейтральных значениях рН. На активность энзима оказывают стабилизирующее действие ионы Са2+, ионы СL-, бромидов и нитратов — активирующее. -Амилаза слюны начинает расщепление крахмала или гликогена в ротовой полости, но ее воздействие быстро инактивируется в кислой среде желудочного сока (при 5 значении рН<3,5). Дальнейшее расщепление крахмала или гликогена происходит благодаря α -амилазе секрета поджелудочной железы и заканчивается с помощью мальтазы и изомальтазы секрета тонкого кишечника. По своим иммунохимическим свойствам и аминокислотному составу слюнная α -амилаза очень сходна с панкреатической амилазой. 2. Коммуникативная функция слюны. Слюна – необходимый компонент формирования правильной речи и общения людей. В процессе разговора, приема пищи при постоянном потоке воздуха влажность в полости рта сохраняется. Это обеспечивают муцин и другие слюнные гликопротеины. Муцинсинтезируется в поднижнечелюстных, подъязычных и малых слюнных железах. Существует целое семейство муцинов. В слюне присутствуют высокомолекулярный и низкомолекулярный муцин. В полипептидной цепи муцина содержится большое количество серина и треонина, а всего их насчитывается около 200 на одну полипептидную цепь. Третьей, наиболее часто встречающейся аминокислотой в муцине является пролин. К остаткам серина и треонина через О-гликозидную связь присоединены остатки N-ацетилнейраминовой кислоты, N-ацетилгалактозамина, фруктозы и галактозы. Сам белок по своему строению напоминает гребенку: короткие углеводные цепи, как зубья, торчат из жесткой, богатой пролином полипептидной основы (Вавилова Т.П. с соавт., 2016). Такое строение позволяет молекуле муцина связывать большее количество воды, обеспечивая вязкость слюны. Муцин, покрывая эпителий полости рта, защищает его от повреждающего действия бактерий и дегидратации. 3. Защитная функция слюны обеспечивается четырьмя механизмами: 1) очищение зубов и слизистой оболочки полости рта от продуктов метаболизма бактерий и остатков пищи; 2) антимикробное и антивирусное действие; 3) формирование защитного слоя (пелликулы) на поверхности органов и тканей полости рта; 4) поддержание кислотно-основного равновесия. Сегодня в слюне человека обнаружено несколько семейств эндогенных антимикробных пептидов (АМП) – дефензины, кателицидины, гистатиныи др. АМП представляют собой небольшие молекулы, построенные из нескольких десятков аминокислот. небольшие размеры позволяют им действовать, нарушая структуры или функции клеточной мембраны микроорганизмов (Вавилова Т.П. с соавт., 2016). Гистатины – это белки, богатые гистидином. Семейство гистатинов представлено 12 пептидами с различной функцией. Все они участвуют в образовании приобретенной пелликулы зуба, а гистатин-5 является мощным ингибитором роста кристаллов гидроксиапатитов (ГАП) в слюне (рис. 13).  Рис.13. Строение гидроксиапатита. Дефензины – α и β-дефензины – это низкомолекулярные пептиды, богатые цистеином. Источником α-дефензинов являются лейкоциты, a β-дефензинов – кератиноциты и слюнные железы. Они формируют ионные каналы в мембране бактериальной клетки, агрегируют с пептидами мембран и тем самым обеспечивают перенос ионов в клетку, нарушая ее осмос. Кроме того, дефензины подавляют синтез бактериальных белков. Кателицидины – это катионные пептиды разнообразной структуры: линейной, α-спиральной или β-шпилькообразной. Они, освобождаясь из гранул нейтрофилов, способны связываться с липополисахаридами бактериальных мембран или формировать ионные каналы. Кальпротектин – низкомолекулярный связывающий кальций белок S100 (36 кДа). Кальпротектин высвобождается из нейтрофилов и макрофагов во время их активации (или гибели) и вовлекается в активный воспалительный процесс. Кальпротектин в нейтрофилах отвечает за первичную иммунную реакцию лейкоцитов, а также имеет противомикробные, фунгицидные и антипролиферативные свойства. Лактоферрин – это гликопротеин, который существует в виде различных полимерных форм – от мономера до тетрамера. Это определяет его функциональные свойства. Каждая молекула белка может обратимо связывать два иона трехвалентного железа или ионы цинка, меди и других металлов. Лактоферрин относится к системе врожденного иммунитета. Главные биологические функции белка – это связывание и транспорт ионов железа. Кроме этого лактоферрин обладает антибактериальными, антивирусными, антипаразитарными, каталитическими свойствами, а также антиканцерогенными, антиаллергическими, иммуномодулирующими и радиопротекторными. Иммуноглобулины. Основным иммуноглобулином полости рта (90%) является секреторный иммуноглобулин A (slgA, IgA), который выделяется околоушными слюнными железами (рис. 14).  Рис.14.. Строение sIgA. Остальные 10% IgA, секретируются малыми и поднижнечелюстными слюнными железами. Все другие виды иммуноглобулинов (IgE, IgG, IgM) определяются в меньшем количестве (рис. 15). 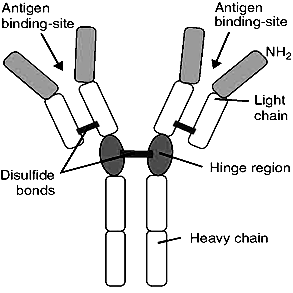 Рис. 15. Строение Ig (схема). В слюну они поступают из плазмы крови через малые слюнные железы и десневую борозду (sulcus gingivalis). Соотношение иммуноглобулинов в полости рта иное, чем в сыворотке крови. Секреторный IgA обладает выраженными бактерицидными, антивирусными и антитоксическими свойствами, активирует комплемент, стимулирует фагоцитоз, играет решающую роль в реализации резистентности к инфекции. Один из важных механизмов антибактериальной защиты полости рта состоит в предотвращении с помощью IgA адгезии бактерий к поверхности клеток и слизистой оболочки, и эмали зубов. Обоснованием данного предположения служит то, что в эксперименте добавление антисыворотки к S. mutans в среде с сахарозой препятствовало их фиксации на гладкой поверхности. Методом иммунофлюоресценции на поверхности бактерий при этом был выявлен IgA. Следовательно, ингибирование фиксации бактерий на гладкой поверхности зуба и слизистой оболочке полости рта может бить важной функцией секреторного IgA, предупреждающего развитие кариеса зубов. Таким образом, секреторный IgA защищает внутреннюю среду организма от различных агентов, попадающих на слизистую оболочку. Гликопротеин-340 (gp340, ГП-340) – это белок, богатый цистеином с молекулярной массой 340 кДа. В присутствии ионов кальция ГП-340 связывается с аденовирусами и вирусами, вызывающими гепатит, ВИЧ-инфекцию. ГП-340 взаимодействует с бактериями полости рта (Srr. mutans. Helicobacter pylori и др.). При образовании колоний ГП-340 подавляет их сцепление. Белок ингибирует активность эластазы лейкоцитов и защищает белки слюны от протеолиза. Лизоцимсинтезируется эпителиальными клетками протоков слюнных желез. Нейтрофилы также являются источниками лизоцима. Бактерицидное действие лизоцима основано на том, что он катализирует гидролиз α (1-4) - гликозидной связи, соединяющей молекулу N-ацетилглюкозамина с N-ацетилмурамовой кислотой в полисахаридах клеточной оболочки микроорганизмов. Это способствует разрушению муреина – пептидогликана, содержащегося в стенке бактерии. 4. Кислотно-основное равновесие в полости рта определяется скоростью слюноотделения, совместным действием буферных систем слюны, метаболитами микроорганизмов, количеством зубов и особенностями их расположения в зубной дуге. Значение рН смешанной слюны в норме колеблется от 6,5 до 7,4 ед. В поддержании рН участвуют три буферные системы: бикарбонатная, фосфатная и белковая. Эти буферные системы вместе формируют первую линию защиты от кислотных или щелочных воздействий на ткани полости рта. Они имеют различные пределы буферной емкости. Фосфатная система наиболее активна при рН 6,8–7,0 ед., карбонатная – при рН 6,1—6,3 ед. Белковая система обеспечивает буферную емкость при различных значениях рН. Благодаря буферным системам у практически здоровых людей уровень рН смешанной слюны восстанавливается после еды в течение нескольких минут до исходного значения. При несостоятельности буферных систем рН смешанной слюны понижается. Это сопровождается увеличением скорости деминерализации эмали и инициирует развитие кариозных и некариозных поражений твердых тканей зубов. На рН слюны в большой степени влияет характер пищи: при приеме кислого сока, кофе с сахаром, йогурта рН снижается до 3,8–5,5, в то же время, употребление пива, кофе без сахара практически не вызывает сдвигов в рН слюны (Вавилова Т.П. с соавт., 2016). 5. Минерализующая функция слюны. Слюна – основной источник ионов кальция и фосфора для эмали зубов. После прорезывания зуба механизм минерализации протекает через механизмы: 1) регуляции рН; 2) препятствия в разрушении кристаллов гидроксиапатита эмали зуба; 3) включения ионов в минерализованные ткани. В эмаль зуба ионы поступают через приобретенную пелликулу, в образовании которой участвуют белки слюны (статзерины, белки, богатые пролином, цистатины, гистатины и др.). Статзерины (Statherins, белки, богатые тирозином) в пелликуле зуба связываются своей N-концевой областью с гидроксиапатитами эмали. Эти фосфогликопротеины содержат до 15% пролина и 25% кислых аминокислот. Статзерины, связывая кальций, ингибируют его осаждение и образование гидроксиапатитов в слюне. Совместно с гистатинами они ингибируют рост и аэробных, и анаэробных бактерий. Белки, богатые пролином (ББП), составляют до 70% общего количества всех белков секрета околоушных слюнных желёз. В структуре ББП от общего числа аминокислот 75% приходится на пролин, глицин, глутаминовую и аспарагиновую кислоты. ББП по свойствам делятся на 3 группы: кислые, основные и гликозилированные. Кислые ББП задерживают деминерализацию эмали зуба и ингибируют излишнее осаждение минералов, т.е. поддерживают постоянное количество кальция и фосфора в эмали зуба. Кислые и гликозилированные ББП способны связывать определенные микроорганизмы и таким образом участвуют в образовании микробных колоний в зубном налете. Основные ББП связывают танины пищи и тем самым защищают слизистую оболочку полости рта от их повреждающего действия, придают вязко-эластические свойства слюне (Вавилова Т.П. с соавт., 2016). Как сказано выше, интенсивность растворимости гидроксиапатита эмали в смешанной слюне значительно увеличивается при снижении pH: при pH ротовой жидкости 6,8 она пересыщена кальцием, при pH 6,0 смешанная слюна становится кальцийдефицитной (Леонтьев В.К., 2006). Физико-химическое постоянство эмали полностью зависит от состава и химического состояния окружающей смешанной слюны. Главными факторами стабильности апатитов эмали в слюне являются pH и концентрация кальция, фосфата и фтористых соединений в растворе. Строение эмали Неорганические вещества эмали составляют 98,7% от сухой массы эмали, а на долю органических веществ приходится лишь 1,3%. Неорганическая часть эмали представлена апатитами и неапатитными формами (менее 2% - Са3(PO4)2, CaCO3, MgCO3 и др.). Состав апатитов может быть представлен формульной единицей А5(ВО4)3Х, где А – это Са2+, Cr2+, Ba2+, Cd2+, К+, Na+; B – P, As, Si, С и X – F, OH, Cl, CO3. Необходимо отметить отличительную особенность карбонатных замещений в апатитах, их локализацию в двух анионных позициях (А-тип в позиции Х, В-тип в позиции ВО4). К основным апатитам эмали относятся гидроксиапатит (75%), карбонапатит (19%), хлорапатит (4,4%) и фторапатит (0,66%). Простейший состав гидроксиапатита выражается формулой Са5(РО4)3(OH). В состав элементарной ячейки кристалла гидроксиапатита входят две формульные единицы Са10(РО4)6(OH)2. Основным структурным элементом апатитов являются фосфатные тетраэдры PO4, формирующие жесткий каркас. Ионы кальция занимают в структуре апатитов две кристаллографически разные позиции. Каждый из ионов Сa12+ связан с 9 атомами кислорода тетраэдров, ионы Са22+ связывают ионы кислорода PO4-групп с анионом (F, OH, Cl) осевого канала. Таким образом, уточненная формула структуры апатитов кальция может быть представлена как (Са1)4(Са2)6(РО4)6(OH)2. В структуре гидроксиапатита молярное соотношение кальция и фосфора составляет 10/6=1,67. Значение кальций/фосфорного коэффициента может колебаться в пределах от 1,33 до 2,0, и это обусловлено двумя причинами: 1) Теоретическое отношение кальция к фосфору соответствует составу одной элементарной ячейки или монокристалла бесконечно больших размеров, а реальные кристаллы очень малы и их состав определяется составом ограняющих его плоскостей. 2) Модификации апатита. Например, в результате изоморфных замещений ионы кальция могут замещаться на ионы бария, магния, хрома, гидроксония (H3O+) или ионы других элементов с близкими свойствами, что приводит к уменьшению коэффициента Са/Р: Са10(РО4)6(OH)2 + F- →Са10(РО4)6F(OH) + OH-– Са10(РО4)6F(OH) + F- →Са10(РО4)6F2 + 2OH- Воздействие высоких концентраций фтора, особенно в кислой среде приводит к разрушению апатита с образованием практически нерастворимого фторида кальция: Са10(РО4)6F2 + 18F-→10СаF2 + 6РО43-– Процентные соотношения компонентов эмали могут отличаться, это связано с тем, что в системе эмаль–слюна протекают гетерогенные равновесия: Са10(РО4)6(ОН)2 ↔10Са2+ + 6РО43-+ 2ОН-– При закислении околозубной среды образовавшиеся при диссоциации гидроксиапатита ионы OH будут взаимодействовать с ионами Н+ с образованием H2O и таким образом химическое равновесие указанной выше реакции будет смещаться вправо (деминерализация). При условии, что околозубная среда будет пересыщена ионами Са2+, РО43-, ОН- равновесие реакции будет смещаться влево (минерализация). Каждый кристалл апатита покрыт гидратной оболочкой толщиной 1 нм. Любое проникновение веществ в кристалл возможно только с преодолением данной оболочки и протекает в 3 стадии: 1) Ионный обмен между гидратной оболочкой и окружением кристалла протекает за несколько минут, в его основе лежит процесс диффузии. В результате в гидратной оболочке накапливаются ионы, способные нейтрализовать заряд апатита (Са2+, Sr2+, PO43-, CO32- и др.). 2) Ионный обмен между гидратной оболочкой и поверхностью кристалла протекает за часы. Некоторые ионы перемещаются с поверхности апатита в гидратный слой, а на их место встраиваются другие ионы из гидратного слоя (чаще ионы Са2+, Sr2+, Na+, PO43-, F-, CO32-), что приводит к нейтрализации заряда кристалла. 3) Внутрикристаллический обмен длится дни и месяцы. Внедрение ионов в глубь кристалла возможно лишь для ионов Са2+, Sr2+, PO43-, F-. Принято выделять 4 порядка структуры апатитов: 1 – ячейка гидроксиапатита (относительная формульная масса около 1000). 2 – кристалл гидроксиапатита, состоящий приблизительно из 2500 ячеек (относительная формульная масса около 1000×2500=2500000). 3 – эмалевая призма, начинающаяся у эмалево-дентинной границы, идущая к поверхности эмали, состоит из тысяч и миллионов кристаллов. 4 – пучок эмалевых призм. Содержание химических элементов варьирует и в пределах слоев эмали. Так, в поверхностном слое (по сравнению с подповерхностным) содержится больше кальция, фосфора и фтора, что и обуславливает его высокую твердость. Такое распределение имеет химическое обоснование. Например, попадающие на поверхность зуба ионы фтора имеют высокую активность и быстро взаимодействуют с ионами кальция, не успевая проникнуть в более глубокие слои эмали. В подповерхностном слое, напротив, увеличивается относительное содержание магния, натрия и карбонат-ионов. Ионы стронция, меди, алюминия и калия равномерно распределены по всей толще эмали. Проницаемость эмали является одним из ее важнейших свойств, отражает уровень в ней физико-химических процессов и способствует поддержанию ее гомеостаза. Проницаемость эмали обеспечивается благодаря наличию в ней микропространств, заполненных водой, по которым способны проникать вещества в зависимости от их радиуса. Некоторые органические вещества (например, лизин) поступают в эмаль в основном по ламеллам. Одним из основных механизмов, обеспечивающих перемещение ионов в водной фазе эмали, принято считать осмотическое давление. Оно возникает из-за значительной разности концентраций ряда ионов на поверхности эмали и в эмалевой жидкости. Проницаемость эмали необходимо рассматривать в двух направлениях: ротовая жидкость → эмаль и пульпа → дентин → эмаль. Большинство исследователей сходятся на том, что основным источником для поступления веществ в эмаль является ротовая жидкость. Так, благодаря ее пересыщенности по отношению к ионам, входящим в состав основных компонентов эмали (Сa2+, HPO42- и F-), преимущественно обеспечивается трофика эмали. В прошлом столетии была изучена проницаемость эмали для большого количества ионов (калия, кальция, фтора, стронция, фосфат-ионов и т.д.) и ряда органических веществ (аминокислот и углеводов). На проницаемость эмали оказывают влияние следующие факторы: 1. Постэруптивный период. Уровень проницаемости снижается с увеличением возраста, что связано с поступлением минеральных компонентов из слюны и отложением их в эмали в процессе ее созревания. 2. Деминерализация эмали. Проницаемость увеличивается пропорционально степени деминерализации эмали. 3. Кислотность среды. При уменьшении рН наблюдается увеличение проницаемости эмали. Происходящий в зубном налете процесс гликолиза обеспечивает закисление среды и таким образом повышает проницаемость эмали. 4. Ротовая жидкость. В присутствии ротовой жидкости происходит уменьшение проницаемости эмали, что обусловлено наличием в ней муцина. 5. Свойства проникающего вещества. Проницаемость эмали для вещества определяется его биологической активностью, способностью связываться с элементами эмали, путем проникновения. Коэффициент активности ионов Cl-, F-, OH-, K+, NO3- равен 0,72, для Ca2+ - 0,36, Ba2+ - 0,33, PO43- – 0,06 (W. Newman & M. Newman, 1961). Из органических веществ наибольшая проницаемость свойственна лизину, меньшая –глицину и наименьшая – глюкозе. Проницаемость эмали для неорганических и органических веществ отличается и не зависит от размера молекулы (Леус П.А., 1977). 6. Структура и состав эмали. Зубы человека менее проницаемы, чем зубы животных. Проницаемость зубов человека снижается в следующем ряду: непрорезавшиеся → постоянные с незрелой эмалью → молочные → постоянные после завершения минерализации эмали. 7. Групповая принадлежность, поверхность, участок зуба. Проницаемость минимальна у резцов, максимальна у моляров, язычная поверхность более проницаема, чем вестибулярная, пришеечная область вестибулярной поверхности более проницаема. 8. Ферменты. Гиалуронидаза обладает способностью увеличивать проницаемость эмали, а щелочная фосфатаза–снижать ее. В качестве источников ферментов могут выступать как слюна, так и микроорганизмы. 9. Физические факторы. Воздействие электрического тока и ультразвука значительно увеличивает проницаемость эмали. Деминерализация – это потеря части минеральных компонентов. Поскольку смешанная слюна сильно пересыщена ионами Ca2+ и PO43-, то естественные колебания их концентраций оказывают слабое влияние на скорость де- и реминерализации. Таким образом, решающее влияние на растворение и кристаллизацию апатита оказывает концентрация гидроксильных ионов. Установлено, что при снижении рН до уровня 5,5 и ниже скорость деминерализации гидроксиапатита значительно превышает скорость реминерализации. Основным источником кислот являются микроорганизмы биопленки. Эмаль принято рассматривать как своего рода буферной системой по отношению к кислотам, действующим на ее поверхности. Вытесняя Са2+, ионы Н+/H3O+ связываются с гидроксиапатитом. При этом структура гидроксиапатита сохраняется, но уменьшается его способность противодействовать кислоте из-за снижения избытка Са. Падение молярного кальций-фосфорного соотношения ниже 1,30 указывает на разрушение кристаллической решетки гидроксиапатита, исчерпание резерва кальция и неспособность эмали далее противостоять растворению. Таким образом, величина Са/Р коэффициента является показателем резистентности эмали к действию кислоты. Степень деминерализации эмали связана с размером кариозного пятна по принципу: чем больше размер пятна, тем более выражена потеря кальция и фосфора. Деминерализация во всех слоях эмали прогрессирует в следующей последовательности: светло-коричневое → коричневое → черное кариозное пятно. Деминерализация при кариесе уменьшается в направлении от поверхности эмали к эмалево-дентинному соединению. Реминерализация – это восстановление минеральных компонентов эмали зуба за счет компонентов слюны или реминерализирующих растворов. Теоретическим обоснованием реминерализации в профилактике и терапии кариеса является доказательство преобладания деминерализации эмали с сохранением в ней белковой матрицы на ранних стадиях кариеса и данные о возможности поступления различных веществ в эмаль. Фазы реминерализации эмали: 1) Доставка реминерализирующих средств, содержащих ионы, предназначенные для замещения дефектов в кристалле апатита. Для протекания данной фазы необходимо подготовить поверхность эмали, удалив твердые и мягкие зубные отложения. Считается целесообразной и обработка поверхности эмали растворами слабых кислот для растворения карбонатных групп апатитов и их последующего замещения на фосфатные группы. 2) Проникновение ионов, предназначенных для реминерализации, с поверхности эмали в гидратный слой кристаллов апатита. 3) Проникновение ионов из гидратного слоя на поверхность кристаллов апатита. Скорость второй и третьей фазы зависит от многих факторов: заряда, ионного радиуса, активности, химических свойств, концентрации ионов, состояния поверхности гидроксиапатита, ее заряда, наличия дефектов кристаллической решетки, концентрации ионов на поверхности. 4) Проникновение ионов с поверхности в глубину кристалла. Эта фаза является самой длительной и может осуществляться только за счет дефектов кристаллической решетки, изоионных или изоморфных замещений в кристаллической решетке гидроксиапатита. Дефект кристаллической решетки преимущественно замещается тем ионом, который ранее был на этом месте, или сходным по ионному радиусу и химическим свойствам по принципу компенсации заряда. Так, место иона кальция может быть занято Ca2+, Mg2+, Ba2+, H3O+, фосфат-иона, PO43-, CO32-, иона гидроксила – OH-, F-, Cl-. Установлено, что при концентрации фтора в питьевой воде 0,2–0,3 мг/л, критическое рН реминерализации составляет 5,5 (при более высоких значениях рН происходит – реминерализация, более низких деминерализация). Однако путем компенсации ионами фтора недостатка гидроксильных ионов можно обеспечить реминерализацию при рН 4,5–5,5. Зная химический состав и фазы реминерализации эмали, можно определить требования к адекватному реминерализирующему препарату. С возрастом уменьшается секреторная функция больших и малых слюнных желез. Происходит нарушение слюноотделения при острых и ряде хронических заболеваний. Так, одним из важных диагностических признаков ящура является избыточное выделение слюны (до 7–8 л в сутки). При гепатохолецистите отмечается гипосаливация, и больные жалуются на сухость в полости рта. Ксеростомия диагностируется при Синдроме/болезни Шегрена (Ронь Г.И., Григорьев С.С., 2011, 2016). При сахарном диабете увеличено содержание глюкозы в смешанной слюне (Еловикова Т.М., Трошунин А.В., Жукова Е.Е., Ожигихина Ж.Э., 2013 и др.). Защитные механизмы слюны против кариеса. В настоящее время установлено, что слюна оказывает выраженное противокариозное действие, что выражается в разведении и выведении сахаров пищевых продуктов, нейтрализации кислот в биопленке, обеспечении процесса реминерализации эмали зуба. Было установлено, что после поступления в полость рта твердой углеводистой пищи концентрация глюкозы в слюне снижается, причем вначале быстро, а затем медленно. Большое значение при этом играет скорость слюноотделения – усиление слюноотделения способствует выведению углеводов. Важно, что усиление слюноотделения не приводит к выведению фторидов, так как они связываются с поверхностями твердых и мягких тканей полости рта, высвобождаясь в течение нескольких часов. Считают, что основным механизмом противокариозного действия фторидов является поддержание баланса между де- и реминерализацией, повышения кислотоустойчивости гидроксиапатита. В результате ряда исследований установлено, что этот механизм реализуется даже при относительно низких концентрациях фторидов в слюне. Влияние слюны на ускорение выделения глюкозы является не единственным механизмом снижения поражаемости кариесом. Более выраженное противокариозное действие слюны состоит в нейтрализации органических кислот, что обеспечивается в основном гидрокарбонатом слюны (HCO3- + H+/H3O= xH2O + CO2/CO32-). Установлено, что в стимулированной слюне концентрация гидрокарбонатов значительно выше, чем в нестимулированной. Из этого следует, что усиление слюноотделения обеспечивает снижение pH биопленки (Григорьев С.С., 2011 и др.). Ряд белков слюны участвует в реминерализации. Молекулы статхерина, кислых гликопротеинов, белков, богатых пролином, цистеином, гистидином, а также ряд фосфопротеинов связывают кальций и стимулируют реминерализацию. 6. Регуляторная функция слюны. В слюне содержится ряд гормонов и биологически активных веществ. Часть этих соединений секретируется из плазмы крови, а другие белки поступают из слюнных желез. Из плазмы крови в слюну переносятся половые гормоны, глюкокортикоиды. Слюнные железы являются источником паротина, эритропоэтина, факторов роста. Паротин – гликопротеин, выделяемый околоушными и поднижнечелюстными слюнными железами. Белок состоит из α-, β- и γ-субъединиц. Активным началом паротина является γ-субъединица, влияющая на развитие минерализованных тканей. Паротин стимулирует синтез нуклеиновых кислот в бластных клетках развивающегося зубного зачатка, активирует поступление ионов Са2+ и Р043", необходимых для формирования кристаллов гидроксиапатита. В слюне определяется фактор роста нервов, фибробластов, эндотелия, эпидермальный фактор роста и многие другие. Белок лептин участвует в процессах регенерации слизистой оболочки полости рта. Связываясь с рецепторами кератиноцитов, он вызывает экспрессию факторов роста кератиноцитов и эпителия (Вавилова Т.П. с соавт., 2016). 6. Ферменты слюны В составе смешанной слюны определяется свыше 50 различных ферментов. Источниками ферментов в слюне выступают слюнные железы, микроорганизмы, лейкоциты и клетки эпителия. Их активность, за исключением α-амилазы и лизоцима, не очень велика. Оксидоредуктазы. В норме в смешанной слюне присутствуют слюнная пероксидаза (лактопероксидаза) и миелопероксидаза, а при патологических состояниях появляется глутатионпероксидаза. Лактопероксидаза – гемопротеин, образуется в ацинарных клетках околоушных и поднижнечелюстных слюнных желез. Фермент окисляет тиоцианаты (SCN-). Механизм окисления SCN- включает несколько реакций. Наибольшее окисление тиоцианатов слюнной пероксидазой протекает при рН 5,0–6,0 ед, поэтому антибактериальный эффект этого фермента увеличивается при низких (кислых) значениях рН. Образующийся гипотиоцианат (-OSCN) подавляет ростStr.mutatis и оказывает мощное антибактериальное действие (в 10 раз больше, чем Н2О2). Фермент миелопероксидаза поступает в смешанную слюну из полиморфно-ядерных лейкоцитов. Миелопероксидаза участвует в окислении ионов хлора, йода и брома. Результатом взаимодействия системы «пероксидаза–пероксид водорода–хлор» является образование гипохлорита (НОСI-). Объектом действия гипохлорита являются аминокислоты белков микроорганизмов, которые окисляются до активных альдегидов или других токсичных продуктов. Поэтому способность слюнных желез экскретировать в значительных количествах ионы тиоцианата, йода, брома, хлора рассматривают как антимикробную защиту. Ферменты класса трансфераз в смешанной слюне в основном представлены аспартатаминотрансферазой и аланинаминотрансферазой. Они имеют тканевое или микробное происхожение, поскольку не проходят через гематосаливарный барьер (из плазмы крови). Их активность в слюне растет при воспалении тканей пародонта и при кариесе зубов. Наибольшее количество ферментов слюны относится к классу гидролаз. Это щелочная и кислая фосфатазы, α-амилаза, лизоцим, нуклеазы. Гликозидазы. Помимо α-амилазы, в смешанной слюне определяется активность нескольких гликозидаз – α-L-фукозидазы, α- и β-глюкозидаз, α- и β-галактозидаз, α-D-маннозидазы, β-глюкуронидазы, β-гиалуронидазы, β-N-ацетилгексозаминидазы, нейраминидазы. Изменение гиалуронидазной активности в слюне коррелирует с количеством грамотрицательных бактерий и возрастает при гингивите и пародонтите. Вместе с гиалуронидазной активностью возрастает активность β-глюкуронидазы, которая в норме подавляется эндогенным ингибитором. Нуклеазы (РНКазы и ДНКазы) поступают в слюну с лейкоцитами. В смешанной слюне определены кислые и щелочные РНКазы и ДНКазы, отличающиеся по своим свойствам. Эти ферменты резко замедляют рост и размножение многих микроорганизмов в полости рта. Их активность увеличивается при некоторых воспалительных заболеваниях мягких тканей полости рта. В зависимости от значения рН (при котором действует фермент) различают щелочную и кислую фосфатазы. Активность обеих фосфатаз в смешанной слюне, как правило, увеличивается при гингивите и пародонтите. Имеются противоречивые сведения об изменении активности этих ферментов при кариесе зубов (Вавилова Т.П. с соавт., 2016). Кислая фосфатаза проявляет свою активность при рН 4,8–5,0, содержится в лизосомах и поступает в смешанную слюну с секретами больших слюнных желез, а также из бактерий, лейкоцитов и эпителиальных клеток. В слюне определяется до 4 изоферментов кислой фосфатазы. Щелочная фосфатаза наиболее активна при рН 9,1–10,5ед. В секретах слюнных желез здорового человека активность щелочной фосфатазы низка, и ее происхождение в смешанной слюне связывают с клеточными элементами и микроорганизмами. Протеиназы. В слюне отсутствуют условия для активного расщепления белков. Это обусловлено тем, что в полости рта нет денатурирующих факторов, а также присутствует большое количество белков-ингибиторов протеиназ. Низкая активность протеиназ позволяет сохранять белки слюны в нативном состоянии и полноценно выполнять свои функции. В слюне здорового человека определяется невысокая активность кислых и слабощелочных протеиназ, и их источником преимущественно являются микроорганизмы и лейкоциты, поэтому активность катепсинов В и D возрастает при воспалении, а при разрушении межклеточного матрикса тканей пародонта в слюне еще появляются матриксные металлопротеиназы (Вавилова Т.П. с соавт., 2016). Ингибиторы протеиназ.Слюнные железы являются источником большого количества секреторных ингибиторов протеиназ. Они представлены преимущественно слюнными цистатинами. Низкомолекулярные ингибиторы способны подавлять активность калликреина, трипсина, эластазы и катепсина G. Они выдерживают нагревание до 90° С при кислых значениях рН и не теряют при этом своей активности. Слюнные цистатины синтезируются в серозных клетках околоушных и поднижнечелюстных слюнных желез. Считается, что через ингибирование активности цистеиновых протеиназ слюнные цистатины выполняют антимикробную и антивирусную функции и защищают белки слюны от ферментативного расщепления. В смешанную слюну человека из плазмы крови попадают α1-ингибитор протеиназ (α1-антитрипсин) и α2-макроглобулин. Ингибитор - α2-макроглобулин ингибирует любые протеиназы. Он синтезируется в печени и определяется в слюне только у 10% обследуемых здоровых людей. В смешанной слюне большая часть ингибиторов протеиназ находится в комплексе с протеолитическими ферментами и только небольшое количество – в свободном состоянии. При воспалении количество свободных ингибиторов в слюне уменьшается, а находящиеся в комплексах ингибиторы теряют свою активность, подвергаясь частичному протеолизу. Интересен факт, что слюнные железы крупного рогатого скота являются источником ингибиторов протеиназ, поэтому их используют для получения лекарственных препаратов («Трасилол», «Контрикал», «Гордокс» и др.). Карбоангидраза синтезируется в ацинарных клетках околоушных и поднижнечелюстных слюнных желез и в составе секреторных гранул выводится в слюну. Фермент регулирует буферную емкость слюны, присутствует в приобретенной пелликуле эмали и сохраняет свою ферментативную активность на поверхности зуба. Ускоряя удаление кислот с поверхности зуба, карбоангидраза защищает эмаль зубов от деминерализации. Низкие концентрации карбоангидразы в слюне обнаруживаются у людей с активным кариозным процессом (Вавилова Т.П. с соавт., 2016). 7. Скорость слюноотделения Принято различать слюноотделение стимулированное и нестимулированное (в покое). В покое отражается базовая скорость слюноотделения (Леус П.А, 2004). Такая слюна присутствует во рту около 14 часов в сутки, стимулированная слюна – до 1,5 часов в сутки (она связана с алиментарными функциями). В сутки у человека вырабатывается в среднем от 1500 до 2000 мл слюны. Скорость секреции неравномерна, она зависит от ряда факторов: возраста (слюноотделение замедляется после 55–60 лет), пищевого раздражителя, нервного возбуждения. Кроме того, во время сна слюны выделяется в 8–10 раз меньше, чем в период бодрствования (от 0,5 до 0,05 мл/мин), а при стимуляции выделяется 2,0–2,5 мл/мин. При отсутствии жалоб и клинических признаков трудно диагностировать какое-либо нарушение слюнных желез у каждого конкретного пациента. Следует проявлять осторожность и при сравнении данных единичного измерения скорости слюноотделения со средним значением (стандартом) для популяции. Оценку объема выделения слюны у всех пациентов следует проводить в динамике и диагностировать изменение (уменьшение) этого показателя индивидуально – у каждого человека. Слюна вырабатывается в ответ на переданный по нерву импульс возбуждения. В течение большей части дня частота нейроимпульсов низкая. Это обеспечивает «нестимулированный» (базовый) уровень слюнотока. Базовое слюноотделение рассматривается как защитная секреция (Быков В.Л., 1998; Sreebny L.M., 1992, и др.). Существуют неинвазивные и безболезненные методики сбора как смешанной слюны, так и слюны, изолированной (из больших и малых слюнных желез, Леус П.А, 2004). Смешанную слюну собрать нетрудно, так как в большинстве случаев ее количество – это довольно точный показатель степени сухости в полости рта. Заболевание отдельной слюнной железы может быть диагностировано по секреции, полученной прямо из железы (Леус П.А, 2004). Количественное определение объема выделенной слюны принято называть «сиалометрией». Перед определением скорости слюноотделения, проводят подробный инструктаж пациента – объясняют методику проведения процедуры сбора слюны. Слюну собирают натощак (после ночного перерыва в приеме пищи) или через 2–2,5 часа после приема пищи. Пациента заблаговременно предупреждают и просят не делать того, что может стимулировать слюноотделение, до самой процедуры сбора. Так, этот запрет включает и жевание пищи, жевательной резинки, конфет, а также курение, чистку зубов, полоскание полости рта, питье и т. д. Тест следует проводить в спокойной обстановке. Для получения средних значений скорости слюноотделения следует провести, как минимум, два определения примерно в одно и то же время дня в два разных дня (Леус П.А., 2004; Ронь Г.И., 2008 и др.). |
