Соединения свинца
 Скачать 2.4 Mb. Скачать 2.4 Mb.
|
|
ПРОИЗВОДНЫЕ ФЕНИЛАЛКИЛАМИНА Изолирование М–д Васильевой. Биоматериал + вода + органическая кислота водная вытяжка + NH4OH + хлороформ органическая фаза выпаривание анализ М-д Стаса-Отто Биоматериал + 96% этанол + органическая кислота спиртовой экстракт упаривание + 100% этанол осаждение белков отделение осадка очищенный экстракт упаривание сухой остаток + горячая вода фильтрование + NH4OH + хлороформ органическая фаза анализ М-д Крамаренко Биоматериал + вода + серная кислота водная вытяжка + электролит осаждение белка отделение осадка очищенная водная вытяжка + эфир (доп. очистка) + NaOH до рН = 8-9 + хлороформ органическая фаза анализ Изолирование н-ацетоном Биоматериал + ацетон ацетоновое извлечение + н-гексан + Hcl очищенная фаза + NH4OH + эфир эфирное извлечение ТСХ, элюирование анализ Обнаружение амфетаминов. ТСХ НФ: силикагель ПФ: хлороформ : ацетон : этанол : аммиак Д: р-в Марки окраска Дериватизация: сухой остаток + толуол + дериватизирующий реактив темп. 60 С 30 мин. + NaH2CO3 центрифугирование Количественное определение. Выбор условий разделения Для разделения фенилалкиламинов методом ВЭЖХ рекомендуются следующие условия: —- хроматографическая колонка (62 х 2 мм), заполненная обращенно-фазным сорбентом "Сепарон" Cie (5мкм) (колонка поставляется с хроматографом); в качестве подвижной фазы (элюента) для разделения фенилалкиламинов используется смесь водного раствора ортофосфорной кислоты (0,2 М), метанола и диэтиламина (75:20:1). Добавление диэтидамина улучшает форму пиков и позволяет сократить время анализа; детектирование фенилалкиламинов проводится при 210 нм; скорость элюирования — 50 мкл/мин. Приготовление эталонных растворов а) В мерной посуде готовится раствор ортофосфорной кислоты в дистиллированной воде (0,2 М). Для этого: на аналитических весах берется навеска ортофосфорной кислоты; навеска переносится в колбу на 100 мл, объем доводится дистиллированной водой до метки, и смесь встряхивается до полного растворения (раствор № 1). б) В мерный цилиндр на 100 мл переносится 75 мл раствора № 1, 20 мл метанола и 1 мл свежеперегаанного при 5б°С диэтиламина. Смесь хорошо перемешивается. в) Для приготовления эталонных растворов анализируемых фенилалкиламинов используются чистые субстанции норэфедрина, эфедрона, эфедрина, амфетамина и метамфетамина, и проводят следующие операции: на лабораторных весах взвешивается по 25 ± 1 мг указанных веществ; навеска каждого вещества переносится в соответствующую маркированную отдельную колбу на 50 см и заполняется элюентом до метки; — содержимое колбы встряхивается до полного растворения осадка. Эталонные растворы служат для идентификации указанных веществ, определения их хроматографических параметров, а также для приготовления контрольных растворов при проведении количественных анализов. Элюеыт и эталонные растворы сравнения перед использованием необходимо очистить от механических примесей (пыль из атмосферы, частицы вещества), которые могут забивать фильтры колонки и нарушать нормальную работу насоса и хроматографической колонки. Для удаления этих примесей используется владипоровская мембрана с размером пор 0,15 — 0,25 мкм или мелкопористый стеклянный фильтр. Элюент перед работой необходимо продегазировать в течение 10 минут. Для этого используется ток газообразного гелия при расходе 40 — 50 мл/мин, обработка на ультразвуковой бане или вакуумный насос. АНАЛИЗ МОДЕЛЬНОЙ СМЕСИ ФЕНИЛАЛКИЛАМИНОВ И ОПРЕДЕЛЕНИЕ ИХ ПАРАМЕТРОВ УДЕРЖИВАНИЯ Тестовая модельная смесь норэфедрина, эфедрона, эфедрина, амфетамина, метамфетамина готовится в растворе подвижной фазы. Для этого: а) берется навеска норэфедрина, эфедрина, эфедрона, амфетамина, метамфетамина; б) навески переносятся в колбу 50см , объем доводится до метки, смесь встряхивается до полного растворения и фильтруется.. Хроматографирование модельной смеси проводится при следующих условиях: расход элюента — 100 мкг/мл; объем вводимой пробы — 7 мкл; масштаб чувствительности — 0,4 е.о.п.; время измерения — 0,3 с; длина волны — 210 нм. ОПРЕДЕЛЕНИЕ ПРЕДЕЛОВ ОБНАРУЖЕНИЯ АНАЛИЗИРУЕМЫХ ВЕЩЕСТВ Предел обнаружения анализируемого вещества устанавливается по величине такого количества вещества, которое вызывает сигнал, превышающий в 5 раз уровень флкжтуационных шумов, который на шкале чувствительности составляет 2 мм. Значение пределов обнаружения (Gmin, мг) рассчитывается по формуле АНАЛИЗ БИОПРОБ НА СОДЕРЖАНИЕ ФЕНИЛАЛКИЛАМИНОВ Качественный анализ Идентификация фенилалкиламинов, содержащихся в биопробах, производится следующим образом: а) сопоставляются время (объемы) удерживания и коэффициенты емкости определяемого компонента и образца сравнения (эталонный раствор) индивидуальных фенилалкиламинов; 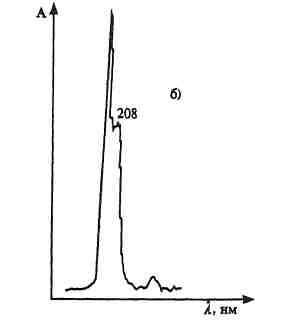 б) сравниваются УФ-спектры предполагаемого компонента и об разца сравнения; в) оценивается совпадение значений времени удерживания определяемого компонента и образца сравнения при добавлении эталонного раствора в раствор экстракта из биопробы (концентрация образца сравнения должна быть близка к концентрации определяемого компонента); г) сопоставляются УФ-спектры определяемого компонента и образца сравнения при двух длинах волн, и оценивается их спектральное отношение. Количественный анализ Для количественного анализа фенилалкиламинов в биощюбах можно использовать различные методы, в том числе метод добавки, метод внешнего стандарта, метод внутреннего стандарта и т.д. а) Метод добавки. В соответствии с методом добавки проводят анализ раствора экстракта биопробы из этого же раствора, но с добавкой в него раствора известной концентрации предполагаемого фенилалкиламина (эталонного раствора). Анализы растворов "без добавки" и "с добавкой" должны проводиться в одном масштабе регистрации. Концентрация определяемого вещества (О) в растворе экстракта из биопробы определяется но формуле 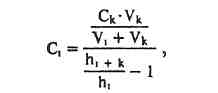 где Ск —- концентрация "добавки" в растворе подвижной фазы; Vk —- объем добавленного эталонного раствора; Vi — объем раствора экстракта с определяемым веществом; hi — высота сигнала определяемого вещества в растворе экстракта из биопробы; hi+k—- высота сигнала определяемого вещества после добавки в раствор экстракта эталонного раствора. б) Метод внешнего стандарта. В соответствии с методом внешнего стандарта и с учетом линейной зависимости выходного сигнала от массы вещества последовательно, сразу же после анализа раствора экстракта биопробы проводят анализ эталонного раствора идентифицированного вещества. Концентрация эталонного раствора (Ск) должна быть близка к концентрации определяемого вещества в растворе экстракта. Анализы эталонного раствора и экстракта биопробы должны проводиться в одном масштабе регистрации. где hi — высота сигнала определяемого наркотического вещества в растворе экстракта биопробы; hk — высота пика вещества эталонного раствора. в) Метод внутреннего стандарта. В соответствии с методом внутреннего стандарта к биообъекту до операции пробоподготовки добавляется известное количество вещества, принятого за стандарт. Концентрация определяемого вещества (СО рассчитывается по формуле где Свс — концентрация внутреннего стандарта; hi — высота пика (или площадь) определяемого вещества; hBc — высота пика (или площадь) стандарта; Fi/bc— относительный калибровочный фактор. Относительный калибровочный фактор компонента Fi/с вычисляется по формуле где hi — высота пика (или площадь) компонента известной концентрации (калибровочный раствор); Q —концентрация калибровочного раствора определяемого компонента; hue — высота пика (или площадь) внутреннего стандарта; Свс — концентрация внутреннего стандарта. СЕЛЕКТИВНЫЙ АНАЛИЗ ЭФЕДРОНА Используя значительное различие в коэффициентах молярного поглощения эфедрона и других соединений этой группы при 250 нм, можно провести селективный анализ эфедрона в смеси с другими компонентами этой группы — норэфедрином, эфедрином, амфетамином, метамфетамином. При этом анализ проводится путем детектирования при двух длинах волн: 210 нм для регистрации всех определяемых фенилал-киламинов и 250 нм для селективно определяемого эфедрона с последующим сопоставлением полученных хроматограмм для количественного определения эфедрона в биопробах. При детектировании при длине волны 250 нм имеет место селективная чувствительность спектрофотометрического детектора к определяемому эфедрону и практически полное отсутствие чувствительности к сопутствующим компонентам. Эфедрин 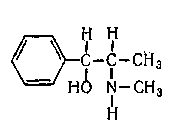 Эфедрин (1-фенил-2-метиламинопропанола-1-. гидрохлорид) относится к ациклическим алкалоидам, в молекуле которых аминогруппа находится в боковой цепи. Эфедрин и его стереоизомер псевдоэфедрин находится в некоторых видах эфедры. Эфедрин также содержится в тиссе ягодном и в некоторых других растениях. Находящийся в растениях эфедрин является левовращающим, а синтетический — правовращающим. К числу синтетических препаратов относится эфетонин, являющийся рацематом эфедрина. Основание эфедрина растворяется в этиловом спирте (1 : 1), воде (1:36), диэтиловом эфире и хлороформе. Гидрохлорид эфедрина растворяется в воде (1 :4), этиловом спирте (1 : 17), практически не растворяется в диэтиловом эфире и хлороформе. Эфедрин экстрагируется органическими растворителями из щелочных водных растворов. Он повышает артериальное давление, сужает сосуды, расширяет зрачок и бронхи, уменьшает перистальтику кишок, возбуждает центральную нервную систему. В медицине эфедрин применяется при бронхиальной астме, в глазной практике и при ряде других заболеваний. Метаболизм. Эфедрин быстро всасывается из пищевого канала и накапливается в печени, почках, легких и мозге. Через 24 ч 80 % принятой дозы эфедрина выделяется из организма с мочой в неизмененном виде. Незначительная часть дозы эфедрина подвергается N-деметилированию с образованием феиилпропаноламина. Этот метаболит эфедрина выделяется из организма с мочой. Эфедрин — в неизмененном виде выделяется 55—75%. Основными метаболитами являются: 8 — 20%— норэфедрин, 4 — 13%—безаминные метаболиты (бензойная и гиппуровая кислоты, фенилпропандиол). При щелочной моче выведение эфедрина снижается до 20—35%, соответственно увеличивается содержание норэфедрина. рКа = 9,6. Т ½ = 9-11ч. Обнаружение эфедрина Реакция с солями меди и сероуглеродом. При взаимодействии эфедрина с сероуглеродом и щелочным раствором сульфата меди образуется производное дитиокарбаминовой кислоты, растворимое в бензоле: 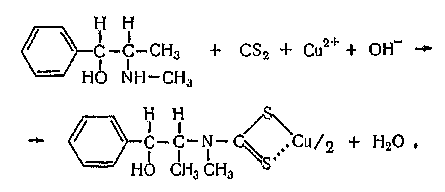 2. Реакция с 2,4-Динитрохлорбензолом. При этом образуется фенилэтилкетон и амин: Образовавшийся при этой реакции метиламин с 2,4-динитро-хлорбензолом дает соединение желтого цвета, которое экстрагируется хлороформом: 3. Реакция с реактивом Драгендорфа. При взаимодействии эфедрина с реактивом Драгендорфа образуются кристаллы, напоминающие тонкие иглы, собранные в пучки. Обнаружение эфедрина по УФ- и ИК-спектрам. Основание эфедрина, растворенное в 0,1 н. растворе серной кислоты, имеет максимумы поглощения при 251, 256 и 262 нм; в ИК-области спектра основание эфедрина (диск с бромидом калия) имеет основные пики при 703, 1455 и 745 см'1. Эфедрон Быстро всасывается в ЖКТ после орального применения, максимум концентрации – через 2-3 часа. Выводится с мочой. рКа = 9. Т1/2 = 3-8ч. 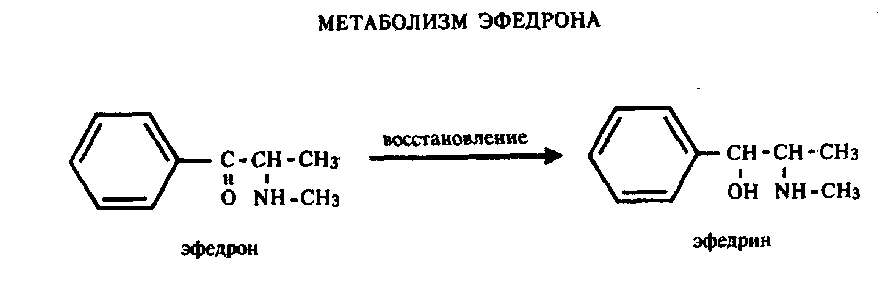 Амфетамин Амфетамин в неизмененном виде экскретируется с мочой лишь на 30%. В качестве его метаболитов определяются: 16—28% — гиппуровая кислота, 4% — бензоглюкуронид, 2—4%— 4-гидроксиамфетамин, 2%—норэфедрин. рКа = 9,9. Т ½ = 8-12ч. 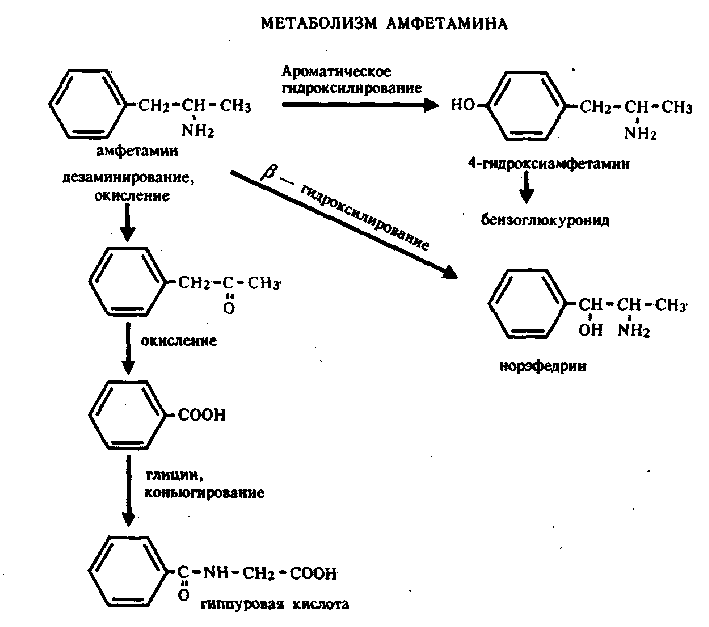 Метамфетамин Метамфетамин — в неизмененном виде с мочой выделяется около 45%. Основные метаболиты: 5%—амфетамин, 15% —4-гидроксиметиламфетамин. рКа = 10,1. Т ½ = 9ч. ПРОИЗВОДНЫЕ ФЕНОТИАЗИНА Производные фенотиазина относятся к нейролептикам. В основе строения данной группы соединений лежит фенотиазиновое кольцо. Физико-химические свойства При взаимодействии с кислотами фенотиазины образуют соли, легко растворимые в воде, спирте, хлороформе, но практически нерастворимые в эфире и бензоле. Основания представляют собой сиропообразную массу, нерастворимую в воде, но растворимую а спирте, эфире, хлороформе, этилацетате. Абсорбция производных фенотиазина в УФ-области спектра наличие 2 максимумов: λ мах. 1. 250-260 нм (ε 35000) 2. 300-315 нм (ε 4500) УФ-спектры отражают только электронную структуру фенотиазиновой части молекулы. Исключение представляют те производные, которые во 2-ом положении содержат радикалы со свободными n-электронами (тиоридазин, левомепромазин). Сульфоксиды фенотиазинов имеют в отличие от нативных (основных) соединений 4 максимума в УФ-области: 230,265,285 и 400 нм. Поведение в организме Всасываются фенотиазины как вещества основного характера преимущественно из кишечника. Гидрофобный характер оснований фенотиазинов способствует взаимодействию их с белками. Кажущийся объем, распределения (Vр) приближается к 100%, поэтому, фенотиазины локализуются в тканях органов (мозг, печень, почки). Выводятся почками, в моче обнаруживается в основном в виде метаболитов. Метаболизм фенотиазинов протекает в 3-х направлениях: 1 путь - трансформация в радикалах R1 и R2 а)N-O-S-деметилирование, которое приводит к увеличению полярности соединений; б)окисление N10-боковой цепи. 2 путь - сульфоокисление Сульфоокисление - образование сульфоксидов со степенью окисления 4 и 6. 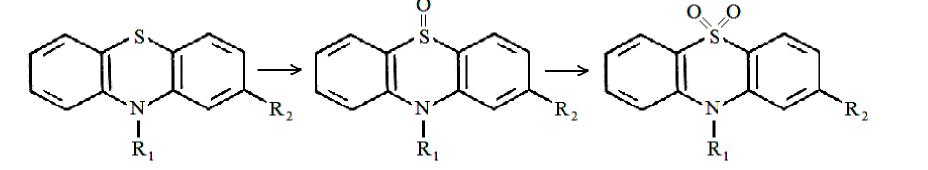 3 путь - ароматическое гидроксилирование в положениях 3, 6 с последующим конъюгировапием с глюкуроновой кислотой. 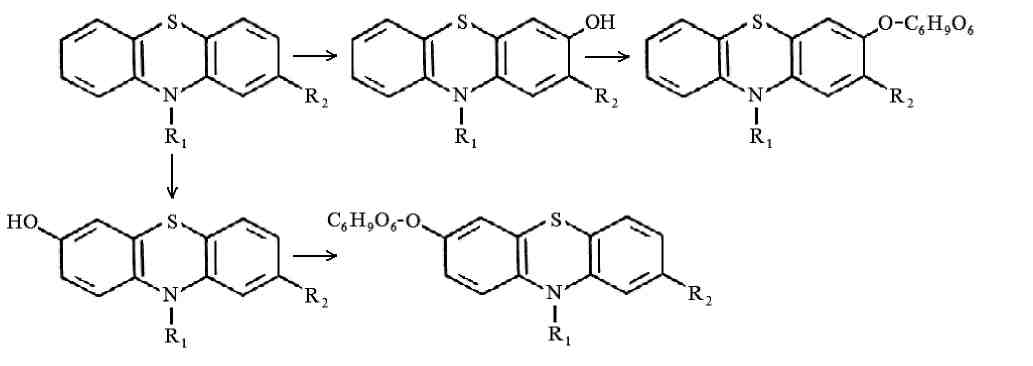 Анализ фенотиазинов Обнаружение проводят по общей схеме идентификации лекарственных соединений: ГХ-анализ Разделение производных фенотиазина проводят на фазе средней полярности OV-225 (3-5% на хроматоне), в стеклянных микроколонках длиной 1-2 м при 200-250оС. Температура инжектора 250-300оС. Детектор азотнофосфорный (чувствительность 0,006мкг/мкл), а для хлорсодержащих – по захвату электронов (чувствительность – 0,001). Внутренний стандарт - имизин. Фотометрия в видимой области спектра В основу этих методов положено измерение поглощения окрашенных продуктов реакции пр.фенотиазина: с конц. H2SO4 – эта методика нашла наиболее широкое применение. Недостаток метода – возможность обугливания при наличии соэкстрактивных веществ, особенно при использовании гнилостно-разложившегося биологического материала (аминазин, дипразин); с реактивом Манделина и конц. H2SO4. Методика используется для производных фенотиазина, которые с конц. H2SO4 дают нестабильное окрашивание с невоспроизводимыми значениями оптической плотности (тиоридазин, левомепромазин); с 18% р-ром соляной кислоты и 1 м р-ром мышьяковой к-ты. Реакция не уступает по чувствительности первым двум методам, однако мягкие условия окисления исключают возможность обугливания соэкстрактивных веществ (тиоридазин, френолон). Фотометрия в УФ-области спектра Этот метод требует высокой степени очистки извлечения и обычно сочетается с ТСХ. Измерение проводят при λмах 250-255нм в раствора 0,5 н. H2SO4. Выделение из биологического материала (метод Соломатина) соединения основного характера Биоматериал + 100% этанол + щавелевая кислота до рН = 2-3 образование растворимых в воде оксалатов фенотиазинов настаивают 3 раза по 2 часа вытяжка упаривание + 100% спирт очищенный от белков раствор упаривание + вода фильтрование очищенный раствор + эфир органическая фаза исследование на фенотиазины. Изолирование из мочи и крови Раздельно 5-10 мл мочи и 2 мл крови + 50% NaOH до рН 13 10 минут на водяной бане гидролизат охлаждается до комнатной температуры и дважды извлекается н-гептаном, содержащим 3% изоамилового спирта промывают водой, насыщенной гептаном и делят на две равные части в одной части проводится обнаружение производных фенотиазина методом тонкослойной хроматографии, а в другой – количественное определение. Экстракт из крови полностью расходуется на количестввенное определение, т.к. содержит меньшее количество соэкстрактивных веществ. Хроматографичесткая очистка и обнаружение в тонких слоях Из аликвоты органического экстракта удаляют в токе теплого воздуха органический растворитель. Сухой остаток + хлороформ НФ: Силуфол ПФ: бензол : диоксан : аммиак ЛИБО этилацетат: ацетон : аммиак В качестве метчиков наносят аминазин (обязательно) и те производные фенотиазина, которые были обнаружены в процессе предварительного исследования. Д: одну пластинку опрыскивают раствором конц. H2SO4 в этаноле (1:9) и при положительном результате на второй пластинке обнаружение проводят прокапыванием реактивом Марки. ТСХ-скрининг Общая система НФ: силикагель КСК ПФ: ацетон : хлороформ : аммиак : диоксан Д: 57% раствор HClO4 + 0.5% NaNO2 розово-фиолетовый Частная система НФ: силикагель КСК ПФ: ацетон : хлороформ Д: 57% раствор HClO4 + 0.5% NaNO2 розово-фиолетовый Качественное обнаружение. С растворами йодида висмута в йодиде калия и фосфорно-молибденовой кислоты получаются аморфные осадки. С концентрированной серной кислотой возникает устойчивое пурпурно-красное окрашивание. С формалинсерной кислотой аминазин дает пурпурно-красное окрашивание, усиливающееся при стоянии. С концентрированной азотной кислотой возникает быстро исчезающее пурпурно-красное окрашивание. С 5% раствором золотохлористоводородной кислоты (после 3—4-кратной обработки остатка основания аминазина 0,1 н. раствором НС1) выделяется темно-красный аморфный осадок, переходящий через 20-50 минут в характерный кристаллический. Обнаружение фенотиазинов. Фенотиазины часто обнаруживают с помощью тонкослойной хроматографии щелочных экстрактов мочи, но при пероральном поступлении в организм специфическая идентификация этого соединения может оказаться невозможной, если для анализа имеется только моча. Фенотиазины, принимаемые в низких дозах, например флуфеназин, невозможно обнаружить в моче ни одним из известных методов. Качественный анализ а) Реакции осаждения +общеалкалоидные осадающие реактивы (часто реактив Драгендорфа) +соль Рейнеке, Bi, Au б) Микрокристаллические реакции +5% раствор хлорного золота дает характерные кристаллические осадки +соль Рейнеке дает характерные кристаллические осадки 4) окисление солями металлов, имеющих высшую степень окисления (FeCl3 и HPtCl4). В основе теста лежит реакция многих из этих соединений с ионами трехвалентного железа в кислой среде. Предпринимается для исследования мочи, содержимого желудка и остатков веществ с места происшествия. а)Реактив FPN (FeCl3+ HClO4+ HNO3), Цвета, варьирующиеся от розового, красного или оранжевого до фиолетового или синего, могут свидетельствовать о присутствии фенотиазинов или их метаболитов. Моча пациентов, регулярно принимающих в лечебных целях традиционные фенотиазины, например хлорпромазин, обычно дает положительную реакцию. Чувствительность Хлорпромазин, 25 мг/л. б)Элениум + HPtCl4 → фиолетовый осадок; Тиоридазин – серо-розовый осадок; Левомепромазин –ярко-зеленое окрашивание. Количественное определение Количественное определение производных фенотиазина проводится без предварительной хроматографической очистки и разделения только в случае, когда установлено отсутствие в биообъекте других веществ основного характера. При их наличии для количественного определения производных фенотиазина проводят хроматографическую очистку методом ТСХ. Для этого на хроматографическую пластинку на стартовую линию, наносят в виде сплошной полосы шириной 1 см всю аликвоту экстракта для количественного определения и хроматографируют. По окончании хроматографирования в УФ-свете отмечают зону соединения с соответствующим Rf, параллельно метчикам, снимают слой сорбента, содержащего соединение скальпелем в пробирку. Элюирование проводят 10 мл раствора 25% аммиака в этаноле (1:1) элюат отделяют фильтрованием через стеклянный фильтр № 4, упаривают досуха в токе холодного воздуха. Сухой остаток растворяют в 5 мл 0,1 н раствора HCl, затем добавляют 4 мл 0,01 н НCl. В случае отсутствия других веществ основного характера вторую часть гептанового извлечения (кровь, моча) реэкстрагируют 5 мл 0,1 н. HCl, а затем 4 мл 0,01 н НCl. Солянокислые растворы объединяют. К объединенному солянокислому раствору добавляют 12 мл ацетатного буферного раствора (рН 3,5), 2 мл насыщенного раствора метил-оранжа и 5 мл хлороформа. Полученная смесь взбалтывается в делительной воронке – при наличии производных фенотиазина хлороформный слой окрашивается в желтый цвет (гелиантаты производных фенотиазина, извлекаемые хлороформом). Хлороформный слой отделяется и определяется оптическая плотность окрашенного раствора (фотоэлектроколориметр ФЭК-56 и др., кювета 10 мм, светофильтр синий с максимумом пропускания при 400 нм). Для построения калибровочной кривой готовят стандартные растворы в 0,01 н НСl производных фенотиазина с содержанием 1,2-10 мкг/мл производных: фенотиазина и исследуют их вышеприведенной процедурой. На основании результатов определения оптической плотности строится калибровочный график. Вышеприведенным методом изолируется до 60% производных фенотиазина из крови и до 80% из мочи. Аминазин Аминазин (хлорпромазин, плегомазин, хлоразин, ларгактил и др.) представляет собой белый или белый с кремоватым оттенком мелкокристаллический порошок. Аминазин гигроскопичен, темнеет под влиянием света, хорошо растворяется в воде, этиловом спирте и хлороформе. Он практически не растворяется в диэтиловом эфире. Растворы аминазина имеют кислую реакцию. Аминазин экстрагируется органическими растворителями из щелочных растворов. Он оказывает сильное седативное действие. При больших дозах аминазин вызывает сон. Он усиливает действие снотворных, наркотических и местноанестезирующих веществ. Аминазин имеет противорвотное действие и успокаивает икоту. Он уменьшает проницаемость сосудов, снимает страх, тревогу, напряжение у больных психозами и неврозами. Метаболизм аминазина: Гидроксилирование Сульфоокисление N-деметилирование разрыв боковой цепи Аминазин всасывается преимущественно из кишечника. Локализуется в тканях мозга, печени, почек. Главными метаболитами аминазина у человека являются: 7-оксипроизводное, десмонометиламиназин и соответствующие сульфоксиды указанных метаболитов. Перечисленные выше метаболиты выделяются с мочой. Некоторое количество этих метаболитов выделяется с мочой в виде комъюгатов с сульфатами и глюкуроновой кислотой. С мочой выделяется и часть неизмененного аминазина. Объекты: 1. Промывные воды желудка (если токсикант был принят внутрь, то промывные воды будут содержать его следы); 2. Желудок с содержимым, кишечник с содержимым (обнаруживаются остатки токсиканта, не успевшие всосаться в кровь); 3. Части печени, почек (аминазин метаболизируется в печени, частично выводится почками). Выделение аминазина из биологического материала (по Б. М. Саломатину). 100 г измельченного биологического материала + этиловый спирт, подкисленным 10% р-м щавелевой кислоты до рН = 2...3. кислые спиртовые вытяжки на водяной бане (при 40 °С) упаривают до густоты сиропа + 96° этиловым спиртом фильтруют выпаривают досуха + 100 мл воды (темп. 40—60 °С) жидкость охлаждают и фильтруют + 5 % р-р щавелевой кислоты до рН = 2...3 + диэтиловый эфир (по 50 мл 2 раза) + 50%-м р-м гидроксида натрия до рН = 13 + 4 порции диэтилового объединенные эфирные вытяжки + 0,5 н р-р серной кислоты водные вытяжки соединяют и нагревают 3 мин на водяной бане (темп. 50—60 °С) кислые водные вытяжки используют для обнаружения аминазина. Выделение аминазина из крови. 5—10 мл крови + 30—50 мл этилового спирта, подкисленного 10 % р-м щавелевой кислоты до рН = 2...3 нагревают на кипящей водяной бане 10 мин охлаждают спиртовую вытяжку сливают и выпаривают досуха + 50 мл воды, нагретой до 40—60 °С взбалтывают фильтруют + 20 мл диэтилового эфира (2 раза) взбалтывают 5—10 мин отделяют эфирный слой кислую водную фазу подщелачивают 50 %-м р-м гидроксида натрия до рН=13 и взбалтывают с 3—4 порциями диэтилового эфира (по 10 мл). Эфирные вытяжки соединяют и исследуют на наличие аминазина. Выделение аминазина из мочи. 50—200 мл мочи + 25 % р-р серной кислоты до рН = 2...3 нагревают на кипящей водяной бане 5 мин охлаждают до комнатной температуры жидкость взбалтывают 5—10 мин с диэтиловым эфиром по 50 мл (2 раза) кислую водную фазу исследуют на наличие аминазина. Предварительные пробы на наличие аминазина в моче. К 1 мл мочи прибавляют 1 мл реактива, состоящего из 80 мл 10 %-го раствора серной кислоты и 20 мл 5 %-го раствора хлорида железа (III). При наличии аминазина и других производных фенотиазина в моче раствор приобретает розовато-лиловую окраску. К 1 мл мочи прибавляют 1 мл реактива ФПН. Появление розовой окраски указывает на наличие аминазина или других производных фенотиазина в моче. Предварительные испытания. Качественные реакции: Реакция с концентрированной серной кислотой. Аминазин с концентрированной серной кислотой дает пурпурно-красную окраску. Реакция с концентрированной азотной кислотой. При взаимодействии аминазина с концентрированной азотной кислотой возникает пурпурно-фиолетовая окраска. Реакция с концентрированной соляной кислотой. Аминазин с концентрированной соляной кислотой дает розовато-фиолетовую, переходящую в красно-фиолетовую окраску. Реакция с реактивом Марки. Аминазин под влиянием реактива Марки приобретает пурпурную окраску. Реакция с реактивом Манделина. Аминазин с этим реактивом дает зеленую окраску, переходящую в пурпурную. Обнаружение аминазина методом хроматографии. НФ: силуфол ПФ: бензол : диоксан : аммиак Д: р-в Марки / HNO3 : СН5ОН Количественное определение аминазина и его метаболитов. Фотоколориметрическое определение основано на реакции с концентрированной серной кислотой. Фотометрирование проводят при λ = 508 нм в кювете 5,105; эталон сравнения – контроль реактивов. Расчет содержания аминазина и его метаболитов производится по калибровочному графику. Спектрофотометрическое обнаружение. Спектрофотометрический метод основан на количественной оценке поглощения растворов токсикантов в ультрафиолетовой области. Ультрафиолетовый спектр снимается в диапазоне длин вол 220-400 нм на СФ-4, СФ-4А и др. при концентрации 10 мкг/мл в пересчете на основание. Максимумы абсорбции неизмененного аминазина при λ = 254-255 нм (макс.) и λ = 300-305 нм (мин). Неизмененный аминазин обычно обнаруживается в желудке и желудочно-кишечном тракте и их содержимом. Основной метаболит – сульфоксид – имеет максимумы абсорбции при длинах волн 238-240, 273; 298 и 340 нм. Химико-токсикологическим анализом по описанной методике обнаруживается 53-60% аминазина, добавленного к органам. Граница обнаружения 0,2 мг, граница определения 0,5 мг аминазина в 100 г органов. Дипразин  Дипразин (пипольфен, прометазин, протазии и др.) — белый кристаллический порошок, легкорастворимый в воде и этиловом спирте, хлороформе (1 : 2), почти не растворим в диэтиловом эфире. Дипразин экстрагируется органическими растворителями из щелочной среды. Дипразин имеет выраженную противогистаминную активность. Он обладает седативным действием, усиливает действие наркотических, снотворных и анальгезирующих средств. Дипразин применяется для лечения аллергических заболеваний, зудящих дерматозов, хореи, энцефалита и др. Главным метаболитом дипразина является сульфоксид этого препарата. Часть дипразина в неизмененном виде выделяется с мочой. Кроме этого, с мочой выделяется и сульфоксид дипразина, который можно обнаружить в моче даже через 14 сут после приема указанного препарата. Выделение из биологического материала (по Б. М. Саломатину). 100 г измельченного биологического материала + этиловый спирт, подкисленным 10% р-м щавелевой кислоты до рН = 2...3. кислые спиртовые вытяжки на водяной бане (при 40 °С) упаривают до густоты сиропа + 96° этиловым спиртом фильтруют выпаривают досуха + 100 мл воды (темп. 40—60 °С) жидкость охлаждают и фильтруют + 5 % р-р щавелевой кислоты до рН = 2...3 + диэтиловый эфир (по 50 мл 2 раза) + 50%-м р-м гидроксида натрия до рН = 13 + 4 порции диэтилового объединенные эфирные вытяжки + 0,5 н р-р серной кислоты водные вытяжки соединяют и нагревают 3 мин на водяной бане (темп. 50—60 °С) кислые водные вытяжки используют для обнаружения. Обнаружение дипразина Реакция с концентрированной серной кислотой. Дипразин с концентрированной серной кислотой дает пурпурно-красную окраску. Реакция с концентрированной азотной кислотой. При взаимодействии дипразина с концентрированной азотной кислотой появляется бледная пурпурно-красная окраска, переходящая в желтую. Реакция с концентрированной соляной кислотой. Дипразин с концентрированной соляной кислотой дает розовато-фиолетовую окраску, переходящую в пурпурно-фиолетовую. Реакция Витали — Морена. Реакция с реактивом Марки. Дипразин с реактивом Марки дает пурпурную окраску. Реакция с реактивом Манделина. Реактив Манделина с Дй-празином дает зеленую окраску, переходящую в пурпурную. Обнаружении методом ТСХ НФ: силуфол ПФ: бензол : диоксан : аммиак Д: р-в Марки / HNO3 : СН5ОН Обнаружение дипразина по УФ- и ИК-спектрам. Дипразин, растворенный в смеси воды и этилового спирта (1:1), имеет максимумы поглощения при длинах волн, равных 252 и 301 нм; в 0,01 н. растворе соляной кислоты имеет максимум поглощения при 249 и около 300 нм; в ИК-области спектра дипразин (диск с бромидом калия) имеет основные пики при 1459, 1222 и 757 см"1. Тизерцин (левомепромазин. левопромазин, метотримепразин и др.) — белый кристаллический порошок, слаборастворимый в воде, хорошо растворяется в этиловом спирте, диэтиловом эфире и хлороформе.  Тизерцин экстрагируется органическими растворителями из щелочных растворов. Тизерцин обладает адренолитической и противогистаминной активностью, проявляет анальгезирующее действие. Под влиянием тизерцина быстро наступает седативный эффект. |
