Соединения свинца
 Скачать 2.4 Mb. Скачать 2.4 Mb.
|
|
Йод Качественное определение,количественное определение: Лучшим объектом для исследования являются свежие рвотные массы.Пары свободного йода можно вытеснить из объекта током воздуха при слабом нагревании, а затем поглощать разведенным крахмальным клейстером. Посинение раствора укажет на наличие хлора. Свободный йод легко вступает в соединение с белками и щелочами. Для обнаружение солей йода в биологическом материале ее подщелачивают едким натром и сжигают. Золу после сжигания извлекают горячей водой, раствор фильтруют, сгущают до небольшого объема, прибавляют раствор нитрита натрия, подкисляют разведенной серной кислотой и нагреванием отгоняют йод в раствор крахмального клейстера или в хлороформ. Крахмальный клейстер помещают в две склянки Дрекселя: вторая склянка служит для контроля поглощения. Поглощенный крахмальным клейстером йод титруют 0.1 н раствором тиосульфата натрия, а при малых количествах определяют колориметрически. Обнаружение йода в моче. 20-100 мл мочи подкисляют разведенной серной кислотой , прибавляют раствор нитрита натрия и взбалтывают с малым количеством хлороформа - получается фиолетовое окрашивание. Оксид углерода(2) Оксид углерода (II) представляет собой газ без цвета и запаха. Смесь оксида углерода (II) с воздухом может быть взрывоопасной. При комнатной температуре взрывоопасны смеси, содержащие от 16 до 73 % оксида углерода (II). Оксид углерода (II) проникает в кровь через дыхательные пути, а затем с гемоглобином крови образует довольно прочное соединение — карбоксигемоглобин (СОНb). Сродство оксида углерода (II) к гемоглобину в 300 раз больше, чем сродство кислорода к указанному оксиду. В крови лиц, отравленных оксидом углерода (II), содержится гемоглобин и его соединения, к числу которых относятся: гемоглобин, не связанный с кислородом и оксидом углерода (II), или так называемый дезоксигемоглобин (Hb), оксигемоглобин (OHb) — гемоглобин, связанный с кислородом, и карбоксигемоглобин (COHb) — гемоглобин, связанный с оксидом углерода (II). Кроме того, в крови может содержаться некоторое количество метгемоглобина (MtHb). При отравлениях метгемоглобин не связывается с оксидом углерода (II). В тканях мышц лиц, отравленных оксидом углерода (II), содержится дезоксимиоглобин (MHb), оксимиоглобин (ОMHb) и карбоксимиоглобин (COMHb). Обнаружение карбоксигемоглобина в крови является доказательством отравления оксидом углерода (II). Для обнаружения и количественного определения карбоксигемоглобина используются: спектроскопические, спектрофотометрические, фотоколориметрические, газо-хроматографические, химические и другие методы. Качественное определение 1.Спектрофотометрический способ обнаружения: В крови лиц, отравленных оксидом углерода (II), не весь гемоглобин превращается в карбоксигемоглобин. Смерть наступает значительно раньше, чем достигается полное превращение оксигемоглобина в карбоксигемоглобин. Карбоксигемоглобин можно обнаружить в крови спектроскопом, который является прибором для визуального спектрального определения ряда веществ, в том числе и карбоксигемоглобина. При рассматривании крови спектроскопом наблюдаются линии и полосы, позволяющие сделать вывод о наличии или отсутствии карбоксигемоглобина. Подлежащую исследованию кровь разбавляют водой до тех пор, пока не будет получен раствор, имеющий светло-розовую окраску. При спектроскопическом исследовании этого раствора четко видны соответствующие спектральные полосы. Спектр оксигемоглобина крови OHb имеет две полосы поглощения между линиями Фраунгофера D и Ε при длинах волн 577—589 и 536—556 нм. Спектр карбоксигемоглобина COHb имеет две полосы поглощения при длинах волн 564—579 и 523— 536 нм. После прибавления одного объема свежеприготовленного раствора сульфида аммония (NH 4 ) 2 S или других восстановителей (дитионит натрия Na 2 S 2 O 4 ·2H 2 O и др.) к четырем объемам водного раствора исследуемой крови оксигемоглобин (OHb) превращается в дезоксигемоглобин Hb, в спектре которого имеется одна широкая полоса поглощения при 543—596 нм. Карбоксигемоглобин не восстанавливается сульфидом аммония и другими восстановителями. Поэтому после прибавления восстановителей полосы поглощения карбоксигемоглобина не исчезают. Таким образом, после прибавления раствора сульфида аммония к крови, содержащей окси- и карбоксигемоглобин, сохраняются две полосы поглощения карбоксигемоглобина, но исчезают полосы поглощения оксигемоглобина, а вместо них появляется широкая полоса поглощения дезоксигемоглобина. По наличию соответствующих полос поглощения в спектре крови делают вывод об отравлении оксидом углерода (II). Спектральный метод оправдывает себя при исследовании крови, содержащей 10—30 % карбоксигемоглобина. 2.Химические методы обнаружения Реакция с раствором гидроксида натрия (проба Гоппе— Зейлера). К определенному объему крови прибавляют равный или двойной объем 30 %-го раствора гидроксида натрия. Кровь, содержащая карбоксигемоглобин, остается ярко-красной, а кровь, не содержащая карбоксигемоглобина, буреет. Реакция с сульфидом аммония (проба Сальковского — Катаяма). К Ю мл дистиллированной воды прибавляют 5 капель крови и 5 капель свежеприготовленного раствора сульфида аммония. Смесь осторожно взбалтывают, прибавляют 30 %-й раствор уксусной кислоты до слабокислой реакции и слегка взбалтывают. Кровь, содержащая карбоксигемоглобин, имеет малиново-красную окраску, а кровь, не содержащая карбоксигемоглобина, становится серо-зеленой. Реакция с хинином и сульфидом аммония (проба Хорошке-вича — Маркса). К 2 мл крови прибавляют 4 мл 8 %-го раствора гидрохлорида хинина и смесь кипятят непродолжительное время. После охлаждения смеси прибавляют 2—3 капли свежеприготовленного раствора сульфида аммония и сильно взбалтывают. Р 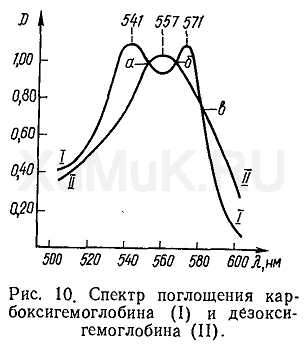 еакция с гексацианоферратом (III) калия (проба Бюр-кера). К 5 мл крови прибавляют воду до 500 мл и взбалтывают. К 5—10 мл полученного раствора крови прибавляют 5 капель 1 %-го раствора гексацианоферрата (III) калия К 3 [Fe(CN) 6 ]. Кровь, в которой содержится карбоксигемоглобин, остается красной, а кровь, не содержащая карбоксигемоглобина, становится желтоватой. Реакция с гексацианоферратом (III) калия и дихроматом калия (проба Сидорова). 1 мл крови разбавляют водой до 10 мл. К 2 мл полученного раствора крови прибавляют 3—5 капель 20 %-го раствора гексацианоферрата (III) калия и такой же объем 0,01 %-го раствора дихромата калия. Смесь крови и реактивов слегка взбалтывают. Кровь, содержащая карбоксигемоглобин, становится карминово-красной, а кровь, не содержащая карбоксигемоглобина, приобретает коричневато-зеленую окраску. Р еакция с гексацианоферратом (III) калия и уксусной кислотой (проба Ветцеля). К 10 мл крови прибавляют 90 мл воды. К 10 мл полученного раствора прибавляют 5 мл 20 %-го раствора гексацианоферрата (III) калия и 1 мл ледяной уксусной кислоты. Из крови, содержащей карбоксигемоглобин, выпадает вишнево-красный осадок, а из крови, не содержащей карбоксигемоглобина,— серовато-коричневый осадок. Реакция с танином (проба Кункеля — Ветцеля). Кровь разбавляют пятикратным объемом дистиллированной воды. В пробирку вносят 5 мл этого раствора крови, прибавляют 15 мл 3 %-го водного раствора танина, а затем содержимое пробирки хорошо взбалтывают. Из крови, содержащей карбоксигемоглобин, выпадает светлый карминово-красный осадок, а из крови, не содержащей карбоксигемоглобина, выпадает серовато-коричневый осадок. Реакция с формальдегидом (проба Либмана). К 5 мл неразбавленной крови прибавляют 5 мл формалина (40 %-й раствор формальдегида) и сильно взбалтывают. Кровь, содержащая карбоксигемоглобин, сохраняет красную окраску, а кровь, не содержащая карбоксигемоглобина, через несколько минут становится коричневато-черной. Реакция с ацетатом свинца (проба Рубнера). К 5 мл неразбавленной крови прибавляют 20 мл 5 %-го раствора основного ацетата свинца и в течение 1 мин сильно взбалтывают. Кровь, содержащая карбоксигемоглобин, сохраняет красную окраску, Реакция с сульфатом меди (проба Залесского). К 1 мл крови прибавляют воду до 100 мл и хорошо взбалтывают. К 5 мл полученного раствора крови прибавляют 5 капель 10 %-го раствора сульфата меди. Смесь хорошо взбалтывают. Кровь, содержащая карбоксигемоглобин, становится пурпурно-красной, а кровь, не содержащая карбоксигемоглобина, приобретает зеленоватую окраску. Количественное определение Для количественного спектрофотометрического определения оксида углерода (II) по карбоксигемоглобину приготовляют ряд растворов: раствор А — раствор исследуемой крови; раствор Б — раствор крови, содержащей смесь карбоксигемоглобина и дезоксигемоглобина; раствор В — раствор крови, в которой все формы гемоглобина (дезоксигемоглобин, оксигемоглобин и метгемоглобин) полностью переведены в карбоксигемоглобин. При количественном определении оксида углерода (II) необходимо измерять оптическую плотность раствора крови, содержащего смесь карбоксигемоглобина и дезоксигемоглобина, а затем измерять оптическую плотность раствора крови, насыщенного оксидом углерода (II). Этот раствор не должен содержать дезоксигемоглобина, оксигемоглобина и метгемоглобина. Дезоксигемоглобин имеет максимум светопоглощения при длине волны, равной 557 нм, а карбоксигемоглобин имеет 2 максимума светопоглощения при длинах волн 541 и 571 нм. При наложении спектральных кривых карбоксигемоглобина и дезоксигемоглобина на одном графике отмечается появление трех изобестических точек (а, б, в) при длинах волн 550, 565 и 580 нм. В этих точках пересечения спектральных кривых оптические плотности растворов карбоксигемоглобина и дезоксигемоглобина одинаковы Расчет содержания карбоксигемоглобина в исследуемой крови в процентах Ρ производят по формуле: ПРОИЗВОДНЫЕ БАРБИТУРОВОЙ КИСЛОТЫ Барбитураты — сильные снотворные и седативные средства. Имеют кето-енольную и лактим-лактамную таутомерию Пробоподготовка. Изолирование из органов трупа. Общие методы Изолирование нейтральным ацетоном Метод Васильевой Метод Стаса-Отто Частные методы Метод Валова 100 г измельченного биологического материала + 180 мл воды и 20 мл 10 %-го раствора гидроксида натрия 30 мин при частом перемешивании центрифугируют 30 мин надосадочная жидкость + 120 мл 10 %-го раствора вольфрамата натрия и 1 н. раствор серной кислоты (до рН=2) нагревают на кипящей водяной бане 20 мин центрифугирование центрифугат процеживают через ватный тампон собирают в делительную воронку + диэтиловый эфирэфирный слой + 50 мл 10%-го гидроксида натрия водный слой отделяют + 25 %-ным раствор серной кислоты до рН=2 + диэтиловый эфир эфирная вытяжка Метод Швайковой 100 г измельченных органов трупов + 200 мл воды + раствор щавелевой кислоты до рН=2 2 ч при перемешивании центрифугируют 30 мин центрифугат процеживают через ватный тампон + хлороформ в течение 5 мин (3 раза) вытяжки соединяют + 25 мл 0,1 н. раствора гидроксида натрия хлороформная вытяжка + вода + соляная кислота до рН=2 + две порции хлороформа (по 20 мл) 5 минхлороформная вытяжка. Метод Попова 100 г измельченного биологического материала + 80 мл р-ра серной кислоты до рН=2...3 настаивают 2 ч при перемешивании биологический материал еще 2 раза настаивают с новыми порциями раствора серной кислоты 1 ч. водные вытяжки процеживают через марлю и центрифугируют центрифугат сливают с осадка и очищают от примесей методом гель-хроматографии барбитураты + хлороформ в течение 7 мин хлороформные вытяжки на водяной бане при 70 °С отгоняют и выпаривают досуха. Очистка полученного извлечения. Метод экстракции. Основан на способности фенобарбитала практически не растворяться в органических растворителях в лактимной форме. В лактамной форме он легко переходит в органический слой. Метод заключается в многократной реэкстракции препарата при различных значениях pH из водного в органический слой и наоборот. Колоночная хроматография. Очистка вытяжки из биологического материала проводится с использованием колоночной хроматографии. В методе применяются колонки с окисью алюминия. Колонка – мерная пипетка на 10 мл, обрезанная с конца слива. Сорбент смачивают 1-2 мл растворителя - смесь хлороформа и 25% аммиака. Органический экстракт выпаривают в чашечке. Остаток растворяют в минимальном количестве растворителя – хлороформа - переносят в колонку. Затем колонку промывают для удаления соэкстрактивных веществ 8-10 мл хлороформа с добавлением аммиака. Фенобарбитал вымывают из колонки 4-5 мл 0,1 н щелочи (NaOH). Вытекающий из колонки раствор щелочи собирают, доводят до pH=1-2 раствором соляной кислоты и экстрагируют барбитурат хлороформом. Предварительный этап (ТСХ-скрининг) Исследование в общих системах растворителей НФ – силикагель ПФ - ацетон:хлороформ (1:9) Длина пробега растворителя – 10 см Время насыщения камеры парами растворителя – 15 – 20 мин Д: • дифенилкарбазоном (ДФК) – 0,1% раствор в хлороформе и раствором сульфата ртути – 5% раствор в концентрированной серной кислоте. Исследуемое соединение оказывается во второй хроматографической зоне (барбитураты): Rf=0,31 – 0,41 Непроявленный слой сорбента с анализируемым веществом элюируют ацетоном. исследование в частных системах растворителей НФ – силикагель КСК, забуференный 0,1н раствором борной кислоты. ПФ – хлороформ:н-бутанол:25% раствор аммиака (70:40:5) Время насыщения камеры парами растворителя – 10 мин Высота поднятия фронта растворителя – 10 см Д: • дифенилкарбазоном (ДФК) – 0,1% раствор в хлороформе и раствором сульфата ртути – 5% раствор в концентрированной серной кислоте. Исследуемое соединение оказывается во второй хроматографической зоне (барбитураты): Rf фенобарбитала = 0,4 Характеристикой каждого вещества при (ТСХ) служит значение Rf : Длина пробега вещества от старта Rf = Длина пробега растворителя от старта Сравниваются значения Rf соединения, находящегося в образце, со значением Rf вещества сравнения. Проведение гомогенного ИФА мочи. Используют следующий набор диагностикума: Реагенты: 1. Реакционная виала, содержащая: антитело на фенобарбитал кофермент НАД конъюгат (фенобарбитал, меченный глюкозо-6-фосфатдегидрогеназой) хромогенное вещество буфер консервант Негативный контроль (холостой образец – моча человека, в которой заведомо нет фенобарбитала, с консервантом – азидом натрия) Позитивный контроль. Контрольный образец, содержащий 1 мкг/мл фенобарбитала, лиофилизированную мочу человека и азид натрия Калибратор. Контрольный образец, содержащий фенобарбитал в концентрации 0,5 мкг/мл. Проведение анализа. 1 Отбор и хранение биообразцов. Образцы мочи отбирают в пластиковые или стеклянные контейнеры. 2. Анализ. приготовление калибратора и контролей контроль температуры – 22 – 25С включение спектрофотометра мочу помещают в виалу, виалу – в держатель и проводят СФ. 3. Интерпретация результатов Цветные реакции + изопропиламин и соли Co (р-в Пари) -> фиолетовое + соли Co и щелочь -> розовое + мурексидная проба -> розовое + родамин -> оранжевое (слой в хлороформе) + пиридин и соли Cu -> аморфный осадок УФ – спектроскопия Вытяжка из биоматериала -> упаривание -> сухой остаток + вода + NH4OH -> спектр при 240нм (фенобарбитал, барбитал) + H2SO4 -> спектр не должно быть максимума 290нм – для тиобарбитуратов + NaOH -> спектр при 240нм (фенобарбитал, барбитал) 305нм – для тиобарбитуратов Количественное определение ГЖХ-анализ Условия газохроматографического анализа Газовый хроматограф с термоаэрозольным детектором (ТАД) или с беспламенным азотно-фосфорным детектором (NPD). Колонка стеклянная, силанизированная, длиной 1 м, внутренний диаметр 2 - 3 мм. Сорбент - 3%-ный SE-30 на хромосорбе W (HP)- 80 - 100 меш. Скорость газа-носителя - 45 мл/ мин азота для ТАД и 40 мл/мин гелия для NPD. Температура детектора 300ºС. Температура испарителя 250ºС. Температура термостата колонки изменяется по линейной программе от 130 до 290ºС со скоростью 20ºС в минуту. Выдерживание при конечной температуре занимает до 15 минут общего анализа. Объем вводимой пробы - 2,5 мкл. Подготовка пробы: 0,2 мл плазмы/мочи + 1,3 мл воды и ацетатного буфера + смесь этилацетат/диэтиловый эфир встряхивание 5 минут центрифугирование отделение органики упаривание + ТМАГ метилирование барбитуратов |
