ХИИИИИИИИМИИИИЯЯЯЯЯ. Тема 1 химия как наука и её значение в жизни человека
 Скачать 1.07 Mb. Скачать 1.07 Mb.
|
ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВХарактерным химическим свойством металлов является их восстановительная способность. Они вступают в реакцию как с простыми веществами – неметаллами, так и со сложными веществами – водой, кислотой, щелочами и другими веществами. Взаимодействие металлов с кислотами ДЕЙСТВИЕ ХЛОРОВОДОРОДНОЙ КИСЛОТЫ НА МЕТАЛЛЫ ДЕЙСТВИЕ СЕРНОЙ КИСЛОТЫ НА МЕТАЛЛЫ ДЕЙСТВИЕ АЗОТНОЙ КИСЛОТЫ НА МЕТАЛЛЫ ДЕЙСТВИЕ ЩЕЛОЧЕЙ НА МЕТАЛЛЫ ДЕЙСТВИЕ ХЛОРОВОДОРОДНОЙ КИСЛОТЫ НА МЕТАЛЛЫМеталл взаимодействует с хлороводородной кислотой, если энергия его ионизации меньше энергии ионизации водорода, а таковыми являются активные металлы, стоящие в ряду напряжений до водорода. При растворении в хлороводородной кислоте активных металлов образуется соль этого металла (хлорид) и выделяется водород. В этом случае в качестве окислителя выступает ион водорода (Н+) кислоты, который оттягивает электрон от атома восстановителя (металла).  Можно рассчитать ЭДС этой реакции. ЭДС = Еокис-ля – Евос-ля = 0 – (-0,76) = 0,76 В. Потенциалы находятся в ряду напряжений металлов. в начало ДЕЙСТВИЕ СЕРНОЙ КИСЛОТЫ НА МЕТАЛЛЫРазбавленная серная кислота растворяет только активные металлы, т.е. реакции идут аналогично реакциям с хлороводородной кислотой. В результате реакции образуется соль металла (сульфат) и выделяется водород.
1 2 Fe0 - 2ē → Fe+2 процесс окисления Fe0 - восстановитель 1 2 2H+ + 2ē → H20 процесс восстановления Н+ - окислитель Fe + 2H+ → Fe2+ + H2 ЭДС = 0 – (-0,44) = 0,44 В Концентрированная серная кислотарастворяет металлы, стоящие в ряду напряжений металлов до серебра (включительно). Не растворяется золото и платиновые элементы (Рt, Os, Ru, Ir, Rh, Pd). 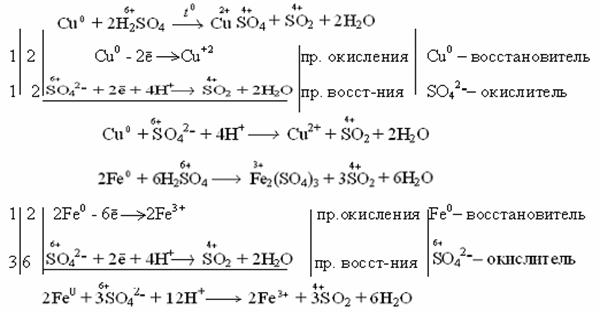 Окислителем в этом случае является сера со степенью окисления +6, которая в зависимости от активности металла и от условий (концентрация кислоты, температура) может восстанавливаться до серы +4, +0, -2. Таким образом, продуктами восстановления серы серной кислоты могут быть Например: неактивные и малоактивные металлы (Cu, Ag, Fe, Ni) восстанавливают серу +6 до серы +4 (SO2). Реакция идет при нагревании. Как видно из реакций, разбавленная серная кислота окисляет железо до +2, а концентрированная до +3. Более активные металлы восстанавливают серу +6 до свободной серы (S0) и сероводородной кислоты (H2S), где сера имеет степень окисления -2. 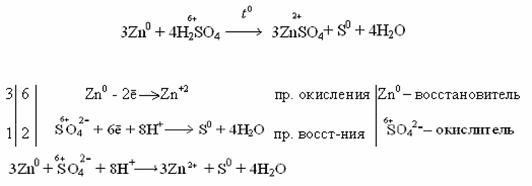 в начало | ||||
