ХИИИИИИИИМИИИИЯЯЯЯЯ. Тема 1 химия как наука и её значение в жизни человека
 Скачать 1.07 Mb. Скачать 1.07 Mb.
|
ДЕЙСТВИЕ ЩЕЛОЧЕЙ НА МЕТАЛЛЫЩелочи действуют только на металлы, образующие амфотерные оксиды и гидроксиды. При этом выделяется водород и образуется соль очень слабой кислоты данного металла. Следует отметить, что образование водорода является результатом взаимодействия атомов металла с ионами водорода воды, а не водорода, входящего в состав щелочи. Таким образом, реакция идет в две стадии: 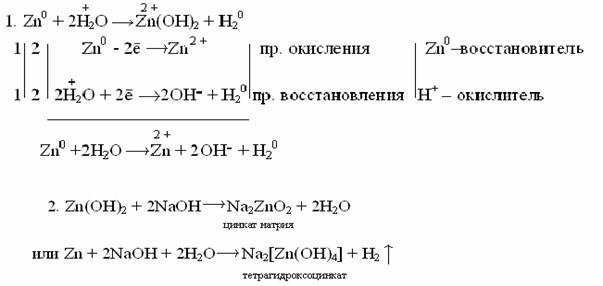 в начало Тема 14: ХИМИЯ МЕТАЛЛОВ И ЭЛЕКТРОТЕХНИЧЕСКИЕ МАТЕРИАЛЫ СПОСОБЫ ПОЛУЧЕНИЯ МЕТАЛЛОВЕсли при ионизации идет выделение тепла () – такой металл не встречается в природе в свободном состоянии, а встречается в виде соединений. Например: К0 → К++282,15 кДж (=-282,15 кДж); Mg0→ Mg2++126,25 кДж (=-126,25 кДж); Если при ионизации идет поглощение тепла, то для металла характерно металлическое состояние и он встречается в свободном виде и называется благородным, например Сu0→ Cu2+-33,6 кДж (=33,6 кДж/моль); Pt =127,68 кДж/моль; Au =129,78 кДж/моль. Степень благородства определяется количеством поглощённого тепла (чем больше , тем благороднее металл). Получение металлов В природе большинство металлов входят в состав руд в виде оксидов и солей (сульфидов, карбонатов, хлоридов, фосфатов, сульфатов, силикатов). Менее активные металлы (платина, золото, медь) встречаются в самородном виде. Получение металлов из руд – задача металлургии. Для восстановления металлов из их соединений используются различные процессы: пирометаллургические, гидрометаллургические, электрометаллургические. Пирометаллургия основана на восстановлении металлов из безводных соединений при высоких температурах. В качестве восстановителей используют С (кокс), СО, Н2, металлы – Аl (алюминотермия), Мg (магнийтермия): а) восстановление из оксидов металлов: Cu2O + C2Cu+CO↑; 3Fe2O3 + CO2Fe3O4 + CO2↑; Fe3O4 + CO3FeO + CO2↑; FeO + COFe + CO2↑. б) восстановление из сульфидов: 2ZnS + 3O22ZnO + 2SO2 (обжиг); ZnO + CZn + СО↑; в) восстановление металлами (металлотермия). Когда применяется алюминий, то процесс называется алюминотермия: Fe2O3+ 2Al → Al2O + 2Fe + Q. В техники смесь порошков Fe2O3и Al называют термитной. Реакция идет с выделением тепла (экзотермичная), значит, может проходить самопроизвольно. Термитную смесь применяют для сварки рельсов. Для этого смесь засыпают в специальный сосуд, укрепленный на стыке рельсов, зажигают ирасплавленное железа соединяет концы рельсов. Гидрометаллургия.Металлы извлекают из руд с помощью водных растворов различных реагентов (кислот, щелочей, или солей). Затем происходит восстановление металла из раствора его соли путем электролиза. Так, если в руде есть оксид меди (II), то после обработки руды серной кислотой получают сульфат меди: CuO + H2SO4 → CuSO4 + H2O. Затем раствор сульфата меди подвергают электролизу и получают медь. Электрометаллургия.Восстановление металла происходит при электролизе на катоде. Электролизом водных растворов могут быть получены лишь сравнительно малоактивные металлы. Активные же металлы, такие как щелочные, щелочноземельные, алюминий, получают исключительно электролизом расплавов их солей по схеме: 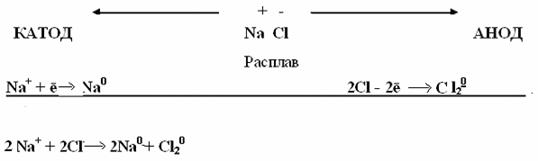 Тема 14: ХИМИЯ МЕТАЛЛОВ И ЭЛЕКТРОТЕХНИЧЕСКИЕ МАТЕРИАЛЫ ЗОННАЯ ТЕОРИЯ ВНУТРЕННЕГО СТРОЕНИЯ МЕТАЛЛОВЭлектропроводимость объясняется двумя теориями металлического состояния. I. Теорияэлектронного газа. Основные положения теории: 1. В узлах кристаллической решетки находится ионы, образующие плотную упаковку и окруженные электронами: Ag Ag+ + ē 2. Электроны в металле не закреплены за отдельными атомами, а свободно перемещаются по всему объему металла, образуя «электронный газ». 3. Все электроны «электронного газа» являются переносчиками тепла и электричества. II. Зоннаятеория кристаллов. Эта теория объясняет электропроводимость на основе квантовой теории строения кристаллических тел. Химическая связь в металле описывается с позиции ММО. В процессе образования кристалла происходит перекрывание внешних электронных облаков атомов по аналогии с образованием химической связи в молекулах. Согласно ММО при сближении двух атомных электронных орбиталей идет расщепление энергии АО на орбиталь с более высоким уровнем энергии (МО – разрыхляющая) и орбиталь с более низким уровнем энергии (МО – связывающая). При последовательном увеличение числа взаимодействующих атомов увеличивается число МО. Если в кристалле число атомов будет равно N = 1023 , то из МО будет образована целая энергетическая зона, у которой разность между энергиями соседних орбиталей будет ничтожно мала. Например: В кристалле натрия разность энергий двух соседних орбиталей равна 10-28 кДж. Таким образом, образуется почти сплошная энергетическая зона. 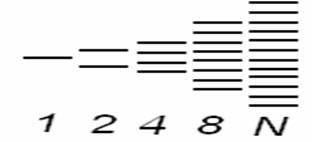 Выводы: 1. Энергетическая зона состоит из очень близко расположенных МО. Она создается за счет орбиталей внешнего энергетического уровня и заполняется электронами этого уровня. 2. Разность энергии самой «нижней» и самой «высокой» МО равна ∆Е/N (N = 6,02 ∙ 1023), т.е. она очень мала и электроны легко переходят с одной МО на другую МО (при затрате минимальной энергии). Электроны двигаясь в объеме металла, являются переносчиками электричества и тепла. 3. Заполнение МО идет в порядке возрастания энергии и в соответствии с принципом Паули – на каждой МО размещается по два электрона с ↑↓. Тема 14: ХИМИЯ МЕТАЛЛОВ И ЭЛЕКТРОТЕХНИЧЕСКИЕ МАТЕРИАЛЫ ЭЛЕКТРОТЕХНИЧЕСКИЕ МАТЕРИАЛЫ.По электрическим свойствам материалы делятся на проводники, диэлектрики, полупроводники и сверхпроводники. Они отличаются друг от друга по механизму проводимости, по величине удельного сопротивления и другими свойствами. Зонная структура металла (проводника). Совокупность уровней занятых валентными электронами называются валентной зонной. Уровни, оставшиеся незаполненными, составляют зонупроводимости в металлах. Эти зоны в металле перекрываются. Электроны с валентной зоны, под действием приложенной разности напряжений переходят в зону проводимости и обуславливает электропроводимость металла. Например, у натрия перекрываются 3s и 3р орбитали (3s1 – валентная зона, занята на 1/2 валентными электронами, 3р – зона проводимости пустая). Зонная структура диэлектрика (изоляторы). В отличие от металлов кристаллы неметаллов обычно не обладают электропроводностью. Они представляют собой диэлектрики (изоляторы). В этих кристаллах между энергетическими зонами – валентной и зоной проводимости возникает область запрещенных энергий, называемая запрещеннойзоной с энергетическим промежутком ∆Е > 4эВ. Энергия электрического поля или теплового движения оказывается недостаточной для преодоления этого энергетического промежутка и электрон не переходит из валентной зоны в зону проводимости, т.е. электроны не могут свободно передвигаться по кристаллу и служить переносчиками электрического тока. Например, ∆Еалмаза = 5,4эВ, ∆Екварца = 5,2эВ. Зонная структура полупроводника. Если ширина запрещенной зоны относительно невелика (в приделах 0,1-4эВ), то при сообщении твердому телу определенного количества энергии (тепло, освещение, облучение, усиление тока), часть его электронов может перейти из полностью заполненной валентной зоны в зону проводимости и принять участие в переносе тока. Такие вещества называются полупроводниками.Например, у собственных полупроводников Ge ∆Е = 0,75эВ, Si ∆Е = 1,21эВ (собственные полупроводники – проводимость обусловлена ионизацией атомов чистого вещества). Особенность собственных полупроводников состоит в том, что при переходе части электронов в зону проводимости в валентной зоне проявляется эквивалентная количество положительных ионов или «дырок», которые так же участвуют в переносе тока. То есть проводимость в полупроводниках может осуществляться как электронами зоны проводимости (n – проводимость), так и «дырками» валентной зоны (р – проводимость). Электроны движутся в зоне проводимости, как это происходит в металле, а «дырки» движутся в валентной зоне (от + к -) в направлении противоположном движению электронов, т.е. собственные полупроводники имеют электронно-дырочную проводимость.
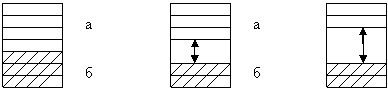 Схема расположения энергетических зон в проводнике, полупроводнике, изоляторе. а – зона проводимости; б – валентная зона. Наряду с собственными полупроводниками большое значение имеют также полупроводники примесноготипа. В них основное количество переносчиков тока – электронов или дырок – поставляют введенные в собственные полупроводники специальные добавки (примеси), энергетические уровни которых располагаются между валентной зоной и зоной проводимости полупроводника. В примесных полупроводниках путем соответствующего подбора добавок можно искусственно создать электронный или дырчатый механизм проводимости. В соответствии с этим добавки подразделяются на две категории: электронно-донорныеиэлектронно-акцепторные. Полупроводники сдонорнойпримесью обладают электронной n – проводимостью, т.к. примеси дают электроны в зону проводимости (примеси – доноры электронов). Например,добавка к Ge…….4s24p2 (IVгр) атомов Р, As, Sb (из V группы) с электронной конфигурацией наружного уровня …..s2 p3 (имеет на наружном уровне на один электрон больше) будет являться донором электронов. Так из пяти электронов наружного уровня – четыре электрона идут на связь с соседними атомами в кристаллической решетке Ge, а пятый электрон становится как бы лишнем, т.к. оказывается вне сферы действия ковалентных связей. Достаточно лишь незначительная затрата энергии (порядка 0,01эВ), чтобы этот электрон перешел из валентной зоны в зону проводимости. Акцепторные примеси сообщают полупроводнику дырочную проводимость. Например, к тому же Ge…4s24p2 (полупроводник) добавляют атомы элементов III группы Al, Ga, Zn с электронной наружной конфигурацией ….. s2 p1 , т.е на наружном уровне на один электрон меньше. Примеси на наружном уровне имеют три валентные электрона и входя в состав кристаллической решетки Ge, атомы этих примесей стремятся захватить недостающий ему четвертый электрон у соседнего атома Ge , у которого возникает на этом месте «дырка» (электрон переходит на уровни зоны примесей), т.е. полупроводник имеет р - проводимость. Изизложенногоможносделатьвывод: донорными являются все примеси, атомы которых содержат больше валентных электронов, чем атомы основного вещества, а акцепторными – это примеси, атомы которых содержат меньше валентных электронов, чем атомы основного вещества. Чтоб представить себе размер добавок, необходимых для изготовления полупроводника приведем пример: если на 100 млн. атомов Ge ввести 1 атом As, то Ge приобретет характер n- проводника. Введение такого же количества атомов В переводит Ge в полупроводник р- типа, в весовых соотношениях это составляет: на 700m Ge – 1г В (бора). СВЕРХПРОВОДНИКИ Материалы, у которых электрическое сопротивление при некоторой критической температуре резко падаетпрактически до нуля, становятсясверхпроводникамипри данной температуре. Впервые сверхпроводимость была открыта в 1911г. Камерлинг – Оннесом у ртути. Критическая температура перехода ее в сверхпроводящее состояние (Тс) равна 4,2 K0. Такой температуры можно добиться при использовании жидкого гелия, кипение которого также равно 4,2 K0. Однако это очень низкая температура, ее достижение связано с большими энергетическими и экономическими затратами. Это так называемоенизкотемпературнаясверхпроводимость. Сверхпроводимость обнаружена у 30 элементов и около тысячи сплавов. Из простых веществ самую высокую критичную температуру перехода в сверхпроводящее состояние имеет ниобий (Тс = 9,17 K0). Сплавы ниобия Nb– Tl – Zr (Тс = 9,7 K0) нашли применение для обмоток мощных генераторов, магнитов больших мощностей для поездов на магнитной подушке, туннельных диодов и др. Более высокое значение Тс имеют сплавы Nb3 Ge (23 K0) и оксидная система (керамика) состава La – Ba – Cu – O (35 K0). Такие температуры могут быть достигнуты в среде жидкоговодорода, температура кипения которого 20,3 K0. Это область среднетемпературной сверхпроводимости. Если же вещество переходит в сверхпроводящие состояние выше температуры кипенияазота, то такие сверхпроводники называютсявысокотемпературнымсверхпроводниками. При температуре жидкого азота такие свойства проявляют вещества следующего состава: Bi – Ca – Sr –Cu – O (Тс = 110К), Hg – Ba – Ca – Cu – O (Тс = 135 K0) и др. Ведутся поиски новых систем, которые могли бы находится в сверхпроводящим состоянии при температуре кипения СО2 (194,7 K0), относящиесяк горячим сверхпроводникам. Однако механизм высокотемпературной сверхпроводимости пока не выяснен. |
