ХИИИИИИИИМИИИИЯЯЯЯЯ. Тема 1 химия как наука и её значение в жизни человека
 Скачать 1.07 Mb. Скачать 1.07 Mb.
|
|
Тема 1:ХИМИЯ КАК НАУКА И ЕЁ ЗНАЧЕНИЕ В ЖИЗНИ ЧЕЛОВЕКА 1.Понятие о материи и движении. Химическая форма движения материи. 2.Химия и экология. Весь окружающий нас многообразный мир, все существующее вокруг нас – это материя, которая проявляется в двух формах: вещества и поля. Вещество – состоит из частиц, имеющих собственную массу (массу покоя). Например: это атомы, молекулы, ионы. Поле– это такая форма существования материи, которая, прежде всего, характеризуется энергией. Посредством поля осуществляется взаимодействие между частицами вещества. Например: это электромагнитные и гравитационные поля. Неотъемлемым свойством материи является движение. Материя находится в непрерывном движении, и она неразрывно с ним связана. Формы движения материи изучаются разными естественными науками: физикой, химией, биологией и другими. Формы движения материи могут переходить друг в друга: химическая форма движения может переходить в электрическую, а электрическая – в тепловую и т.д., по строго эквивалентным соотношениям: 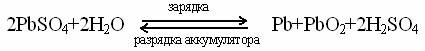 При зарядке аккумулятора электрическая энергия превращается в химическую, а при разрядке – наоборот: химическая – в электрическую. Мерой движения материи, количественной её характеристикой служит энергия, а мерой инерции материи является масса, поэтому энергия и масса – важнейшие взаимосвязанные свойства материи. Химия изучает химическую форму движения материи, под которой понимают качественные изменения веществ, т.е. превращение одних веществ в другие. Таким образом, химия – наука о веществах и законах их превращений. Химическая форма движения материи проявляется при химических реакциях. При химических процессах происходит обмен атомами между различными веществами, перераспределение электронов между атомами, разрушение одних соединений и образование других. Современная химия включает: общую химию, неорганическую, органическую, физическую, аналитическую химию, электрохимию, биохимию и т.д. Мы изучаем общую химию, которая изучает наиболее общие ее законы и положения, включая периодический закон, состав и строение атомов, теорию химической связи, основные закономерности химических процессов, учение о растворах, электрохимию и др. Значение химии в народном хозяйстве. Химия – одна из наук, играющих важную роль в жизни каждого человека и общества в целом. Нет ни одной отрасли производства несвязанной с химией. Подвергая природные материалы химической переработке, получают разнообразные вещества необходимые для быта, промышленности и с.-х. Это предметы домашнего обихода, лекарства, металлы, удобрения, краски, пластмассы и др. Для химической переработки природного сырья необходимо знать законы химии о превращении веществ, а эти знания дает химия. Химия позволяет синтезировать материалы, которых нет в природе. Это всем известные полимерные материалы, без которых современная жизнь невозможна. Все значения химии в жизни человека можно выразить следующим образом: «Что бы случилось, лишись человечество всего, что дает химия? Трудно представить себе все катастрофические последствия этого предположения: рухнут все сооружения, т.к. исчезнут все материалы и вяжущие вещества; из-за отсутствия смазок остановятся станки; без топлива остановится транспорт; все вокруг покрывается серой, грязной пленкой; нет красителей, лаков, эмалей; из нашего обихода исчезнут сотни предметов, к которым мы давно привыкли» (из химического журнала). в начало Химия и экология. В результате деятельности человека в окружающую среду попадает большое количество вредных веществ. Отходы химической промышленности загрязняют воздух, почву, воду. К настоящему времени в окружающую среду выброшено – 3 млн новых химических соединений, к которым природа не приспособлена. Эти выбросы как заводов химической и металлургической промышленности, так и электростанций, транспорта, промышленных и с.-х. предприятий. Водный бассейн.Океаны, реки и внутренние водоемы загрязняются промышленными и бытовыми сточными водами, которые могут содержатьHg, Pb, Cd, As, Be, Te, остатки пестицидов, горюче-смазочные материалы и др. вещества. Поэтому сточные воды могут быть сброшены в водоемы только после механической, химической и биологической очистки. Воздушный бассейн. Воздух загрязняется промышленными и коммунально-бытовыми выбросами. Это пыль, сажа, капли – сернокислого тумана, окислы азота, хлор, фтор и т.д. Надо отметить, что заводы и фабрики выносят из труб чуть ли не больше половины всех химических элементов таблицы Д.И. Менделеева. Загрязняют воздух и автотранспорт, и самолеты, и ракеты. Выхлопные газы содержат СО и оксиды азота. Происходит также радиоактивное заражение воздуха. Для охраны воздушного бассейна применяют пыле- и золоуловители, фильтры и адсорбенты, через которые должен пройти выброшенный воздух. Загрязнения водного и воздушного бассейнов попадают в почву, впитываются растениями и попадают с водой и пищей человеку. В настоящее время имеются нормы допустимых концентраций вредных веществ в воде, воздухе, почве, и есть специальная экологическая служба. Надо стремиться к тому, чтоб отходы производства были минимальны, то есть приближаться к безотходному производству. А если есть отходы производства, то они должны использоваться самим производством, то есть стремиться к замкнутому его циклу. в начало Тема 2: ПЕРИОДИЧЕСКИЙ ЗАКОН И ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ Д.И. МЕНДЕЛЕЕВА 1.Открытие периодического закона Д.И. Менделеева. 2.Конструкция периодической системы (период, группа, подгруппа). Открытие периодического закона Д.И. Менделеева Днем открытия периодического закона Д.И. Менделеева считается 1 марта 1869г, хотя путь к этому открытию лежал через долгие годы. Теперь имя Менделеева навечно вошло в список имен величайших ученых мира, а его открытие стало основой современной химии. В основу классификации химических элементов Д.И. Менделеев положил два основных свойства, известные в то время: 1) атомная масса; 2) химические свойства. Работа по систематике известных элементов (известно их было тогда 63) состояла в том, что Д.И. Менделеев располагал элементы по увеличению их атомных масс с учетом их коренных свойств. Он обнаружил, что элементы сходные в химическом отношении встречаются через определенные интервалы и что, таким образом, в ряду элементов многие их свойства периодически повторяются. Была установлена зависимость свойств элементов от атомных масс. Эта закономерность получила свое выражение в периодическом законе: свойства простых тел, а так же формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов (масс) элементов. Закон является новым мощным инструментом в изучении элементов. Он дал возможность заранее определить свойства еще не открытых элементов. Так им были описаны свойства неизвестных в то время элементов под № 21, 31, 32 (он оставил пустые клетки). При жизни Д.И. Менделеева эти три элемента были открыты: в 1875г. открыт 31 Ga (Лекок де Буабодран), 1879 г. – 21Sc (Нильсон и Клеве), 1886 г. – 32Ge (Винклер) и помещены в периодическую систему. Эти три элемента Д.И. Менделеев назвал «укрепителями» периодического закона. Он писал: «Периодическому закону будущее не грозит разрушением, а обещаются только дальнейшая надстройка и развитие». Располагая элементы по возрастанию атомной массы, Д.И. Менделеев в трёх случаях отказался от этого принципа. Так 18Ar(А=39,948) стоит до 19K(A=39,098); 27Со(А=58,933) находится до 28Ni(A=58,70); 52Te(127,60) до53I(A=126,904). Таким образом, он не придавал исключительного значения атомной массе, а устанавливал место элемента в таблице, учитывая всю совокупность свойств элементов. Развитие теории строения атома показало, что размещение элементов Д.И. Менделеевым в периодической системе совершенно правильное и соответствует строению атомов. В настоящее время открыто 114 элементов. Есть ли границы периодической системы? Наука отвечает: не может быть резко очерченных границ – ни начала, ни конца периодической системы. Так, в 1953 г. был открыт позитроний (Ps), масса которого почти в 1000 раз меньше атома водорода. Он открывает менделеевскую систему элементов. Позитроний можно представить в виде электрона и позитрона. Позитрон – частица, по массе близкая к электрону, но имеющая положительный заряд. Позитроний (Ps) – движущийся вокруг общего центра тяжести электрон и позитрон. Позитроний состоит из электронно-позитронной оболочки и не имеет ядра, но имеет короткое время жизни: около 10-7 – 10-10 сек. и исчезает с испусканием фотонов. Позитроний открывает периодическую систему элементов, он является сильным восстановителем и может участвовать в химических реакциях, как восстановитель. Например он восстанавливает ионы: Fe3+ до Fe2+ Открытие позитрония поставило вопрос о существовании совершенно иного материального мира, построенного из антиатомов. Действительно, позитроний находится на границе между атомами – состоящими из положительно заряженного ядра и отрицательно заряженных электронов, иантиатомами – системами из отрицательно заряженных ядер и положительно заряженных позитронов: 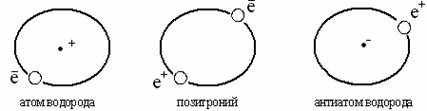 Антиатомы существуют, некоторые из них (антиатомы водорода, гелия) изучены экспериментально. Поэтому нельзя говорить о начале периодической системы, т.к. таблица относительно позитрония может повторить в мире антиатомов структуру периодической системы Д.И. Менделеева. Происходит развитие системы химических элементов в области тяжелых элементов: уже открыт 114 элемент. Возможно, возникнут новые закономерности, дополняющие (но не нарушающие) закон Д.И. Менделеева. Естественный конец периодической системы определяется порядковым номером элемента, для которого среднее время жизни атомного ядра становится меньше 1*10-15сек. Для элементов с порядковыми номерами 108-114 это время около 1*10-12сек. Развитие теории атомных ядер позволило считать, что при больших порядковых номерах могут существовать так называемые «острова стабильности», т.е. отдельные атомы с большим временем жизни. в начало Конструкция периодической системы (период, группа, подгруппа). Выражением периодического закона является периодическая система химических элементов. Периодическая система – графическое изображение периодического закона. В 1869 г. Менделеев дал набросок таблицы – длинную форму, а в 1870 г. он предложил короткую форму. В современный вариант короткой формы внесены некоторые существенные изменения (благородные газы перенесены из нулевой группы в восьмую группу). В настоящее время известно несколько сот вариантов периодической системы элементов (более 400) и все они в своей основе содержат предложенный Менделеевым принцип построения. Периодическая система состоит из 7 периодов и 8 групп. Период– горизонтальный ряд элементов, расположенных в порядке возрастания заряда ядра атомов, начинающиеся с типичного металла(щелочного), проходящего через амфотерный элемент и заканчивающийся неметаллом(благородные газы). Номер периода показывает число энергетических уровней. Периоды бывают малые и большие. Таблица Большие и малые периоды
Исходя из определения периода можно сделать вывод об изменениях свойств элементов: слева направо свойства элементов изменяются отметаллических через амфотерные к неметаллическим. А следовательно свойства их соединений изменяются от основных через амфотерные к кислотным. Например III период:  Такая закономерность имеется и в больших периодах, но металличность уменьшается значительно медленнее. Группа– вертикальный ряд элементов, расположенных по мере увеличения заряда ядра атомов, и имеющих одинаковую электронную конфигурацию внешнего энергетического уровня, т.е. имеют одинаковое число электронов на внешних подоболочках. Отсюда элементы одной группы имеют одинаковую высшую положительную степень окисления (высшую валентность), равную номеру группы. Таблица
Исключения: у фтора степень окисления – 1( F-1); Cu, Ag, Au проявляют степень окисления +1, +2, +3; элементы VIII группы не дают соединений со степенью окисления +8 (только Os, Ru, Xe дают соединения со степенью окисления+8: OsO4, RuO4, XeO4). Группа – понятие широкое. В одну группу входят элементы с разными химическими свойствами. По химическим свойствам элементы группы делят на подгруппы: главные (А) и побочные(В). Главные подгруппы (А) начинаются во II периоде (элементами Li, Be, B, C, N, O, F) и благородные газы. Побочные подгруппы (В) начинаются в ІV периоде, куда также входят лантаноиды и актиноиды. Изменение химических свойств в главных(А) подгруппах следующее: сверху вниз по группе свойства элементов изменяются от неметаллических через амфотерные к металлическим, а свойства их соединений от основных через амфотерные к кислотным. Например: ІV подгруппа А: 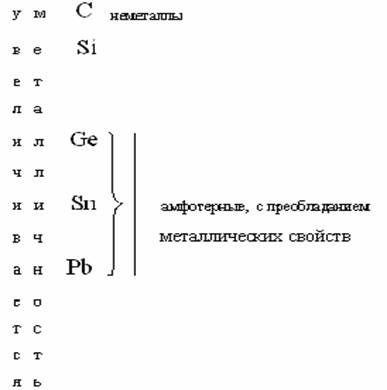 Если в подгруппе А все элементы металлы, то эта закономерность остается, т.е. металличность сверху вниз усиливается. Например, І группа (подгруппа А): 19K более металличен, чем 3Li, а 55Cs металличнее 19K. 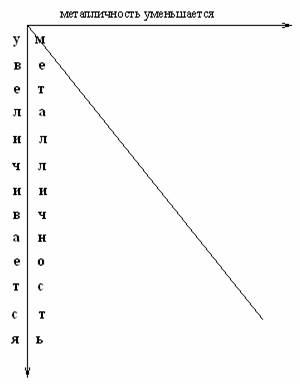 Чтобы учесть изменение химических свойств элементов по периоду и группе нужно периодическую систему разделить диагональю от H до At, и отметить изменение металличности по периоду и по группе. Как видно из схемы, в левом нижнемуглурасполагаются металлы (самый металлич. Fe), а в правом верхнем – неметаллы(самый неметаллический F). Амфотерные элементы занимают промежуточное положение между металлами и неметаллами. Главные вопросы, которые возникли после открытия периодического закона: 1. Причины периодического изменения химических свойств элементов. 2. Причины деления групп на подгруппы. 3. Причины большого сходства лантаноидов и актиноидов. 4. Причина трёх исключений в несоответствии величины атомной массы и положения элемента в периодической системе. На эти вопросы ученые получили ответ после изучения строения атома. в начало | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
