ХИИИИИИИИМИИИИЯЯЯЯЯ. Тема 1 химия как наука и её значение в жизни человека
 Скачать 1.07 Mb. Скачать 1.07 Mb.
|
Применение электролизаВажнейшее применение электролиз находит в металлургической, химической промышленности и в гальванотехнике. В химической промышленности методом электролиза получают различные продукты: фтор, хлор, едкий натр, водород, многие окислители, некоторые органические вещества (например – анилин из нитробензола). К наиболее крупномасштабному электрохимическому процессу в химической промышленности относятся электролиз раствора NaCl с получением газообразного хлора на аноде, водорода на катоде и раствора щелочи в катодном пространстве. В металлургической промышленности электролизом расплавленных соединений и водных растворов получают металлы (Cu, Bi, Sn, Sb ,Pb, Ni, Cd,Zn), а так же производят электрохимическое рафинирование – очистку металлов(Cu, Ag, Au, Pb, Sn и др.) от вредных примесей и извлечение ценных компонентов Анодом при рафинировании служит очищаемый металл. На аноде растворяется основной металл и примеси, потенциал которых отрицательнее потенциала основного металла. Примеси, имеющие более положительный потенциал, не растворяются и выпадают из анода в виде шлама. На катоде в первую очередь выделяется металл, имеющий наиболее положительный потенциал. Например: потенциалы Cu, Ag, Au, Pв, Sn положительнее, чем потенциалы других металлов (примесей), то каждый из этих металлов в первую очередь выделяется на катоде, а примеси остаются в растворе. При малой концентрации примесей их потенциалы в соответствии с уравнением Нернста сдвигаются в сторону отрицательных значений, чтоспособствует преимущественному выделению на катоде основного метала. Электролизом расплавов получают металлы, имеющие очень отрицательныеэлектродные потенциалы. К гальванотехнике относятся гальваностегия и гальванопластика. Процесс гальваностегии представляет собой нанесение путем электролиза на поверхность металлических изделий слоев других металлов для предохранения этих изделий от коррозии, для придания их поверхности твердости, а также в декоративных целях. Важнейшими гальванотехническими процессами являются оцинковывание, хромирование, кадмирование, никелирование, меднение и др. Гальванопластикойназываются процессы получения точных металлических копий с рельефных предметов электроосаждением металла. Путемгальванопластинки изготовляют матрицы для прессования различных изделий, матрицы для тиснения кожи и бумаги, печатные радиотехнические схемы, типографские клише. К гальванотехнике относится также другие виды электрохимической обработки поверхности металлов:электрополированиестали, оксидирование алюминия, магния. Последнее представляет собой анодную обработку металла, в ходе которой определенным образом изменяется структура оксидной пленки на его поверхности. Это приводит к повышению коррозионной стойкости металла. Кроме того, металл приобретает при этом красивый внешний вид. в начало Закон Фарадея. Решение задач.С количественной стороны процесс электролиза изучен в 30-х годах ХIХ века выдающимся английским физиком М.Фарадеем, который в результате своих исследований установил следующие законы электролиза: Первый закон. Масса вещества, образовавшегося или растворившегося при электролизе, пропорциональна количеству электричества, прошедшего через электролит, и не зависит от других факторов: m(г)= k ∙Q где k – электрохимический эквивалент; Q – количество электричества; Кл.; m – масса вещества (г). Второй закон. Равные количества электричества выделяют при электролизе на электродах эквивалентные массы различных веществ. Для выделения на электроде одного эквивалента вещества необходимо затратить 96487 Кл. (это число Фарадея). Отсюда ; где mэ – масса эквивалента, г/моль. Из этих двух законов математическое выражение закона Фарадея будет: Q = I ∙ t ; ; ; где I – сила тока (А); t – продолжительность электролиза (сек.) Одним из показателей эффективности использования электроэнергии в процессах электролиза являются выход по току, равный отношению теоретически необходимого количества электричества (по закону Фарадея) к практически затраченному при получении продукта, которое соответствует отношению массы (mпр) полученного вещества к теоретически возможному (mтеор), т.е. . Примеры решения задач по закону Фарадея. Задача № 1.Определите массу цинка, которая выделяется на катоде при электролизе ZnSO4 в течение 1 часа при силе тока 26,8А, если выход цинка по току равен 50%. Решение: согласно закона Фарадея ;  Задача №2. Какая масса КОН образовалась у катода при электролизе раствора K2SO4, если на аноде выделилось 11,2 кислорода (н.у)?
Решение: Находим объем моля эквивалента кислорода (н.у) 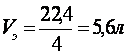 Находим число молей кислорода, выделившегося на аноде: 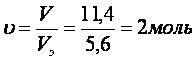 На катоде столько же эквивалентов образуется КОН, т.е. 2 моль. Из формулы: m (КОН) = ν ∙ М = 2 ∙ 56 = 112г. М – молярная масса (г/моль) М(КОН) = 56 г/моль. в начало Тема 14: ХИМИЯ МЕТАЛЛОВ И ЭЛЕКТРОТЕХНИЧЕСКИЕ МАТЕРИАЛЫ | |||||||||||||||||||||||||
