ХИИИИИИИИМИИИИЯЯЯЯЯ. Тема 1 химия как наука и её значение в жизни человека
 Скачать 1.07 Mb. Скачать 1.07 Mb.
|
|
Энергии (Есв) и длины (св) галогеноводородных соединений
Валентный угол-угол между направлениями химической связи в молекулах и твердых телах. Например: H2O (форма молекулы угловая): 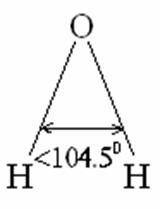 Кратность связи – это двойные и тройные связи. Надо отметить, что при образовании кратных связей между одинаковыми атомами длина связи уменьшается, а энергия связи увеличивается.  Физические причины образования связи между атомами удалось установить, только после того как стали известны законы движения микрочастиц – была создана квантовая механика. В 1927 г. (через два года после опубликования уравнения Шрёдингера) В. Гейтлер и Ф. Лондон решили уравнение Шрёдингера для атома водорода и опубликовали работу, посвященную квантово-механическому расчету образования молекулы водорода. Эта работа положила начало применению квантовой механики для решения химических проблем. Так получила развитие новая область науки – квантовая химия, решающая химические проблемы с помощью квантовой механики. в начало Квантово-механическое объяснение ковалентной связи. Прежде чем перейти к рассмотрению квантово-механического объяснения образования молекулы водорода, рассмотрим зависимость потенциальной энергии молекулы от расстояния между атомами. Эту зависимость можно выразить графически: 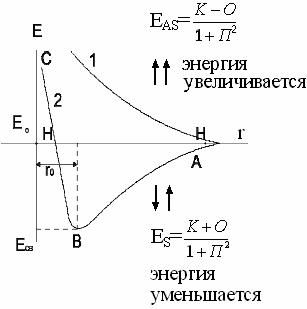 Зависимость энергии системы состоящей из двух атомов водорода от межатомного расстояния. 1 – при одинаково направленных спинах электронов; 2 – при противоположно направленных спинах электронов; E0 – энергия системы из двух невзаимодействующих атомов водорода; R0 – межъядерное расстояние в молекуле водорода; Есв – минимальная энергия системы из двух атомов водорода (энергия связи). Оказалось, что изменение энергии при сближении двух атомов водорода зависит от того, одинаковы или противоположны по знаку спины взаимодействующих электронов. При совпадающем направлении спиныв (кривая 1) сближение атомов приводит к непрерывному возрастанию энергии системы. Такой процесс оказывается энергетически невыгодным и химическая связь между атомами не возникает. При противоположно направленных спинах (кривая 2) сближение атомов до некоторого расстояния r0 сопровождается уменьшением энергии (AB). При r=r0 система обладает наименьшей потенциальной энергией (Есв), т.е. находится в наиболее устойчивом состоянии. Дальнейшее сближение атомов приводит к возрастанию энергии (ВС), что связано с возростанием сил отталкивания, которые велики при малых расстояниях. Следовательноr0-длина связи (межъядерное расстояние), а наименьшая энергия Eсв-энергия связи. В. Гейтлер и Ф. Лондон рассчитали, что r0=0,0869 нм; Eсв=3,14 эВ Критерием правильности расчета является степень совпадения теоретических и экспериментальных данных: Экспериментальные данные: r0=0,0741 нм ; Есв=4,47 эВ. Результаты квантово-механического расчета молекулы H2 по Гейтлеру и Лондону. Молекула H2 состоит из 4-х частиц : двух ядер и двух электронов. Изображаем эту систему: 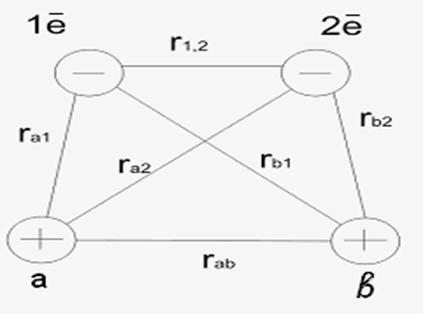 Возможно движение 1ē вокруг своего ядра (а), а 2ē вокруг своего ядра (). А так же возможно движение 1ē вокруг чужого ядра (), а 2ē вокруг ядра (а). Полная энергия системы U будет равна сумме энергией всех взаимодействий в системе между ядрами и электронами, между ядрами (a и ), между электронами (1ē и 2ē). При отталкивании частиц энергия будет увеличиваться (+), а при притяжении уменьшаться (-). U=e2/r; U=e2/rab+e2/r1,2-e2/ra1-e2/rb2-e2/ra2-e2/rb1; e-заряд. Как видно, из уравнения энергия системы уменьшается, т.к. притяжений в этой системе больше, чем отталкиваний. Гейтлер и Лондон исходили из волнового характера движения электронов в атомах. Запишем волновую функцию для изолированных атомов водорода, когда электроны вращаются вокруг своих ядер I) = a1 b2. (I) Запишем , когда электроны вращаются вокруг чужих ядер: II) = a2b1 (II) Они «сконструировали» волновую функцию молекулы H2, являющуюся линейной комбинацией функций и I Общая равна: общ=С1a(1) b(2)+C2a(2)b(1) . C1 и C2 – нормирующие коэффициенты При этом возможно два варианта: 1) С1=С2 (Сs-симметричная волновая функция); 2) С1=-С2 (Cas – антисимметричная волновая функция). I решение: s=Cs[а(1)b(2) +a(2)b(1)] Волновые функции складываются, электронная плотность увеличивается, связь образуется. II решение: as=Cas[а(1) b(2) -a(2)b(1)] Волновые функции вычитаются, электронная плотность уменьшается, связь не образуется. Энергия для молекулы с симметричной волновой функцией Es=(K+O)/(1+П2), для несимметричной Eas=(K-O)/(1+П где: К-кулоновский интеграл, характеризует электростатическое взаимодействие электронов с ядрами, а так же электронов и ядер между собой, имеет положительный знак (+). О-обменный интеграл определяет уменьшение потенциальной энергии молекулярной системы по сравнению с изолированными атомами, имеет отрицательный знак (-). Он вносит основной вклад в энергию системы. П-интеграл перекрывания, показывающий степень перекрывания волновых функций атомов, равен 0,56. Итак, химическая связь образуется в случае s, если спины электронов, образующих электронную пару, антипараллельны в начало Валентность и ковалентная связь с позиций метода валентных связей (МВС). Ковалентная связь – связь, осуществляемая одной общей или несколькими парами электронов с антипараллельными спинами. Для описания ковалентной связи сложных молекул имеются два метода: 1. Метод валентных связей (МВС), в развитии которого заслуга принадлежит Гейтлеру, Лондону, Слейтеру и Полингу. 2. Метод молекулярных орбиталей (ММО) – обязан своему возникновению Малликену и Хунду. В основе метода МВС лежат следующие положения: 1. Единичная химическая связь между двумя атомами образуется двумя электронами с антипараллельными спинами, причем эта электронная пара принадлежит обоим атомам. 2. При образовании связи происходит перекрывание волновых функций между взаимодействующими атомами. Образуется зона с повышенной электронной плотностью, что приводит к уменьшению потенциальной энергии системы. 3. Связь располагается в том направлении, в котором возможность перекрывание волновых функций электронов образующих связь, является максимальной. 4. Ковалентная связь тем прочнее, чем в большей степени перекрываются взаимодействующие электронные облака. Метод валентных связей объясняет валентность элемента и свойстваковалентной связи. Впервые понятие о валентности было введено в химию химиком Э. Франклендом в 1853 г. Он принимал валентность водорода равную единице, а валентности других элементов определялись как число атомов водорода, соединяющегося с одним атомом рассматриваемого элемента. С развитием учения о химической связи изменилось понятие о валентности. Согласно представлениям Гейтлера и Лондона, валентность элемента равна числу неспаренных электронов в атоме. Число неспаренных электронов увеличивается при возбуждении атома: двухэлектронные облака распадаются на одноэлектронные. Распаривание электронов происходит с подуровня на подуровень в пределах уровня. Например: 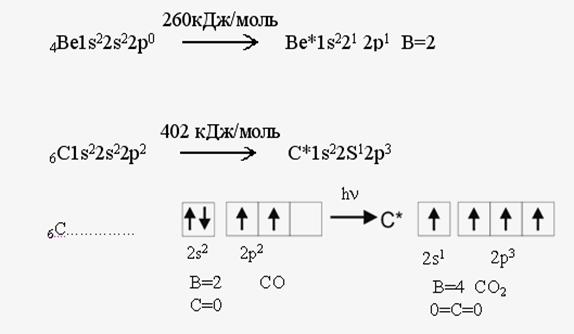 Неспаренные электроны могут образовывать общие электронные пары с другими атомами, т.е. ковалентные связи. В МВС число образуемых атомом ковалентных связей называется ковалентностью или спин- валентностью (по числу неспаренных электронов, предоставляемых атомом для образования связи). Рассмотрим валентные возможности атома серы: 16S 1s22s22p63s23p43d0. 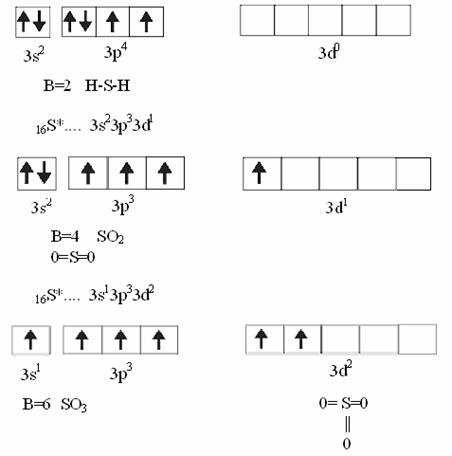 Как видно из примера, в представлении МВС числовое значение валентности соответствует числу ковалентных связей, которые образует атом. Валентность не имеет знака заряда, т.к. не учитывается полярность связи. Способы образования ковалентной связи. Имеется два механизма образования ковалентной связи. 1. Обменный механизм. Каждый атом отдает на образование общей электронной пары (ковалентной связи) по одному неспаренномуэлектрону. Количественной мерой валентности в обменном механизме МВС считают число неспаренных электронов у атомов в основном или возбужденном состоянии атома:  Это неспаренные электроны внешних оболочек у s и p элементов, внешних и предвнешних оболочек у d-элементов, предвнешних ипредпредвнешних оболочек у f-элементов. 2. Донорно-акцепторный механизм. Согласно этому механизму общая электронная пара образуется за счет неподеленной пары электронов одного атома (донора) и свободной орбитали другого атома или иона (акцептора):  Примером донорно-акцепторной связи является образование иона аммония: NH4+: NH3+H+ NH4+; 7N 1S22S22p3. 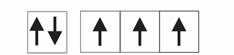 Азот образует три ковалентные связи по обменному механизму за счет трех неспаренных электронов, а неподеленной парой электронов азот образует четвертую связь с ионом водорода. 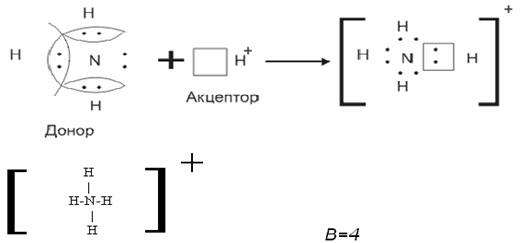 Соединения, в которых хотя бы одна связь донорно-акцепторная, называются комплексными. В природе комплексные соединения встречаются часто: это соли:[Cu(NH3)4]SO4, гемоглобин - комплекс белка с железом, хлорофилл – комплекс белка с магнием и др. Таким образом, суммарная валентность элемента равна числу неспаренных электронов (обменный механизм) и числу электронных пар, способных переходить на свободные орбитали других атомов (донорно-акцепторный механизм) в начало Пространственная структура молекул. В рамках МВС такая перестройка электронной структуры атома рассматривается на основе представления о гибридизации атомных орбиталей(ввел Л. Полинг). Гибридизация атомных электронных орбиталей. При образовании молекулы вместо исходных АО (s,p,d электронных облаков) образуются равноценные «смешанные» или гибридные электронные облака. Например: при гибридизации s-АО и p-АО образуются два гибридных облака, т.е. происходит уравнивание электронных облаков по форме и энергии.  В гибридной АО электронная плотность смещается в одну сторону от ядра, поэтому при взаимодействии ее с АО другого атома происходит максимальное перекрывание, которое приводит к повышению энергии связи (образуется более прочная химическая связь). Деформация АО требует затраты энергии. Но более полное перекрывание электронных облаков за счет гибридных АО приводит к образованию более прочной химической связи и, следовательно, к выигрышу энергии. Если этот выигрыш энергии перекрывает затраты энергии на образование гибридной орбитали, то гибридизация приводит к уменьшению потенциальной энергии системы и образованию молекулы. В случае гибридизации АО соблюдаются следующие правила: 1. Число образующихся гибридных орбиталей всегда равно общему числу исходных АО, участвующих в гибридизации. 2. Гибридизация происходит у орбиталей, имеющих близкие значения энергии. 3. Химические связи, образованные гибридными орбиталями прочнее, т. к. больше площадь перекрывание электронных облаков, а полученная молекула более устойчива. Гибридизация АО определяет пространственную конфигурацию молекул. Различают sp, sp2, sp3 гибридизацию. 1. sp-гибридизация. Примером является гибридизация атома беррилия 4Be 1s22s22p0 hν 4Be * 1s22s12p1 Два неспаренные электрона у возбужденного атома Ве находятся на 2s и 2p орбиталях. В результате гибридизации образуются два гибридных облака, которые могут образовать две ковалентные связи. Рассмотренный случай гибридизации одной s- и одной р-орбитали, приводящей к образованию двух sp орбиталей, называется sp- гибридизацией. 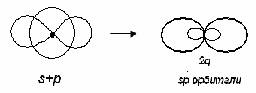 где q – обозначение гибридных орбиталей; sp орбитали ориентированы в противоположных направлениях, что приводит к линейному строению молекулы. Например, молекула BeF 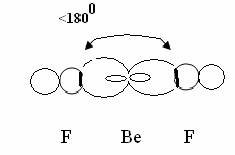 Обе Be-F связи равноценны. 2. sp2 гибридизация. Гибридизация одной s и двух р-орбиталей приводит к образованию трех гибридных sp2 орбиталей. 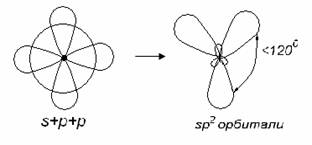 Например, рассмотрим гибридизацию атома бора. Неспаренные электроны у возбужденного атома бора находятся на 2s и двух 2p орбиталях, в результате образуется три гибридные орбитали, расположенные под углом 1200 Молекула ВF3 построена в форме пирамиды (пирамидальная форма).  3. sp3 гибридизация. Если в гибридизации участвуют одна s и три p- орбитали, то имеем sp3 гибридизацию. При этом образуются четыре гибридные орбитали, вытянутых в направлениях к вершине тетраэдра, то есть ориентированных под углом 1090281 друг к другу. Такая гибридизация имеет место в возбужденном атоме углерода при образовании молекулы СН4. 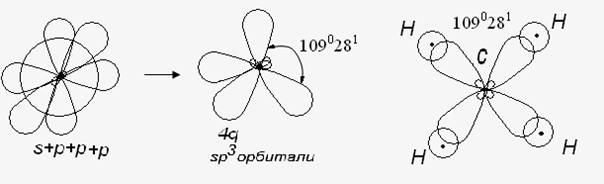 Неспаренные электроны у возбуждённого атома углерода находятся на 2s и трёх 2р – орбиталях – это sр3 гибридизация. СН4 молекула имеет форму тетраэдра, все четыре связи С – Н равноценны. Однако на пространственную конфигурацию молекулы влияют атомные орбитали, имеющие неподеленную пару электронов. Например: молекулаNH3. 7N 1s22s22p3, у азота sp3 – гибридизация атомных орбиталей (азот – центральный атом молекулы NH3).  На трех гибридных орбиталях у атома азота находятся неспаренные электроны, а на четвертой гибридной орбитали находится неподеленнаяэлектронная пара, не принимающая участие в химической связи между атомом азота и атомами водорода. Форма молекулы NH3-тригональная (пирамидальная структура) с валентным углом 107, 30, вместо угла 1090281 характерного для sp3гибридизации. Уменьшение величины угла происходит из-за отталкивающего действия неподелённой пары, занимающую гибридную орбиталь, и не принимающую участие в химической связи. 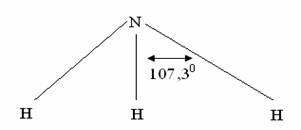 При образовании молекулы Н2О тоже происходит sp3 гибридизация центрального атома молекулы-кислорода. 8О 1S22S22P4 Кислород имеет четыре гибридные орбитали (4q), на двух гибридных орбиталях находятся неспаренные электроны, а на оставшихся двух-неподеленные электронные пары, не принимающие участия в химической связи между атомом кислорода и водородом. Молекула имеет угловую форму с углом 104,50. O
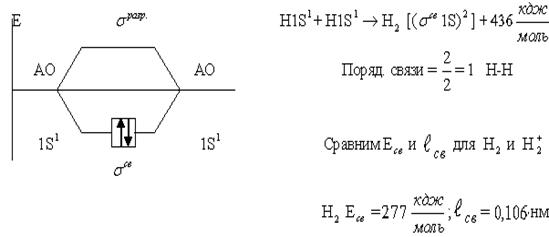
104,5 H H Уменьшение угла (104,50 вместо классического 1090281) происходит из-за отталкивающего действия между двумя неподеленными электронными парами и электронными парами, образующими химические связи. Заканчивая рассмотрение МВС нужно отметить, что метод имеет много достоинств: он относительно прост и нагляден, позволяет предсказать такие свойства многих молекул как: пространственная конфигурация, полярность, энергия и длина связей и др. Однако в ряде случаев МВС не может объяснить природу, образующихся химических связей или свойства молекул. Недостатки МВС. 1. МВС учитывает только валентные электроны и в образовании связи участвует пара электронов с . 2. МВС не может объяснить наличие свободных радикалов –ОН, –СН3 и др. 3. МВС не может объяснить одноэлектронную химическую связь в соединениях H2+, Hе2+, O2-. 4. Не объясняет парамагнетизм О2: магнитные свойства у О2 указывают на то, что в молекуле О2 имеются два неспаренных электрона, а сог-ласноМВС у О2 все электроны спаренные. Эти факты объясняются другим методом – методом молекулярных орбиталей (ММО), разработанный Р. Малликеном, Ленардо-Джонсоном,Хундом(1927-29гг). Метод молекулярных орбиталей (ММО). Основная идея ММО – из АО образуются молекулярные орбитали, то есть электроны с АО переходят на МО. В отличии от АО молекулярныеорбитали охватывают не один атом, а всю молекулу, то есть являются двух или многоцентровыми. Наиболее широко в ММО используется линейная комбинация АО, таким образом можно сказать МО – линейные комбинации атомных орбиталей(МО-ЛКАО). При этом соблюдается несколько правил: 1. Число МО равно общему числу АО, из которых комбинируются МО. 2. Энергия одних МО оказывается выше, других – ниже энергии исходных АО, то есть происходит расщепление энергии АО. Средняя энергия МО, полученных из набора АО, приблизительно совпадает со средней энергией этих АО. 3. Электроны заполняют МО, как и АО, в порядке возрастания энергии, при этом соблюдается принцип запрета Паули и правило Хунда. 4. Наиболее эффективно комбинируются АО с теми АО, которые характеризуются сопоставимыми энергиями и соответствующей симметрией. 5. Как и в методе ВС, прочность связи в методе МО тем прочнее, чем выше степень перекрытия АО. Основная проблема МО – нахождение , описывающей состояние электрона на МО. Например, разберем расчет на примере молекулярного Н. Молекулярный ион состоит из двух ядер и одного электрона. 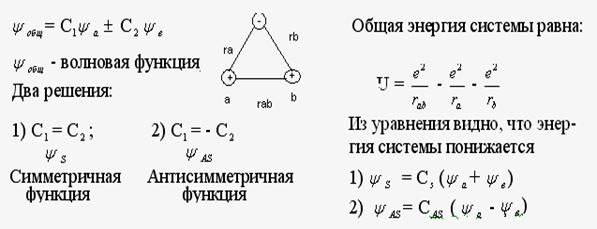 Связь образуется тогда, когда в случае симметричной волновой функции образуется МО – связывающая. Связь не образуется тогда, когда в случае антисимметричной волновой функции образуется МО разрыхляющая,. МО – с меньшей энергией, чем исходные АО. МО – с большей энергией, чем исходные АО. АО обозначают через s, p, d, f; МО обозначают типом перекрытия АО (). Рассмотрим образование Н:  В данном случае пор. связи = = 0,5 – молекулярный ион образуется. Этот пример образования Н доказывает, что химическая связь образуется одним электроном. Образование Н:
 Увеличение и уменьшение Е у Н по сравнению с Н обус-ловлено уменьшением порядка связи с 1 до 0,5. Молекула Н прочнее, чем молекулярный ион Н. ММО объясняет существование дигелий иона Не.  Возможно ли образование молекулы Не?  Рассмотрим порядок заполнения энергетических уровней у элементов второго периода. МО образуются из 1s, 2s и 2р АО 2px 2p 2s 2py 2s 2pz Молекулярные орбитали двухатомных молекул элементов второго периода по возрастанию энергии располагается в ряд: σ1s<σ1s<σ2s<σ2s<σ2p<π2p= π2p<π2p= π2p<σ2p. Используя данный ряд заполнения МО, запишем образование молекулы О. 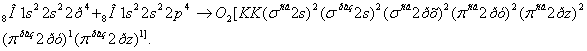 Порядок связи =2; О=О. КК – это обозначение электронов на первом уровне (n=1) и не принимающих участие в химической связи. Поскольку энергии 2ру = равны, на каждую МО помещается по одному неспаренному электрону. Наличие этих неспаренных электронов в молекуле О по ММО и обусловливают парамагнитные свойства кислорода. Ионная связь Ионная связь – вид химической связи, осуществляемый за счет электростатического взаимодействия противоположно заряженных ионов. Это связь между атомами с большой разницей ЭО, например, между катионами S – металлов первой и второй групп периодической системы и анионами неметаллов VI и VII групп. Например, KF, NаCl, LiO, NаOH и др. При образовании ионной связи атомы стремятся отдать или приобрести столько электронов, чтобы строение их внешней электронной оболочки было устойчивое, т. е. имело 8 – электронную конфигурацию (конфигурацию благородного газа). Принимая или отдавая электроны, атомы превращаются в катионы и анионы, которые электростатически взаимодействуют, и образуется ионная связь. Например, образование ионной связи вNаCl: 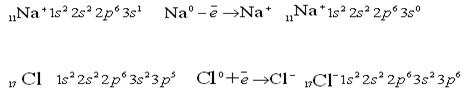 Как видно, у Na и Cl на наружном уровне 8-электронная конфигурация, т.е. такое состояние этих ионов устойчивое. Если в ковалентной полярной связи электронная пара перетянута к более ЭО атому, то в ионной связи происходит присоединение или отдача электрона атомами. Поэтому, ионную связь считают крайним случаем ковалентной полярной связи, когда длина диполя равна диаметру молекулы. Ионная связь в «чистом» виде не существует, т.к. в любой химичес-кой связи всегда имеется та или другая доля ковалентного характера, т.е. ионная связь не бывает 100%. Чтобы ионная связь была 100% нужно, чтобы Е>Е (энергия сродства к электрону > энергии ионизации). Например, CsCl: Eu (Cs) = 3,89 ; E (Cl) = 3,83 ; E < Eu, значит ионная связь не 100%, т.е. не происходит полного перехода электрона от атома цезия к атому хлора. Ионная связь имеет место в ионных кристаллических решетках (твердое состояние), где каждый ион окружен несколькими ионами противоположного знака. Связь ионная непрочная. Например: NaOH при растворении диссоциирует NaOHNa + OH. Исходя из структурной формулы в молекулеNaOH связи Na-O-H (Na – O ионная, O-H ковалентная полярная). При диссоциации разрывается ионная связь. В отличие от ковалентной связи ионная связь ненаправленная и ненасыщенная. Ненаправленностьобъясняется следующим образом: электрическое поле иона имеет сферическую форму, т.е. ионы можно представить как заряженные шары, силовые линии которых равномерно распределяются во всех направлениях в пространстве. Поэтому, каждый ион может притягивать к себе ион противоположного знака в любом направлении. Ненасыщенность в том, что два разноименных иона притянувшись друг к другу, сохраняют способность электростатически взаимодействовать с другими ионами, т.е. полностью электрическое поле иона не компенсируется. Например, NaCl: 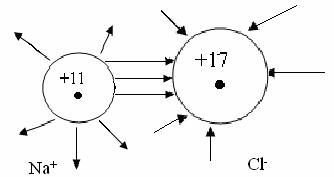 Металлическая связь Для металлов характерно наличие на внешней электронной оболочке небольшого числа валентных электронов (1-3) и значительное число вакантныхорбиталей. Поэтому энергетически более выгодно, чтобы электроны не были локализованы, а принадлежали всему кристаллу металла. Согласно теории свободных электронов, в углах кристаллической решетки металла находятся положительно заряженные ионы, которые окружены «электронным газом», состоящим из делокализованных электронов. Ме Ме + n Между положительно заряженными ионами металла и нелокализованными электронами существует электростатическое взаимодействие, обеспечивающее устойчивость вещества. Этот особый вид химической связи в металлах за счет перекрывания электронных орбиталей делокализованныхвалентных электронов называется металлической связью. В отличие от ковалентной неполярной связи металлическая связь – ненасыщенная и ненаправленная. Все свойства металлов обусловлены этим видом связи. Так наличие электронов, которые могут свободно перемещаться по объему кристалла, обеспечивает высокую электро- и теплопроводность, а также ковкость и пластичность металлов. Металлический блеск обусловлен отражением световых лучей от «электронного газа», который несколько выходит за границу положительно заряженных ионов. Заключение по материалу «Химическая связь и строение молекул» В зависимости от расстояния, на котором проявляется химическая связь, ее делят на короткодействующую и длиннодействующую. Короткодействующая проявляется на расстояниях близких к размеру атомов: это в молекулах или кристаллах на расстоянии 0,074-0,400 нм; энергия разрыва этой связи 40-1000 кДж/моль. К короткодействующей относится ковалентная связь, это очень прочная связь. В зависимости от способа образования ковалентной связи энергия связи будет разная. Например: а) обменный механизм 120-500 кДж/моль б) донорно-акцепторный механизм 40-200 кДж/моль Примером обменного механизма образования ковалентной связи является образование Н2 : Есв=436 кДж; lсв=0,074 нм. Ионная связь слабее ковалентной связи, ее энергия составляет около 100 кДж/моль. Рассмотрев виды внутримолекулярной химической связи по уменьшению прочности их можно расположить: Металлическая › ковалентная неполярная › ковалентная полярная › ионная. Что касается взаимосвязи между отдельными видами связи, то можно сделать следующий вывод: ковалентная связь – универсальный вид химической связи, т.е. когда полярность достигает своего максимума (длина диполя равна диаметру молекулы) ковалентная полярная связь превращается в ионную связь, а когда связываются химической связью одинаковые атомы и электроны обобществляются, то ковалентная неполярная связь превращается в металлическую. В настоящее время можно считать, что известные на сегодня виды химической связи едины по своей природе. | |||||||||||||||||||||
