ХИИИИИИИИМИИИИЯЯЯЯЯ. Тема 1 химия как наука и её значение в жизни человека
 Скачать 1.07 Mb. Скачать 1.07 Mb.
|
|
Тема 5: ПЕРИОДИЧЕСКОЕ ИЗМЕНЕНИЕ СВОЙСТВ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ 1. Периодическое изменение физических свойств элементов 2. Периодическое изменение химических свойств элементов В ряду атомов с последовательно возрастающим порядковым номером (или зарядом ядра) так же последовательно увеличивается число электронов в них. Это приводит к повторению подобных конфигураций их электронных оболочек и подоболочек. Большинство же физико-химических и химических свойствэлементов сильно зависит именно от строения внешних электронных подоболочек, т.е. от электронных конфигураций внешних атомных орбиталей. Отсюда следует, что место элемента в таблице Менделеева определяется его свойствами, а каждому месту соответствует элемент, обладающий определенной совокупностью свойств. Из физических свойств следует отметить периодичность изменения атомного объема и радиуса атомов и ионов. в начало Периодическое изменение физических свойств элементов Атомный объем– объем одного моля атомов простого вещества в твердом состоянии, содержащего независимо от природы элемента одинаковое число атомов, равное числу Авогадро (NA=6,02∙1023). По периоду слева направо атомный объем уменьшается от I по VI группу, где появляется первая пара p-электронов. После VI группы начинается увеличение атомного объема, но наибольший атомный объем имеют щелочные металлы. Атомные и ионные радиусы Атомы и ионы не имеют строго очерченных границ, вследствии волновой природы электрона. Поэтому пользуются так называемыми эффективными или кажущимися (условными) радиусами атомов и ионов. Существует несколько методов определения радиусов атомов и ионов и, как правило, они дают близкие друг другу результаты. Если представить себе атомы в кристаллах простого вещества в виде соприкасающихся друг с другом шаров, то расстояние между центрами соседних шаров (т.е. между ядрами соседних атомов) можно принять равным удвоенному радиусуатома. Так наименьшее межъядерное расстояние в кристаллах меди равно 0,256 нм, а радиус атома меди r=0,256/2=0,128нм. Радиусы, определяемые таким образом, называется атомными радиусами по Брэггу.Имеется метод расчета радиусов по Слейтеру.В качестве радиуса атома берут расстояние от ядра атома до максимума электронной плотности его валентных электронов. Для соединений с металлической и ковалентной связью как единую систему для расчета радиусов, рекомендуют использоватьорбитальные радиусы. Это расстояние от ядра атома до максимума функции радиального распределения вероятности последней АО, заселенной электронами. Например, для атома меди это расстояние от ядра атома до максимума электронной плотности 4sорбитами, для кремния – до аналогичной характеристики – 3p-АО. 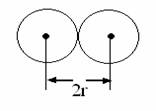 Изменение величины радиуса имеет периодический характер.По периоду изменение радиуса зависит от заряда ядра атомов.Слева направо по периоду с увеличением заряда атомов (Z) атомные радиусы уменьшаются, т.к. число энергетических уровней (n) остается постоянным (в пределах периода), а заряд ядра растет и притяжение электронов увеличивается (атом сжимается). Сверху вниз по группе радиусы атомов увеличиваются, т.к. увеличивается число энергетических уровней. Надо отметить, что по группе увеличивается заряд ядра атомов (Z), но увеличение числа энергетических уровней перекрывает влияние увеличения заряда ядра и радиус увеличивается. Изменение орбитальных радиусов атомов по периоду и группе(нм)
В связи с изменением радиуса атомов изменяются их окислительно-восстановительные свойства. Так, по периоду в связи с уменьшением радиуса атомов неметалличность увеличивается и увеличиваются окислительные свойства, а по группе – радиус атомов увеличивается усиливаются металлические свойства и соответственно увеличиваются восстановительные свойства. Для ионов, так как и для атомов, существует несколько систем радиусов. Наиболее «индивидуальным» радиусом иона (как и для атома) считают его орбитальный радиус. Потеря атомом электронов приводит к уменьшению его эффективных размеров, а присоединение избыточного электрона – к увеличению. Поэтому радиус катиона – меньше радиуса атома, а радиус аниона – больше. rаниона>rатома>rкатиона Например: rk=0,216 нм; rk+=0,059 нм; rCl=0,072 нм; rCl=0,074 нм. Радиус иона тем сильнее отличается от радиуса атома, чем больше заряд иона: rCr=0,043 нм rCr =0.041 нм rCr =0,040 нм. в начало Периодическое изменение химических свойств элементов Химические свойства элементов определяются числом электронов на внешнем энергетическом уровне, а так же способностью отдавать или присоединять электроны. Различают: металлы, неметаллы, благородные газы. Металлы имеют на наружном энергетическом уровне от 1 до 3ē (кроме Н,Не,В). Для атомов металлов характерна отдача электронов и превращение их в положительно заряженные ионы (катионы): Ag0-e Ag+. Для отрыва электрона требуется некоторая энергия. С количественной стороны способность атома отдавать электроны характеризуется энергией ионизации. Энергия ионизации – энергия необходимая для отрыва электрона от атома, иона, радикала или молекулы в газовой фазе при T=00K без передачи освобожденному электрону кинетической энергии. Обозначается Еu, измеряется в кДж/моль или электрон-вольтах (эВ). Необходимо учесть что 1эВ – энергия, которую приобретает электрон в ускоряющемся электрическом поле с разностью потенциалов 1В (1эВ=96,5 кДж/моль), а напряжение электрического поля достаточное для отрыва электрона называется потенциалом ионизации. Энергия ионизации, выраженная в эВ, численно равна потенциалу ионизации, выраженному в вольтах. От атома можно оторвать 1,2,3 и т.д. электронов. Поэтому различают энергию ионизации первую (Eu(1)) и вторую (Eu(2)) и т.д. Поскольку положительный заряд образующегося иона растет (по мере удаления электронов) требуется большая затрата энергии, т.е. энергия ионизации растет Eu(1) Например: для атома углерода последовательные энергии ионизации равны: Eu(1)=11,26 эВ, Eu(2)=24,4эВ; Eu(3)=47,9эВ, Eu(4)=64,5 эВ. Энергия ионизации зависит от заряда ядра и радиуса атома.Чем больше заряд и меньше радиус, тем больше энергия ионизации. У элементов одного и того же периода при переходе от щелочного металла к благородному газу заряд ядра постепенно возрастает, а радиус атома уменьшается, поэтому энергия ионизации постепенно увеличивается, с максимумом у благородных газов, а восстановленные свойства ослабевают. В группе сверху вниз (подгруппа А) энергия ионизации уменьшается, т.к. увеличивается радиус атомов (хоть и увеличивается заряд ядер атомов) за счет увеличения числа энергетических уровней. Первые энергии ионизации атомов второго и третьего периодов, эВ
Энергия ионизации – мера металличности, у металлов она минимальная. У неметаллов на наружном энергетическом уровне от 4 до 7ē (включая H и В). Основное свойство неметаллов – способность присоединять электроны: Cl0+eCl-. Энергия выделяющаяся (или поглощающаяся) при присоединении электрона к атому, иону, радикалу или молекуле в газовой фазе при Т=0 К, без передачи частице кинетической энергии, называется сродством к электрону. Обозначается Eē, выражается так как и Eu, в эВ или кДж/моль. Сродство к электрону атомов s,d,f элементов (металлы ), как правило, близко к нулю или отрицательно; из этого следует, что для большинства из них присоединение электронов энергетически не выгодно. Сродство же к электрону атомов p-элементов (неметаллов) всегда положительно с наибольшим значением у самого типичного неметалла – фтора. Сродство кэлектрону зависит от заряда ядра и радиуса атома.Чем больше заряд ядра атомов и меньше радиус, тем больше сродство к электрону. Такую закономерность мы имеем слева направо по периоду. Вдоль каждого периода заряд ядра атомов увеличивается, а радиус атомов уменьшается – сродство к электрону увеличивается, усиливаюся окислительные свойства. Сверху вниз по группе сродство к электрону уменьшается, т.к. увеличивается радиус атомов, что приводит к увеличению восстановительных свойств. Сродство к электрону – мера неметалличности: чем больше неметалличность, тем больше сродство к электрону. Суммируя сказанное нужно отметить что оба показателя (Eu и Ee) по периоду увеличиваются, а по группе уменьшаются. Соответственно по периоду увеличиваются окислительные свойства, а по группе – увеличиваются восстановительные свойства. Выводы: 1. Самыми сильными восстановителями являются элементы находящиеся в начале каждого периода и в конце I подгруппы А (это Cs,Fr). Их атомы имеют самые низкие значения энергии ионизации. 2. Самыми сильными окислителми являются элементы, располагающиеся в правом верхнем углу таблицы периодической системы (F,O). Атомы этих элементов обладают наивысшими значениями сродства к электрону. Для решения вопроса какой из атомов легче присоединяет электрон следует учитывать оба показателя: Eu и Ee. Согласно Р. Малликену (США)полусумма этих величин называется электроотрицательностью (ЭО): ЭО = . Электроотрицательность показывает на способность атома присоединить электроны: по периоду увеличиваются, а по группе – уменьшаются. Сложность использования подхода Малликена заключается в том, что нет надежных методов количественного определения энергии сродства к электрону. Поэтому Л. Полинг (США) предложил вместо абсолютных значений ЭО использовать относительные значения. Он принял за единицу ЭОLiи рассчитал ОЭО для других элементов. Например: Eu(Li)=5,39 эВ; E-е (Li)=0,22 эВ; ЭОLi==2,805 эВ; Eu(F)=17,42 эВ; E-е =3,62 эВ; ЭО F==10,52 эВ; ОЭО Li=1 ОЭОF== 4. Для амфотерных элементов ОЭО лежит в пределах 1,5-2,0 ОЭО по Полингу
в начало Тема 6: ХИМИЧЕСКАЯ СВЯЗЬ И СТРОЕНИЕ МОЛЕКУЛ (IЧАСТЬ) 1. Понятие о химической связи. Основные типы химической связи. 2. Количественная характеристика химической связи. 3. Квантово-механическое объяснение ковалентной связи. 4. Валентность и ковалентная связь с позиций метода валентных связей (МВС). Учение о химической связи – центральный вопрос современной химии. Многообразие химических соединений, механизм их образования можно понять только, изучив природу взаимодействия атомов в веществе. в начало Понятие о химической связи. Основные типы химической связи. Химическая связь – взаимодействие атомов, обусловленное перекрытием электронных облаков связывающихся частиц, которое сопровождается уменьшением полной энергии системы (молекулы, молекулярного иона, кристалла). Отсюда следует, что к основным чертам химической связи можно отнести: а) снижение общей энергии двух и многоатомной системы по сравнению с суммарной энергией изолированных частиц, из которых эта система образована. Б) перераспределение электронной плотности в области химической связи между атомами, сближенных на расстоянии связи. Таким образом, условием образования химической связи является уменьшение потенциальной энергии системы взаимодействующих частиц; если же энергия образовавшейся системы не уменьшается по сравнению с суммарной энергией исходных частиц – связь не образуется. Основные положения химической связи были высказаны в период 1914-1920 гг. Основным принципом в развитии теории химической связи послужило открытие электронного строения атома. В 1916 г. В. Коссель предположил, что при взаимодействии двух атомов один из них отдает, а другой принимает электроны, при этом образуются противоположно заряженные ионы и их взаимное электростатичес-кое притяжение приводит к образованию химической связи (теория Косселя). Дальнейшее развитие идей Косселя привело к созданию современных представлений об ионной связи. В 1916-1918 гг. Г. Льюис предположил, что химическая связь может возникать так же путем образования электронной пары, одновременно принадлежащей двум атомам; эта гениальная догадка Г. Льюиса послужила основой для разработки современной теории ковалентной связи. Идея Льюиса об электронных парах была подтверждена и объяснена методами квантовой химии. Современное представление о химической связи Согласно квантово-механическим представлениям можно говорить лишь о вероятности нахождения электронов в поле атомных ядер. Данному пространственному положению атомных ядер отвечает определенное распределение электронной плотности. Выяснить как распределяется электронная плотность – описать химическую связь в веществе. В зависимости от характера распределения электронной плотности в веществе различают три вида химической связи: ковалентную, ионную, металлическую. в начало Количественная характеристика химической связи. Количественной характеристикой химической связи являются: энергия связи, длина, валентный угол, кратность связи. Энергия связи(Есв) – количество энергии которое необходимо затратить, чтобы разорвать все имеющиеся связи между атомами в одном моле вещества. Измеряется в кДж/моль. Энергия связи определяет прочность молекулы. Чем она больше (Есв), тем прочнее молекулы. Для многоатомных соединений с однотипными связями за энергию связи принимается среднее ее значение, рассчитанное делением энергии образования соединения из атомов на число связей. Например, энергию связи в аммиаке определяют путем деления энергии образования молекулы NH3 из атомов водорода и азота на три: энергия образования NH3 равна 1170 кДж/моль (Т = 298оК). 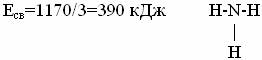 Длина связи (св) – расстояние между ядрами атомов, образующих соединение. Длину связи определяют экспериментально при помощи молекулярной спектроскопии, дифракции рентгеновских лучей и др. Имеется корреляция (зависимость) между длиной и энергией связи: с уменьшением длины связи обычно увеличивается энергия связи и соответственно устойчивость молекул. Например, в ряду галогеноводородов от HF до HJ длина связи растет, а ее энергия уменьшается. |
