ХИИИИИИИИМИИИИЯЯЯЯЯ. Тема 1 химия как наука и её значение в жизни человека
 Скачать 1.07 Mb. Скачать 1.07 Mb.
|
|
Тема 8:МЕЖМОЛЕКУЛЯРНОЕ ВЗАИМОДЕЙСТВИЕ 1. Водородная связь, её свойства, значение в природе. 2. Силы Ван-дер-Вальса. Универсальное межмолекулярное взаимодействие (УММВ). Водородная связь, её свойства, значение в природе Все межмолекулярные взаимодействия (ММВ) можно разделить на две группы: специфические и универсальные, при этом возможны: донорно-акцепторный механизм образования и электростатическое взаимодействие. К специфическим ММВ относится водородная связь. Химическая связь,образованная положительно поляризованным водородом (Н) одной молекулы и электроотрицательным атомом (F, Cl, N, O, S) другой или той же молекулы называется водородной связью. Отсюда следует, что водородная связь бывает межмолекулярной и внутримолекулярной (внутримолекулярной она бывает реже). Энергия водородной связи значительно меньше энергии обычной ковалентной связи: она равна примерно 8 – 40кДж (а ковалентная 120 – 1000 кДж/моль). 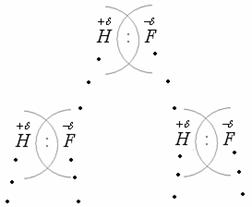 Возникновение водородной связи можно в первом приближении объяснить действием электростатических сил. Например: возникновение водородных связей между молекулами в фтороводородной кислоте. Как известно, в молекуле HF связь ковалентная сильно полярная: на ионе водорода накапливается положительный заряд, а на ионе фтора – отрицательный. Поэтому между протоном атома водорода и отрицательно заряженным атомом фтора соседней молекулы HF возникает электростатическое притяжение и возникает водородная связь (обозначается тремя точками). 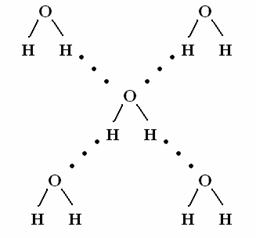 Водородная связь между молекулами воды образуется по донорно-акцепторному механизму. Водородная связь образуется между ионом водорода одной молекулы и ионом кислорода другой молекулы. У иона кислорода имеются две неподелённые электронные пары (донор), а ион водорода имеет свободную орбиталь (акцептор). Таким образом каждая молекула может максимально образовать по четыре водородные связи: При этом длина водородной связи почти в 2 раза больше (0,180 нм) длины ковалентной связи О-Н (0,099 нм); и прочность водородной связи невелика20 кДж/моль. Хотя энергия водородной связи невелика ее хватает, чтоб вызвать ассоциацию молекул, т.e. их объединение в димеры или полимеры, которые в ряде случаев существуют не только в жидком состоянии вещества, но и сохраняются при переходе его в пар. Например, в воде имеются агрегаты типа (НО). Именно ассоциация молекул, затрудняющая отрыв их друг от друга, и служит причиной аномально высоких температур плавления и кипения таких веществ как HF, HO, NH. Так вода, в отсутствие водородных связей, должна была бы кипеть при температуре – 66С, а кипит при темпера-туре+100С. В максимальном количестве водородные связи возможны во льду; при температуре 20С в жидкой воде сохраняется около половины водородных связей, в парообразном состоянии все водородные связи разрываются. 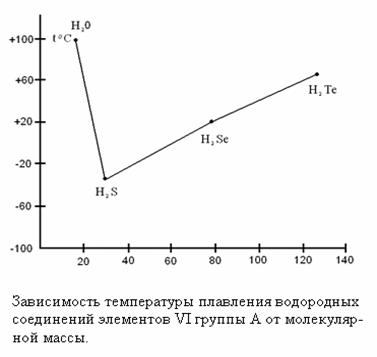 В ряду однотипных соединений VI-ой подгруппы А температуры плавления и кипения с увеличением атомной массы элемента возрастают. Объясняется это усилением взаимного притяжения молекул с увеличением размеров атомов и с ростом дисперсионного взаимодействия между ними. Однако, HO, имеющая наименьшую молекулярную массу в ряду HO – HS – HSe – HTe, кипит при оптимально высокой температуре, что связано с ассоциацией молекул в агрегаты за счет водородных связей и затруднением отрыва их друг от друга. Водородная связь играет большую роль в природе. Она проявляется не только в воде, но и в различных кристаллических веществах, полимерах, белках, нуклеиновых кислотах и др. Например, в белках и НК водородные связи участвуют в спираллизации их молекул. И ещё пример, благодаря водородным связям лёд легче воды, так что лёд образуется на поверхности воды и предохраняет оставшуюся жидкую воду от потери тепла и замерзания. Внутримолекулярная водородная связь может возникать между ионами водорода и отрицательными атомами полярных групп в одной и той же молекуле. Например в о- нитрофеноле: 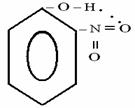 в начало Силы Ван-дер-Вальса. Универсальное межмолекулярное взаимодействие (УММВ). Универсальное межмолекулярное взаимодействие проявляется во всех молекулах без исключения и называется связью или силами Ван-дер-Ваальса. Хотя эти силы значительно слабее сил короткодействующей химической связи (энергия вандерваальсовых сил не превышает 8 кДж/моль), они являются причиной перехода большинства веществ из газообразного состояния в жидкое и твердое, а так же устойчивости молекулярных крис-таллов, адсорбции газов поверхностями твердых тел и других явлений. Они ненаправленные и ненасыщенные. Эти силы действуют на расстоянии между молекулами в несколько нм (-м). Силы Ван-дер-Ваальса включают в себя три составляющие: ориентационное (диполь-дипольное), индукционное и дисперсионное взаимодействие. 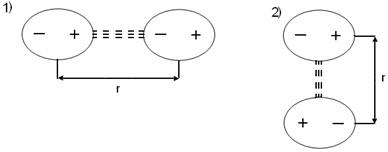 1. Ориентационное (диполь-дипольное) взаимодействие связано с полярностью молекул. При сближении двух полярных молекул они ориентируются согласно знаку заряда (1) и располагаются либо последовательно (1) или антипараллельно (2). Полярные молекулы притягиваются за счет электростатических сил диполь-дипольного взаимодействия (например, в жидком сероводороде,хлороводороде и др.). Такой реакции препятствует тепловое движение молекул, усиливающееся с повышением температуры. Поэтому ориентационное взаимодействие тем больше, чем больше дипольные моменты, меньше расстояния между молекулами и ниже температура. Ориентационное взаимодействие существенно сказывается на свойствах вещества. Например, вещество кипит тогда, когда энергия ММВ преодолевается энергией кинетического движения молекул. Поэтому, чем больше энергия ММВ, тем до более высокой температуры следует нагревать вещество, чтобы оно закипело. Так tжидкого N равна - 196C, а t СО (II), молекулы которого, в отличие от молекул N полярны, больше и tкип = -191,5С. 2. Индукционное взаимодействие возникает при взаимодействии полярных и неполярных молекул. Например, HCI и CI.При этом полярная молекула поляризует неполярную, в которой появляется (индуцируется) наведенный дипольный момент. В результате возникает притяжение молекул. 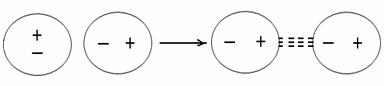 Энергия индукционного взаимодействия тем больше, чем больше дипольный момент полярной молекулы и чем больше поляризуемость неполярной (поляризуемость молекул – это мера смещения зарядов в молекуле в электрическом поле заданной напряженности). Поляризуемость резко увеличивается с увеличением размеров электронной оболочки. Энергия индукционного взаимодействия в 10-20 раз слабее ориентационного взаимодействия. 3. Дисперсионное взаимодействие универсальное и присутствует всегда. Оно проявляется при взаимодействии неполярных молекул и при взаимодействии атомов благородных газов. Например: переход благородных газов при низких t в жидкое состояние. Суть возникновения дисперсионных сил заключается в следующем. При движении электронов в молекуле мгновенно возникает ассиметрия распределения положительных и отрицательных зарядов. В результате такого движения электронов каждую молекулу можно рассматривать, как место возникновения мгновенно существующих диполей (мгновенно существующий диполь может существовать около 10 с), которые в свою очередь индуцируют мгновенныемикродиполи у соседних молекул. Движение мгновенных микродиполей становится согласованным, их появление и распад происходит синхронно. 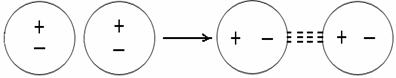 В результате взаимодействия мгновенных диполей энергия системы понижается. Для неполярных молекул, при взаимодействии друг с другом, дисперсионное взаимодействие является единственной составляющей вандерваальсовых сил. Силы дисперсионного взаимодействия сравнимы по величине с силами полярных ММВ. Энергия дисперсионного взаимодействия возрастает с увеличением размеров атома (радиусов), так как при этом поляризуемость молекул увеличивается, но энергия уменьшается при увеличении расстояния между центрами частиц. Например, в ряду однотипных соединений F, CI, Br, J повышается температура кипения и плавления, что связано с увеличением размеров радиусов этих атомов, а значит иполяризуемости. Вклад отдельных составляющих в энергию межмолекулярного взаимодействия отражены в таблице:
Как видно из таблицы, в случае HCI на долю дисперсионных сил приходится 81% всего межмолекулярного взаимодействия, для HBr – 95%, дляHJ – 99,5% Для газов и жидкостей межмолекулярное взаимодействие называют силы Ван-дер-Ваальса, а в твёрдых телах ММВ заменяют понятием адгезии икогезии. Адгезия– сцепление между молекулами различных веществ (между разнородными молекулами). Практически это проявляется в сцеплении между поверхностями разнородных по химической природе материалов (мел на доске, грязь на гусеницах трактора). Когезия – сцепление между однородными молекулами данного вещества (в кристаллах сахара, соли, алмаза). Эти силы лежат в основе механической прочности материала. Явлениями адгезии и когезии объясняется адсорбция, которая является в свою очередь частным случаем более общего явления – сорбции.Сорбция – всякое поглощение веществ из одной фазы другой. Адсорбция – изменение концентрации вещества на границе раздела фаз. Чтобы уяснить сущность явления адсорбции рассмотрим состояние двух молекул одного вещества: 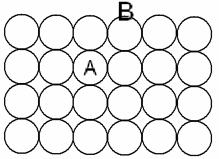 где А - молекула расположена в толще тела; В - молекула расположена в поверхностном слое Силовое поле молекулы А полностью компенсировано (насыщено) в результате взаимодействия с другими молекулами, а в молекуле В поле компенсировано лишь частью. Ненасыщенная часть поля поверхностных молекул создает особый вид потенциальной энергии, называемыйповерхностной.Это вещество – адсорбент, а вещество, которое скапливается на поверхности адсорбента – адсорбируемое вещество. При этом поверхностная энергия абсорбента понижается. Например: поглощение краски активированным углем. Явление адсорбции используется вхроматографическом методе, основанном М.В. Цветом (1903). Метод применяется для разделения сложных смесей: гормонов, витаминов, пигментов листьев растений, изотопов и д.р. Ионообменная адсорбция применяется для опреснения воды. в начало Тема 9: ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ПРОТЕКАНИЯ ХИМИЧЕСКИХ ПРОЦЕССОВ 1. Закон сохранения массы вещества и энергии, как две составные части закона сохранения материи. 2. Внутренняя энергия системы. Энтальпия. 3.Термохимия, термохимические законы. Закон сохранения массы вещества и энергии, как две составные части закона сохранения материи В 1748 г. М.В. Ломоносов сформулировал закон сохранения массы веществ, а в 1756 г. экспериментально доказал этот закон. В настоящее время закон сохранения массы веществ формулируется так: «Масса веществ, вступивших в реакцию, равна массе веществ, образовавшихся в результате реакции». Zn + 1/2О2 ZnO 6.54 г + 1,60 г 8,14 г В 1843г. (почти 100 лет спустя) немецкий физик Мейер, англ. физик Джоуль и нем. физиолог Гельмгольц доказали экспериментально и сформулировали закон сохранения энергии: «Энергия не возникает из ничего и не исчезает бесследно, но отдельные ее виды могут переходить друг в друга по строго эквивалентным соотношениям». Например: при зарядке аккумулятора электрическая энергия превращается в химическую, а при разрядке аккумулятора – наоборот, химическая – в электрическую. 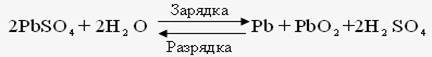 До начала ХХ века эти два закона (сохранения массы веществ и энергии) рассматривались отдельно друг от друга. Когда было доказано , что энергия обладает массой (Лебедев, 1900) эти два закона объединили в единый закон природы – закон сохранения материи: общее количество вещества (а вещество – это вид материи) до и после реакции остается неизменным , происходит лишь превращение одной формы материи в другую. Раздел науки, изучающий переходы энергии из одной формы в другую, от системы к системе, а так же энергетические изменения при разных физических и химических процессах называется – термодинамикой. Объектом изучения в термодинамике является – система.Системой называется совокупность веществ, находящихся во взаимодействии и обособленных от окружающей среды. Напр., это раствор в колбе, смесь газов в баллоне и др. В зависимости от характера взаимодействия системы с окружающей средой различают: открытые, закрытые и изолированные системы. 1.Открытая система – происходит обмен энергии и вещества с другими системами и окружающей средой. 2.Закрытая система – осуществляется обмен энергией, но не веществом. 3.Изолированная система – обмен энергией и веществом с внешней средой полностью исключён. Состояние системы характеризуется термодинамическими параметрами T, V, P. Если процессы происходят при const: T-изотермический, V-изохорический, P-изобарический. К важнейшим величинам, характеризующим химические системы, относятся: внутренняя энергия (U), энтальпия (H), энтропия (S), энергия Гиббса(G). Все эти величины представляют собой функции состояния, т.е. зависят только от состояния системы, но не от способа, которым это состояние достигнуто. в начало Внутренняя энергия системы. Энтальпия. Внутренняя энергия системы – это полная энергия системы, складывающаяся из кинетической и потенциальной энергии частиц системы (это поступательные и вращательные движения молекул, колебательные движения атомов внутри молекул, движение электронов в атоме), кроме потенциальной и кинетической энергии системы в целом. Каждая система имеет внутреннюю энергию (U) , её измерить нельзя. Протекание химической реакции сопровождается изменением внутренней энергии, которая равна U-U=U где (1 – начальное состояние, 2 – конечное состояние). Теплота, подведенная к системе, расходуется на увеличение внутренней энергии и на совершение работы системы против внешних сил. Q=U+A (I), где А- работа. A=pV . U=Q-A=Q-pV (II). V=V- V Уравнение (II) выражает первое начало термодинамики, согласно которому: изменение внутренней энергии равно теплоте, сообщенной зак-рытой системой извне, за вычётом работы, произведённой системой против внешних сил. Первое начало термодинамики является формой выражения закона сохранения энергии. Химические реакции могут протекать в условиях: 1. Т, V – const (изохорно-изотермический процесс). =0, тогда А=0, а То есть теплота, подведенная к системе идет на изменение внутренней энергии. 2. Т, P – const (изобарно-изотермический процесс). Q=U+A=U+pV= U – U+p(V – V)= U – U + pV – pV= (U+ +pV) – ( U+ pV) Сумму U+pV называют энтальпией системы и обозначают буквой H: H=U+pV. Подставив энтальпию в выражение , имеем , то есть теплота, подведенная к системе при const давлении, расходуется наизменение энтальпии системы. Энтальпию измерить нельзя, как и внутреннюю энергию, но можно найти изменение энтальпии(H) при переходе системы из одного состояния в другое. Измеряется H в стандартных условиях и обозначается кДж/моль. в начало Термохимия, термохимические законы. Раздел химии,посвященный количественному изучению тепловых эффектов реакций, называется термохимией. Химические уравнения, в которых указаны тепловые эффекты, называются термохимическими. Реакции, идущие с выделением тепла – экзотермические, а с поглощением тепла – эндотермические. 1. В экзотермических реакциях H > H, поэтому H–H= – H; A+B AB + Q (-H). Например: Zn(к)+HSO Zn SO(ж) + H(г)+143,0 кДж; =-143,0 кДж 2. В эндотермических реакциях H< H, поэтому H–H=+H; C+ДA-Q (+H). Например: N(г)+О(г) 2NO(г)-180,5 кДж; =180,5 кДж. Особенности термохимических уравнений: 1. В уравнениях допускаются дробные коэффициенты, так как энтальпию относят к одному молю вещества. 2. В уравнениях указываются агрегатные состояния веществ, так как от агрегатного состояния зависит энтальпия реакции. Например: 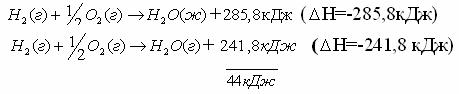 Разница в 44 кДж – это энтальпия перехода из одного агрегатного состояния в другое. Изменение энтальпии химической реакции обратно по знаку тепловому эффекту реакции (P –const). Найдены энтальпии различных процессов: нейтрализации, испарения, образования, сгорания и др. Тепловой эффект реакции образования одного моля вещества из простых веществ в стандартных условиях называют теплотой образованияилиэнтальпией образования(). Например: Энтальпию образования простых веществ, устойчивых в стандартных условиях, принимают равной нулю В основу всех термохимических расчетов положены законы: Лавуазье – Лапласа (1780-1784) и Г.И. Гесса (1840). Закон Лавуазье – Лапласа гласит: теплота разложения сложного вещества на простые равна теплоте его образования из тех же веществ, взятой с обратным законом. AB A+B + Q; A+B AB - Q Q= Q; CaO(т)Ca(т)+1/2O(г)-635.5 кДж/моль; Ca(т)+ 1/2O(г)CaО (т)+635.5 кДж/моль. Закон Гесса является частым случаем закона сохранения энергии: тепловой эффект химической реакции зависит только от начального и конечного состояния веществ и не зависит от промежуточных стадий реакции. 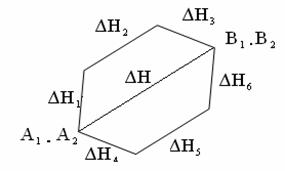 Образование В и В возможно: 1. Непосредственно из А и А (тепловой эффект ∆Н). 2. Через промежуточные стадии, тепловые эффекты которых ∆Н1, ∆Н2, ∆Н3. 3. Через промежуточные стадии, тепловые эффекты которых ∆Н4, ∆Н5, ∆Н6. Согласно закону: ∆Н=∆Н1+ ∆Н2+∆Н3=∆Н4+∆Н5+∆Н6 Например. Реакцию нейтрализации HSO раствором NaOH можно проводить: 1. В одну стадию: . 2. Через промежуточные стадии: а) ; б) Суммарный тепловой эффект в обоих случаях одинаковый. В термохимических расчетах большое значение имеют следствия из закона Гесса. Первое следствие из закона Гесса: Тепловой эффект химических реакций равен сумме энтальпий образования продуктов реакции за вычетом суммы энтальпий образования исходных веществ. Вычисления проводятся с учетом стехиометрических коэффициентов перед веществами в уравнении реакции: Например. Вычислить энтальпию данной реакции 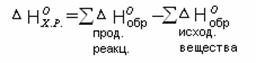 и решить вопрос эндо- или экзотермической является реакция. Из таблицы берем энтальпии веществ: ; Реакция экзотермическая, т.к. ∆Н = -802,2 кДж. Второе следствие из закона Гесса: тепловой эффект химической реакции равен сумме энтальпий сгорания исходных веществ за вычетом суммы энтальпий сгорания продуктов реакции. Вычисления проводятся с учетом стехиометрических коэффициентов перед веществами в уравнении реакции: 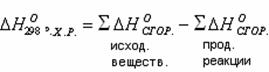 Энтальпия сгорания – тепловой эффект реакции окисления кислородом элементов, входящих в состав вещества, до образования высших оксидов. Третье следствие из закона Гесса: тепловой эффект перехода вещества из одного агрегатного состояния в другое равен разности между энтальпиями в одном и другом агрегатных состояниях. Например: +; + Разница в 44 КДж/моль – теплота перехода жидкой воды в пар и наоборот. в начало Тема 10: НАПРАВЛЕННОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ 1. Факторы, определяющие направление протекания химических процессов. Энтропия. 2. Энергия Гиббса и направленность химических реакций. Факторы, определяющие направление протекания химических процессов. Энтропия. Первое начало термодинамики – закон сохранения энергии – рассматривает уже совершившиеся процессы, но не указывает направление процесса химической реакции, ее возможность и полноту протекания, а это представляет собой основную задачу при исследовании любого процесса, особенно высокотемпературного. Развитие химических реакций определяет второе начало термодинамики. До середины XIX считали, что непременным условием химической реакции является ее экзотермичность, т.е. уменьшение энтальпии системы. В1867 г. был высказан принцип Бертло (фр.) – Томсона (англ.), согласно которому, всякая химическая реакция идет в сторону уменьшения энтальпии (выделения тепла), (∆Н<О). Т.е. химические реакции протекают самопроизвольно в направлении уменьшения внутренней энергии, в направлении, отвечающему положительному тепловому эффекту. Однако попытка объяснить направленность химических процессов только стремлением к минимуму внутренней энергии приводит к противоречивым фактам. Так, при обычной температуре известны самопроизвольно протекающие процессы с поглощением тепла (эндотермические), т.е. с увеличением энергосодержания (∆Н>О). Например, растворение некоторых солей (, ) в воде. Так, энтальпия растворения 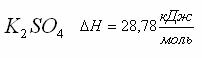 Эндотермичность процессов, самопроизвольно проходящих, показывает несостоятельность принципа Бертло-Томсона. Значит тепловой эффект реакции не объясняет все возможности самопроизвольного протекания процессов: самопроизвольно идут как эндотермические так экзотермические реакции. Чтобы составить представление о втором факторе, влияющем на направление химической реакции, рассмотрим самопроизвольно протекающий процесс, не сопровождающийся тепловым эффектом. Например, рассмотрим процесс самопроизвольного смешивания двух газов (Ar иHe). 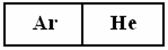 Эти газы находятся в баллоне и разделены перегородкой.  После открытия перегородки газы самопроизвольно смешиваются, а обратного процесса самопроизвольного разделения не произойдет. Процесс протекает именно так, чтоб в итоге процесса система перешла от более упорядоченного состояния к менее упорядоченному, т.е. уменьшалась степень упорядоченности системы. Это значит, что естественное течение процесса – это переход от порядка к беспорядку. Например, испарение жидкостей, растворение веществ и др. Рассмотренные явления представляют собой переход в наиболее вероятностное состояние, т.е. в состояние с максимальным беспорядком частиц. Итак, в природе для самопроизвольного протекания процессов известны две движущие силы: 1. Стремление перейти в состояние с наименьшей внутренней энергией (выделение тепла). 2. Стремление перейти в наиболее вероятностное состояние (состояние с наибольшим беспорядком). Мерой беспорядка с количественной стороны является термодинамическая величина – энтропия (S). Ее ввел в 1856 г. Клаузиус. В 1896 г. Больцман дал физическую интерпретацию понятия энтропии: «Нет закона в природе, который бы утверждал, что не может произойти разделение газов, но вероятность такого состояния очень мала». Беспорядок – более вероятностное состояние. Энтропия измеряется в стандартных условиях и записывается Дж/мольК. В отличие от внутренней энергии и энтальпии, можно определить не только изменение энтропии, но и ее абсолютное значение. Характеристика энтропии дается во втором и третьем начале термодинамики. Второе начало термодинамики: в изолированной системе самопроизвольно могут протекать только такие процессы (и химические реакции), при которых энтропия возрастает. Большой беспорядок в системе связан с большей вероятностью ее состояния. Состояние любой системы можно охарактеризовать макро – и микросостояниями. Макросостояние – это состояние вещества, характеризующееся определенными значениями T, P, V. Микросостояние – состояние каждой частицы вещества – молекулы, атома, иона, характеризующееся скоростью движения, положением (мгновенные координаты), направлением перемещения. Одному и тому же макросостоянию соответствует большое число разных микросостояний. Это связано с тем, что в макроскопических количествах вещества число частиц очень большое, а их положения и скорости при обычных температурах чрезвычайно разнообразны. Число микросостояний, которое соответствует данному макросостоянию вещества, называется вероятностью состояния и обозначается W. Термодинамическая вероятность системы выражается огромными числами. Поэтому пользуются логарифмом вероятности (W). Энтропия (S) пропорциональна W и вычисляется по формуле: S=KW, где К- коэффициент Больцмана равен К=R/N; K= Дж/K (R – газовая постоянная 8,314 Дж/мольК; N – число Авогадро ). Из уравнения следует, что энтропия системы увеличивается пропорционально логарифму термодинамической вероятности состояния (W). 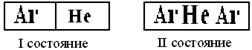 Например: S=KW; S> S S= KW; S – S= S=K; W> W. Энтропия в самостоятельных процессах стремится к увеличению. Величина энтропии зависит от температуры и агрегатного состояния вещества. При повышении температуры растет скорость движения частиц, т.е. число их микросостояний увеличивается и соответственно увеличивается термодинамическая вероятность и энтропия. О зависимости энтропии от температуры говорится в третьем начале термодинамики: при абсолютном нуле энтропия идеального кристалла равна нулю. Это начало свидетельствует о том, что у идеально правильно построенных кристаллов при T=0 К расположение частиц в узлах кристаллической решетки характеризуется идеальным порядком, т.е. узловые частицы в кристалле неподвижны. Например: T=0 К; W=1. W=1=0 S= S S=0. Энтропия изменяется при изменении агрегатного состояния вещества. Возрастает энтропия при превращении вещества из твёрдого агрегатного состояния в жидкое (S) и, в особенности, при переходе из жидкого состояния в газообразное (S). Проследим изменения энтропии при изменении агрегатного состояния воды:
Как видно, в ряду агрегатных состояний: твердое – жидкое – газ энтропия возрастает. Энтропия также увеличивается при переходе вещества из кристаллического в аморфное состояние. Увеличение числа атомов в молекуле приводит к увеличению энтропии: (О)=161; (О)=205; (О)=238,8 Дж/мольК. Изменяется энтропия и при протекании химических процессов. Эти изменения обычно особенно велики в случае реакций, приводящих к изменению числа молекул газов: увеличение числа газовых молекул приводит к увеличению энтропии, уменьшение – к уменьшению энтропии. Например: N()+3H()2NН(). 4 моля 2 моля Энтропия данной системы в результате прохождения реакции уменьшается. Расчеты по вычислению величины изменения энтропии в результате протекания химической реакции (S) производятся по формуле: (т.е. от суммы энтропий продуктов реакции вычитают сумму энтропий исходных веществ). 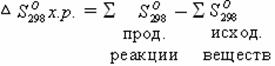 При расчете следует учитывать стехиометрические коэффициенты перед молекулами в реакции. Можно рассчитать энтропию реакции и сделать вывод о возможности самопроизвольного протекания реакции. Например: 2Fe()+3HO()FeO()+3H(); (Fe())=27,15 Дж/мольК; (FeO())=89,96 Дж/мольК; (HO())=130,52 Дж/мольК; (H())=188,72 Дж/мольК; =(89,96+(3188,72)-(227,15+3130,52=210,26 Дж/мольК. Энтропия увеличивается (S имеет положительное значение) значит реакция идет самопроизвольно. в начало Энергия Гиббса и направленность химических реакций. Из изложенного выше, можно сделать вывод, что движущей силой любого протекающего в природе процесса, в том числе и химического, являются два фактора (при T, P – ): 1) стремление системы перейти в состояние, характеризующееся наименьшим содержанием энергии (выделение тепла); 2) стремление системы к беспорядку, характеризуемое возрастанием энтропии. Т.е. энтальпийный и энтропийный факторы действуют одновременно. Взятые в отдельности эти факторы, не могут быть критерием самопроизвольного течения химической реакции. Суммарный эффект этих двух факторов в изобарно-изотермических условиях и определит направление химических процессов.Для процессов при T и P эти два фактора дают новую термодинамическую величину – энергию Гиббса(изобарно-изотермический потенциал). Измеряют в стандартных условиях, единица измерения кДж/моль. Для простых веществ =0 (например:(H)=0.) Рассчитывается энергия Гиббса по формуле: =– T. Как видно из формулы: изменение энтропии умножают на температуру (K). Первая причина: единицы измерения S и Н неодинаковые: НкДж/моль, а S Дж/мольК, умножая энтропию на температуру, мы имеем одинаковые единицы измерения. И вторая причина, энтропия зависит от температуры и это надо учитывать при расчетах. Итак, движущей силой самопроизвольного протекания химической реакции в изобарно-изотермических процессах является энергия Гиббса. Величину энергии Гиббса можно рассчитать: 1. По формуле, приведенной выше: 3. Исходя из табличных значений для сложных веществ: с учетом коэффициентов перед молекулами в реакции. Возможны три результата расчета и соответственно три варианта прохождения процесса: 1. G<0(–G) процесс идет самопроизвольно. 2. G>0(+G) процесс в прямом направлении самопроизвольно не идет. 3. G=0 устанавливается химическое равновесие. Электрохимия использует формулу из термодинамики, связывающую энергию Гиббса с ЭДС реакции: –G=, где – число электронов отданных одним атомом восстановителя, F число Фарадея (96500Кл), – ЭДС. Из формулы видно, что реакция возможна, когда положительная величина. Используя формулу =– T, можно вычислить Т равновесную, т.е. ту температуру, при которой в химической реакции наступит равновесие. Если G=0, то = T, значит: T=. Примеры расчетов: Вычислить при = и определить направление реакции: CaO()+CO ЭЛЕКТРОХИМИЯ Тема 12: ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ Электрохимия – раздел химии, изучающий химизм появления электрического тока в результате окислительно-восстановительных реакций на электродах. Электрохимию делят на два раздела: а) учение о химизме превращения химической энергии в электрическую (в гальванических элементах); б) учение о действии электрического тока на химические процессы (электролиз). Рассмотрим химические источники тока. Простейшая электрохимическая система состоит из двух электродов (проводник I рода) и ионного проводника (проводник II рода) между ними. Электроды замыкаются металлическим проводником. Ионным проводником служат растворы или расплавы электролитов, а также твердые электролиты. Электродаминазывают проводники, имеющие электронную проводимость (проводники I рода) и находящиеся в контакте с ионным проводником. Для обеспечения работы системы электроды соединяют друг с другом металлическим проводником, называемым внешней цепью электрохимической системы. 1. Принцип работы гальванического элемента (ХИТ). 2. Электродные потенциалы, ряд напряжений металлов. 3. Концентрационные цепи. Тема 13: ЭЛЕКТРОЛИЗ 1.Основные понятие и особенности электролиза. 2.Отдельные примеры электролиза растворов и расплавов солей. 3.Применение электролиза. 4.Закон Фарадея. Решение задач. | ||||||||||||||||||||||||||||||||||||||||||||
