ХИИИИИИИИМИИИИЯЯЯЯЯ. Тема 1 химия как наука и её значение в жизни человека
 Скачать 1.07 Mb. Скачать 1.07 Mb.
|
ДЕЙСТВИЕ СЕРНОЙ КИСЛОТЫ НА МЕТАЛЛЫРазбавленная серная кислота растворяет только активные металлы, т.е. реакции идут аналогично реакциям с хлороводородной кислотой. В результате реакции образуется соль металла (сульфат) и выделяется водород.
1 2 Fe0 - 2ē → Fe+2 процесс окисления Fe0 - восстановитель 1 2 2H+ + 2ē → H20 процесс восстановления Н+ - окислитель Fe + 2H+ → Fe2+ + H2 ЭДС = 0 – (-0,44) = 0,44 В Концентрированная серная кислотарастворяет металлы, стоящие в ряду напряжений металлов до серебра (включительно). Не растворяется золото и платиновые элементы (Рt, Os, Ru, Ir, Rh, Pd). 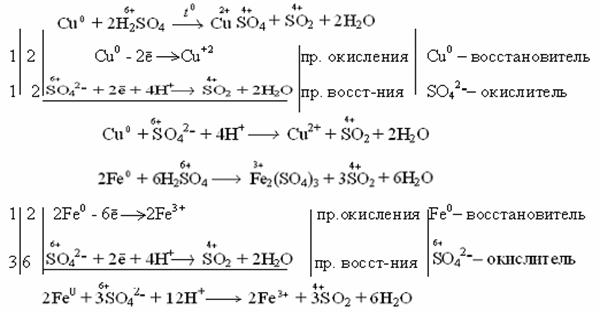 Окислителем в этом случае является сера со степенью окисления +6, которая в зависимости от активности металла и от условий (концентрация кислоты, температура) может восстанавливаться до серы +4, +0, -2. Таким образом, продуктами восстановления серы серной кислоты могут быть Например: неактивные и малоактивные металлы (Cu, Ag, Fe, Ni) восстанавливают серу +6 до серы +4 (SO2). Реакция идет при нагревании. Как видно из реакций, разбавленная серная кислота окисляет железо до +2, а концентрированная до +3. Более активные металлы восстанавливают серу +6 до свободной серы (S0) и сероводородной кислоты (H2S), где сера имеет степень окисления -2. 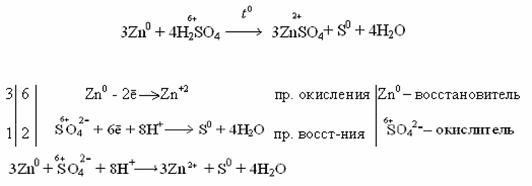 в начало ДЕЙСТВИЕ АЗОТНОЙ КИСЛОТЫ НА МЕТАЛЛЫАзотная кислота, являясь сильным окислителем, действует почти на все металлы (кроме Au, Pt, Ru, Rh, Ir, Os, Ta), превращая их в нитраты, а некоторые – в оксиды (пассивирование металлов). Особенность действия азотной кислоты на металлы заключается в том, что она окисляет металлы без выделения водорода даже из разбавленного раствора кислоты, в отличие от серной. Глубина восстановления азота из азотной кислоты зависит от концентрации последней и от активности взаимодействующего с ней металла. Чем больше разбавлена кислота и чем активнее металл, тем глубже идет восстановление. Азот кислоты восстанавливается 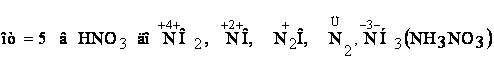 ÜРазберем некоторые примеры взаимодействия азотной кислоты с металлами. При взаимодействии концентрированной азотной кислоты с неактивными металлами выделяется NO2: 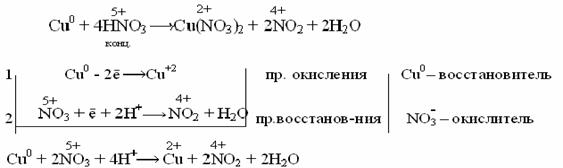 Разбавленная азотная кислота с малоактивными и неактивными металлами (Pb, Cu, Ni, Ag, Fe) образует NO: 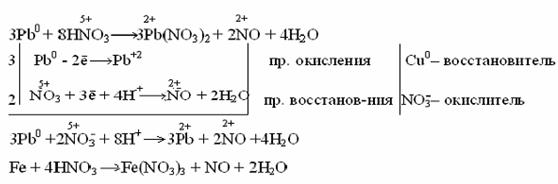 Очень разбавленная азотная кислота восстанавливается до аммиака (NH3) при взаимодействии с очень активным металлом, образующим в кислой среде ион аммония NH4+: 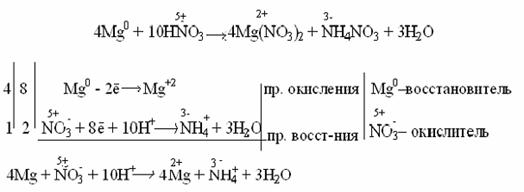 Концентрированная кислота пассивирует некоторые металлы (Al, Cr, Fe), что выражается в покрытии металлов тонкой оксидной пленкой: Поэтому концентрированную азотную кислоту перевозят в алюминиевых цистернах, а разбавленную – в цистернах из кислотоупорной стали. Металлы способны вытеснять друг друга из растворов солей. Возможность прохождения таких реакций определяется положением металлов в ряду напряжений: более активные металлы вытесняют из растворов их солей менее активные. Например: Zn + CuSO4 → ZnSO4 + Cu. в начало | ||||
