Учебник для медицинских и фармацевтических вузов Под ред. В. А. Черешнева и В. В. Давыдова. М. Издво, 2006. 1050 с
 Скачать 3.85 Mb. Скачать 3.85 Mb.
|
11.3. КЛАССИФИКАЦИЯ И ХАРАКТЕРИСТИКА ОСНОВНЫХ ВИДОВПОВРЕЖДЕНИЯ КЛЕТОКРазличают следующиеосновные виды повреждений клеток:
Острое повреждение клеток под влиянием патогенных факторов и неблагоприятных внешних и внутренних условий возникает быстро (секунды, минуты, часы, дни), хроническое – медленно (недели, месяцы, годы). При парциальномповреждении выходит из строя та или иная незначительная часть клетки, которая в целом остается жизнеспособной, а повреждения являются обратимыми. При субтотальномповреждении страдает большая часть клетки, жизнеспособность которой резко снижается, а повреждения нередко являются необратимыми. При тотальномповреждении наступает необратимая гибель всей клетки. Обратимые поврежденияклеток после прекращения действия патогенного агента не сопровождаются их гибелью. Возникающие при них нарушения внутриклеточного гомеостаза являются обычно незначительными и временными. Они устраняются благодаря активизации внутри- и внеклеточных защитно-компенсаторно-приспособительных механизмов. В итоге жизнедеятельность клетки восстанавливается. Например, как при воздействии эритемной дозы ультрафиолетовых лучей (вызывающей покраснение кожи), как и при кратковременном уменьшении кровотока (ишемии) в коже или во внутренних органах возникающие в клетках незначительные, частичные изменения метаболизма, структуры и функций через определенное время восстанавливаются до нормального уровня. Необратимые поврежденияклеток характеризуются выраженными и стойкими нарушениями внутриклеточного гомеостаза. Последние не могут быть устранены даже максимальной активизацией защитно-компенсаторно-приспособительных механизмов в еще оставшихся жизнеспособными поврежденных внутри- и внеклеточных структурах. Например, при длительных или резко выраженных влияниях на организм ультрафиолетовых и инфракрасных лучей, радиоактивных и токсических веществ, ишемии миокарда, головного и спинного мозга в различных клетках, тканях и органах организма возникают грубые расстройства структуры, метаболизма и функций последних, приводящие к снижению их продолжительности жизни и гибели (некрозу). Гибель клеток обычно сопровождается аутолизом (благодаря выходу из лизосом и активизации гидролитических ферментов). Однако в ряде случаев гибель клеток и тканей может возникать без развития аутолиза. Это происходит тогда, когда смерть целого организма наступает быстро (внезапно), например, при действии на организм очень высоких или низких температур окружающей среды. Специфическиеповреждения клеток являются характерными для того или иного конкретного патогенного фактора. Например, к специфическим проявлениям повреждения клеток можно отнести: 1) развитие иммунного гемолиза эритроцитов при наличии в организме антиэритроцитарных антител; 2) угнетение активности холинэстеразы фосфорорганическими соединениями; 3) подавление моноаминооксидазы ее ингибиторами и др. Неспецифические (стереотипные) повреждения клеток возникают под влиянием различных по этиологии и патогенезу патогенных факторов. Например, к неспецифическим проявлениям повреждения клеток относятся:
11.4. Морфологические и функциональные проявления повреждений клеток К морфологическим признакам повреждения клетокотносят:
К функциональным признакам поврежденияклеток относят:
11.5. Основные типы клеточных реакций в патологии Среди них наиболее часто выделяют следующие:
11.6. Ишемическое повреждение клетки Большую роль в механизмах повреждения клеток, наиболее часто возникающих при ишемии, реперфузии, гипоксии и интоксикации структур различных уровней организации организма играют недостаток кислорода, макроэргов и избыток содержания в клетках ионов кальция и натрия.В частности, при развитии ишемии (местного малокровия) в клеточно-тканевых структурах обязательно в большей или меньшей степени возникают разнообразные метаболические, структурные и физиологические нарушения (схема 11-1). Тяжесть ишемического повреждения клеток завсисит от степепени нарушения кровообращения, сохранения выведения метаболитов из органа, вида органа, продолжительности ишемии и температуры среды. При ишемическом повреждениии клеток нарушается их энергообеспечение: синтез АТФ, транспорт энергии АТФ от места продукции к эффекторным структурам клеток, утилизации энергии АТФ. Нарушение синтеза АТФ. Клетка реагирует пр этом мобилизацией энергии из внеклеточных запасов (использование богатых энергией креатинфосфата, гликогена, глюкозы, триглицеридов), активацией гликолиза, уменьшением потребления энергии за счет ограничения функциональной активности клетки, ограничения транспорта ионов и химических процессов синтеза. Активацию гликолиза можно рассматривать как один из механизмов компенсации. Однако увеличение интенсивности гликолиза сопровлждается активацией фермента глицеральдегид-3-фосфатдегидрогеназы, что приводит к гиперпродукции восстановленных форм никотинамидадениндинуклеотида (НАДН) и никотинамидадениндинуклеотид фосфата (НАДФН). Накопление в клетке продуктов гидролиза АТФ, СЖК, их производных, НАДН, НАДФН приводит к развитию внутриклеточного ацидоза. Нарушение транспорта энергии АТФ. Это проявляется результатом повреждения ферментных механизмов транспорта энергии макроэргических фосфатов. Главным образом, аденинуклеотид-транслоказы (АТФ/АДФ-транслоказы), осуществляющей перенос молекул АТФ из матрикса в цитозоль, и изомеров креатинфосфокиназы (КФК), обеспечивающих доставку макроэргических фосфатов от митохондрий к местам их утилизации. Нарушение утилизации АТФ за счет снижения активности АТФазы эффекторных стуктур поврежденной клетки и митохондрий, Na+/K—АТФазы сарколеммы и Са2+-АТФазы саркоплазматического ретикулума. 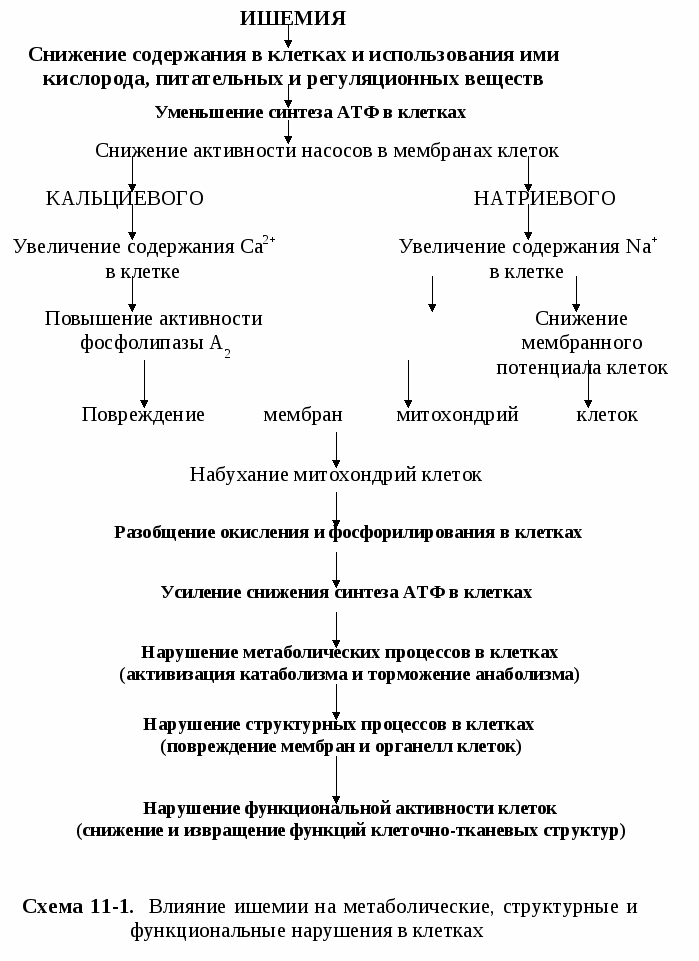 Гидратация клеток 11.7. Реперфузионное повреждение клетки Восстановление кровообращения в ткани после кратковременной ишемии, как правило, приводит к полному восстановлению структуры и функций поврежденных клеток. Однако восстановление кровообращения после длительной ишемии может привести к развитию так называемого реперфузионного повреждения. В механизме развития реперфузионного повреждения клеток основное значение имеют:
Реперфузионное повреждение клеток сопровождается большей интенсификацией ПОЛ мембран, большим накоплением в клетках ионов кальция и натрия, большим повреждением мембран и ферментных систем, чем при ишемии той же длительности. После реперфузии длительно ишемизированного органа или группы органов может возникнуть ишемический шок (синдром жгутированных конечностей, синдром сдавления конечностей). 11.8. Общие механизмы повреждения клеток Они могут быть следующими:
Особое место в патогенезе повреждения клеток занимают механизмы повреждения клеточных мембран. Последние относятся, главным образом, к повреждениям углеводных (полисахаридных), белковых и, особенно, липидных компонентов клеточных мембран. К наиболее важным патогенетическим факторам повреждения липидных компонентов мембран относятся: 1) активизация процессов перекисного окисления ненасыщенных жирных кислот и фосфолипидов (возникающая в результате угнетения супероксиддисмутазы, каталазы, пероксидазы, восстановленного глутатиона), 2) активация мембранных фосфолипаз, 3) осмотическое растяжение мембран набухших клеток, 4) увеличение абсорбции полиэлектролитов на липидном бислое, 5) повреждающее действие макромолекул (иммуноглобулинов и иммунных комплексов) через активацию системы комплемента (процессов протеолиза) и др. 11.9. ОБЩИЕ РЕАКЦИИ ОРГАНИЗМА НА ПОВРЕЖДЕНИЕ КЛЕТОК Повреждения клеток в зависимости от их характера, локализации, интенсивности и продолжительности, наряду с местными изменениями, обычно сопровождаются разными механизмами развития клинических проявлений, общими реакциями. К последним относятся активация протеолитических (кининовой, калликреин-кининовой, фибринолитической) систем плазмы крови, дистресс, реакции «острой фазы», лихорадка, обморок, коллапс, шок и кома. Общие, как и местные, реакции организма в ответ на действие тех или иных повреждающих клеточно-тканевые структуры факторов сопровождаются при различной патологии и явлениями полома, и явлениями защиты, компенсации и приспособления. Выраженность и соотношение процессов и явлений полома, с одной стороны, и защитно-приспособительных процессов и явлений, с другой стороны, определяют не только клиническую картину, но и исход, и прогноз конкретного вида патологии, возникшего в целостном организме под действием разнообразных патогенных факторов. 11.10. МЕХАНИЗМЫ ЗАЩИТЫ, КОМПЕНСАЦИИ И АДАПТАЦИИ ПОВРЕЖДЕННЫХ КЛЕТОК Последние могут быть активными и пассивными. К активным механизмам относятся:
К пассивным механизмам относятся:
11.11. ОСНОВНЫЕ ВИДЫ ПОВРЕЖДЕНИЯ КЛЕТОК Одним из проявлений повреждения клеток является дисплазия. 11.11.1. Дисплазии Дисплазии (от греч. dys – нарушение, расстройство, plaseo – образую) – нарушения процесса развития клеток, которое проявляется выраженным и длительным изменением их структуры, функций и в целом жизнедеятельности, в том числе продолжительности жизни. Обычно это стойкие наследуемые изменения клетки, возникающие в результате повреждения тех или других структур наследственного аппарата (генов, хромосом, генома) клетки, но могут быть и приобретенными в процессе онтогенеза, главным образом, в эмбриональный и фетальный периоды. В патогенезе дисплазии важное место занимает расстройство процессов дифференцировки клеток, определяющих их структурную, метаболическую и функциональную специализацию. Структурными проявлениями дисплазий являются изменения строения (числа, формы и величины клеток) и внутриклеточных органелл, а также их мембран. В частности, могут появляться клетки большого размера, имеющие неправильную форму и диспропорциональное соотношение органелл в них (например, появление мегалобластов при пернициозной анемии; серповидных эритроцитов при патологии гемоглобина (появление HbS, приводящего к развитию серповидно-клеточной анемии; огромных нейронов при туберозном склерозе коры головного мозга и т.д.). В таких клетках могут одновременно отмечаться различные признаки дистрофий. Клеточные дисплазии явялются одним из обязательных проявлений атипизма опухолевых клеток. Наиболее часто повреждения клеток проявляются в виде дистрофий. 11.11.2. Дистрофии Дистрофии (от греч. dys – нарушение, расстройство, trophe – питаю) – это такие изменения состава клеточно-тканевых структур, которые обусловлены нарушениями в них процессов метаболизма (обмена веществ) и ведущие к накоплению или уменьшению тех или иных веществ (соединений), либо к появлению веществ, которые в норме не встречаются. Механизмы развития дистрофий В возникновении дистрофий различных видов важное место отводят следующим механизмам. Клеточная энзимопатия (наследственная или приобретенная как в пре-, так и в постнатальный периоды онтогенеза), вызывающая состояние дисметаболизма, возникающая в результате либо избыточного, либо недостаточного, либо извращенного синтеза того или иного метаболита. Трансформация клеточного метаболизма. Химическое превращение одних веществ в другие. Декомпозиция. Нарушения ультраструктуры (физико-химических свойств) мембран клеток и субклеточных структур (ядра и других органелл), среди которых особое место занимают разрушение отдельных составных частей (например, белково-липидных комплексов) клеток. Инфильтрация. Избыточное пассивное поступление веществ из межтканевой жидкости в клетку. Эндоцитоз. Избыточная активная резорбция веществ в клетку. Снижение поступления веществ из межтканевой жидкости или крови в клетку. Смешанный вариант. Классификация дистрофий Выделяют следующие основные виды дистрофий. По времени развития различают:
По распространенности дистрофические процессы бывают местными и общими, которые могут быть в объеме:
По структурному уровню дистрофии могут быть:
По преобладанию морфологических изменений в паренхиме или мезенхиме выделяют дистрофии:
По преобладанию нарушений того или иного обмена веществ в паренхиме или мезенхиме различают дистрофии:
а) протеинозы или белковые – зернистая, вакуольная (гидропическая), гиалиново-капельная, роговая и др.; б) липидозы или жировые; в) глюцидозы или углеводные; г) минералозы или минеральные; д) калькулезы, литиазы – образование камней;
а) протеинозы – гиалиноз (гомогенные белковые массы, содержащие особые гликопротеиды), амилоидоз – белковые массы, содержащие специфические гликопротеиды: комплекс глобулинов и полисахаридов), б) липидозы, в) глюцидозы. 3) смешанные, к которым относятся: а) хромопротеидозы, б) нуклеопротеидозы, в) минералозы и др. В качестве иллюстрации рассмотрим наиболее часто встречающиеся виды белковой паренхиматозной дистрофии. Характеристика зернистой дистрофии Внутренние органы (сердце, печень, почки и др.) увеличиваются в размерах, набухают, становятся более бледными, малокровными: функции их снижаются, но не сильно. Микроскопически характеризуются увеличением клеточных элементов в размерах и появлением в цитоплазме мелких белковых зерен. Последние включают набухшие митохондрии; мельчайшие вакуоли с белковой оболочкой, заполненные водой, электролитами и ферментами; денатурированные цитоплазматические белки; распавшиеся липопротеидные комплексы (Рис. 11-1). Этиология. Наиболее частыми этиологическими факторами считаются: - инфекционные (возбудители дифтерии, скарлатины, тифа, пневмоний), - токсические (отравление грибами, змеиным ядом, мышьяком, фосфором), - биологические (паразиты, микробы, риккетсии, микоплазмы, вирусы), - местные расстройства кровообращения, - авитаминозы, - пищевое (полное, неполное, частичное) голодание. 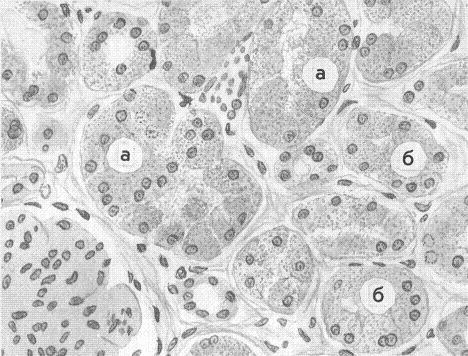     Рис.11-1. Зернистая дистрофия эпителия почечных канальцев. Цитоплазма нефроцитов зерниста (а) в результате скопления белковых гранул; просветы канальцев сужены (б). Патогенез. Основными патогенетическими факторами являются: - нарушение белково-водно-электролитного обмена, - повышение проницаемости клеточных и субклеточных мембран, - распад липопротеидных комплексов, - активация гидролитических ферментов и др. При ранней ликвидации причинных факторов данный процесс обратим. Однако при длительном действии патогенных факторов на клетки и ткани дистрофия в них и расстройства их функции прогрессируют. Сначала развивается паранекроз, далее - некробиоз и, наконец, - некроз. Характеристика вакуольной гидропической дистрофии Внешний вид органа (также как и при зернистой дистрофии) мало изменен. Микроскопически, как видно на рис. 11-2, характеризуется набуханием клеток и появлением в их цитоплазме (реже в ядре) сначала мелких, потом более крупных вакуолей, наполненных цитоплазматической жидкостью (вода, белки, ферменты). По мере увеличения воды вакуоли сливаются друг с другом, образуя пузырьки с оттесненным на периферию ядром, либо его лизисом или рексисом. Чаще наблюдается в эпителии кожи, почечных канальцах, клетках печени, мышц, коры надпочечников, нервных структур.   Этиология.Среди этиологических факторов особое место в повреждениях клеток (кожи и слизистых) занимают термические факторы, возбудители натуральной оспы (эпидермис кожи), бешенства (нервные клетки) и других инфекций, а также голодание, особенно белковое, приводящее к кахексии, различные виды интоксикаций, авитаминозов и др. Патогенез. Основными патогенетическими факторами являются: - нарушение белково-водно-электролитного обмена, - повышение проницаемости клеточных и субклеточных мембран, - распад липопротеидных комплексов, - активация гидролитических ферментов и др. При ликвидации причинных факторов процесс может быть обратимым. Функция органа резко снижается. Однако в далеко зашедших случаях процесс обычно необратим. Характеристика гиалиново-капельной дистрофии Внешний вид органов (почек, печени, миокарда) изменен мало. Микроскопически характеризуется наличием в цитоплазме крупных гиалиново-подобных белковых капель, сливающихся между собой, и развитием деструкции ультраструктуры клеток (рис. 11-3). Этиология.Чаще всего этот вид дистрофии возникает под влиянием биологических (бактерий, вирусов), токсических и разнообразных длительно действующих флогогенных и других патогенных факторов. Патогенез.В механизмах развития данной дистрофии важное значение имеют: - глубокая денатурация белков цитоплазмы, - инфильтрация тела клетки грубодисперсными белками, - разрушение ультраструктур клеток и др., - функция органа резко нарушена. Процесс необратим.  Рис. 11-3. Гиалиново-капельная дистрофия эпителия проксимальных канальцев почек. (а) – скопление белковых тел. Исходы дистрофий Дистрофический процесс может быть как обратимым, так и необратимым. Возможен переход либо в паранекроз, либо в некробиоз, либо в некроз. Паранекроз – состояние клеток и тканей, приближающееся к некробиозу, развивающееся вследствие дистрофических изменений и являющееся обратимым. Характеризуется помутнением цитоплазмы, возникновением грубодисперсных осадков, повышением вязкости коллоидов, уменьшением дисперсности, усилением сорбционных свойств и изменением электролитного состава цитоплазмы и ядра, а также вакуолизацией клетки, повышением проницаемости цитоплазматической мембраны для различных веществ, в том числе, для красителей. Некробиоз – состояние тканей (клеток), находящееся между жизнью и смертью и предшествующее некрозу и развивающееся вследствие необратимых дистрофических процессов. Длительность некробиоза разная в зависимости от характера повреждающих факторов, вида и состояния повреждаемых тканей. Некроз – омертвение клеточно-тканевых структур части тела, наступающее при жизни целостного организма, и обусловленное действием различных повреждающих факторов. Некроз необходимо отличать от физиологического отмирания (умирания) клеток, наступающего вследствие их естественного, наследственно обусловленного, запрограммированного старения и изнашивания (апоптоза). Процесс апоптоза в условиях действия на организм повреждающих факторов, как правило, ускоряется, а восстановительные процессы в погибающих клетках – замедляются. 11.11.3 Виды некроза и их характеристика Различают сухой и влажный некроз. Сухой (или коагуляционный) некроз характеризуется макро- и микроскопическими нарушениями тканей и органов, представленных на рис 11-4. Этот вид некроза сопровождается отсутствием или резким уменьшением кровоснабжения тканей и количества содержащейся в ней влаги. 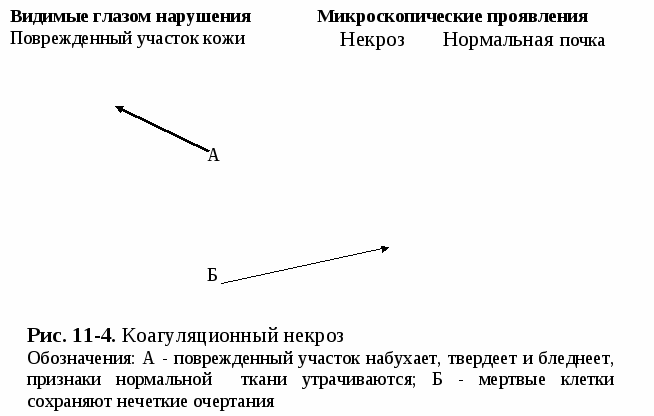 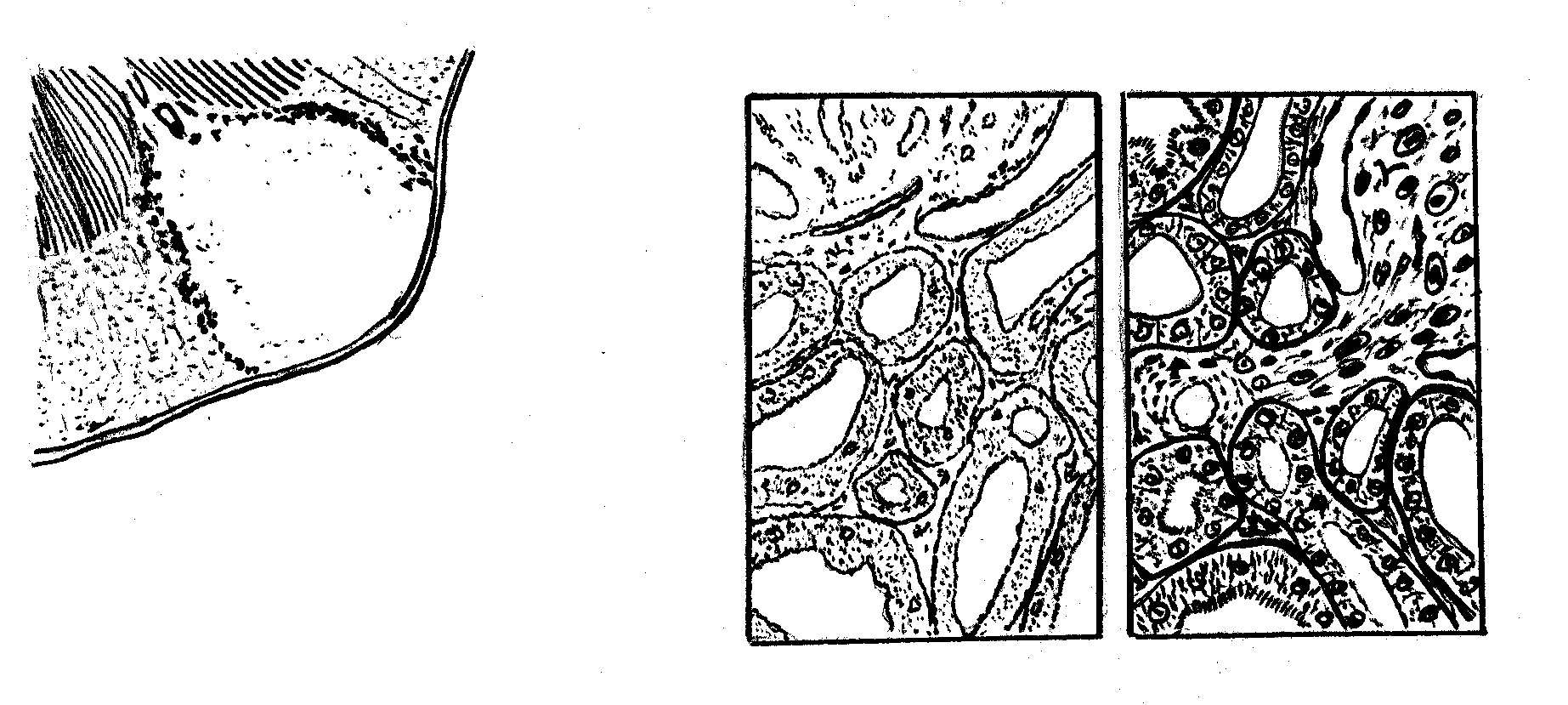 Влажный (или колликвационный) некроз сопровождается увеличением кровоснабжения тканей и количества содержащейся в ней влаги. Разновидностью некроза является гангрена (омертвение частей живого тела, имеющих непосредственное соприкосновение с внешней средой, которая во многом определяет исход некроза). Гангрена развивается чаще в дистальных частях конечностей, выступающих частях головы, матке. Различают сухую и влажную гангрену. При первой мертвые ткани высыхают (мумифицируются) и хорошо отграничиваются от здоровых. При второй в результате гнилостного (микробного) распада омертвевшие ткани увлажняются, гниют, что приводит к общей интоксикации и малой склонности к отграничению от здоровых тканей. Морфологические признаки некроза появляются не сразу, а спустя некоторое время, в связи с развитием в омертвевших тканях аутолитических процессов. Скорость их развития зависит от характера повреждающего фактора и вида поврежденных тканей. Морфологические признаки некроза быстрее обнаруживаются в тканях центральной нервной системы, семенниках, покровном эпителии, эпителии паренхиматозных органов, позже – в мышцах, волокнистой соединительной ткани, жировой клетчатке, а еще позже – в костях. В очагах некроза циркуляторного происхождения эти признаки обнаруживаются позже, чем в очагах травматического некроза. Ранним, главным или основным признаком некроза тканей является изменение (уменьшение, исчезновение) ядер, в первую очередь их нуклеотидов. Изменения ядра (рис. 11-5) могут быть в виде кариолиза (обесцвечивания и растворения ядра), кариопикноза (уменьшения, уплотнения, сморщивания ядра), кариорексиса (фрагментация ядра, разрыв на мелкие глыбки, вплоть до пылевидной зернистости). Затем наступают изменения со стороны цитоплазмы, которые могут быть в виде: плазмолиза (вакуолизации и разжижения), плазмокоагуляции (уплотнения), плазморексиса (распада цитоплазмы на глыбки и др.). 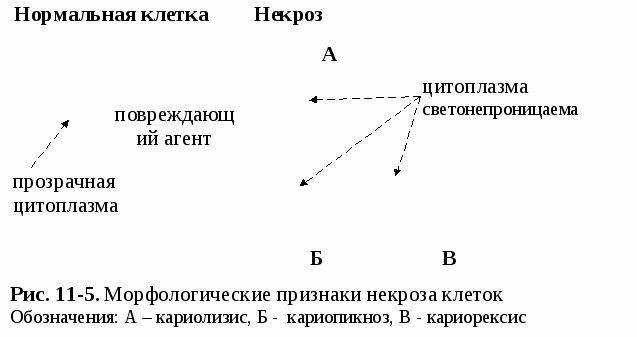 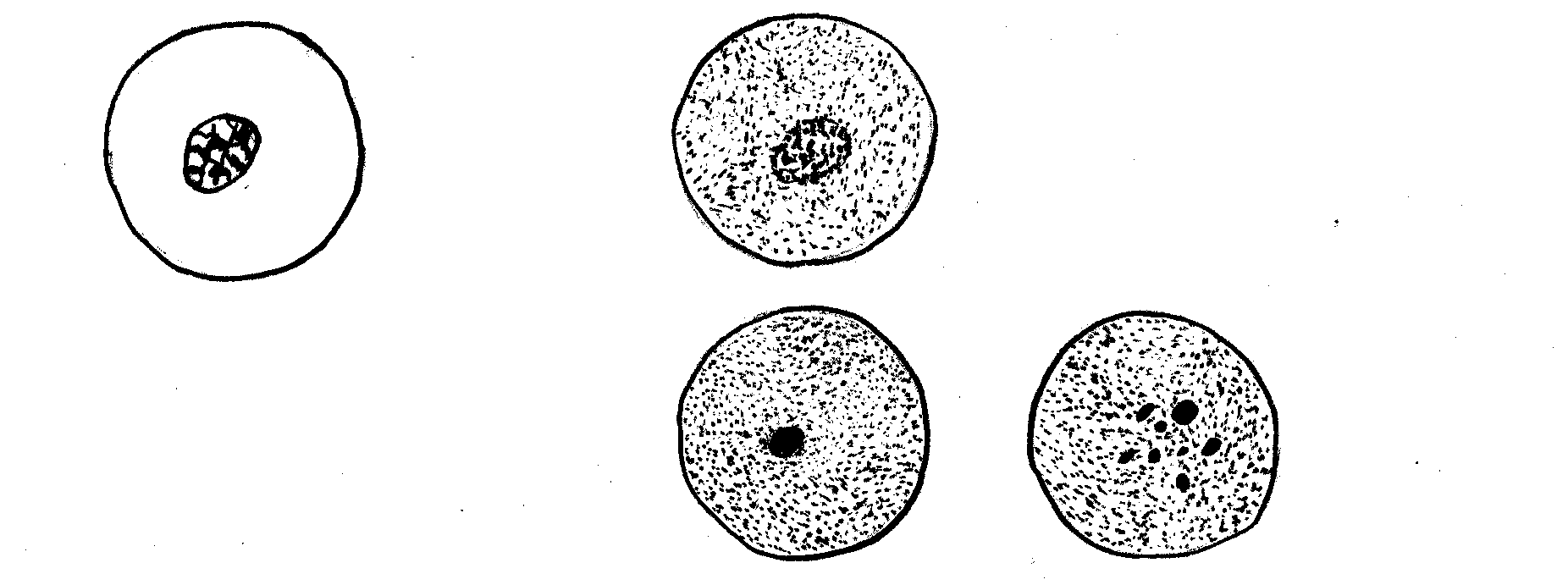 Значение некроза тканей для организма огромно. С одной стороны, функции омертвевших тканей полностью прекращаются, с другой стороны, омертвевшие ткани могут быть причиной повреждения других тканей, происходящего за счет увеличения продуктов их повреждения, образования ФАВ, тканевых гормонов, метаболитов. Исход некроза зависит от вида и объема повреждения, а также от вида ткани. В частности, он может быть следующим:
Современным методом диагностики и прогноза различных, в том числе деструктивных, заболеваний и контроля за эффективностью их лечения является биопсия органов, т.е. прижизненное взятие поврежденных и живых кусочков их на гистологический анализ. 11.12. ОСОБЕННОСТИ ДЕЙСТВИЯ ЛЕКАРСТВЕННЫХ СРЕДСТВ В ПОВРЕЖДЕННЫХ КЛЕТОЧНО-ТКАНЕВЫХ СТУРТУРАХ Основными среди них являются следующие: - расстройства поглощения лекарственных средств; - изменение поступления, распределения, превращения (метаболизма), утилизации и выведения (фармакокинетики) лекарств; - изменение эффекта действия (фармакодинамики) лекарств; - формирование различных форм лекарственной непереносимости; - развитие толерантности (невосприимчивости) к лекарственным средствам. 11.13. ПРИНЦИПЫ ПОВЫШЕНИЯ УСТОЙЧИВОСТИ КЛЕТОК К ДЕЙСТВИЮ ПОВРЕЖДАЮЩИХ ФАКТОРОВ И СТИМУЛЯЦИИ ВОССТАНОВИТЕЛЬНЫХ ПРОЦЕССОВ В ПОВРЕЖДЕННЫХ КЛЕТКАХ Среди них с целью частичной или полной нормализации метаболических, структурных и функциональных расстройств поврежденных клеток выделяют следующие лечебно-профилактические воздействия:
ГЛАВА 12. АПОПТОЗ И ЕГО РОЛЬ В ПАТОЛОГИИ |
