Биохимия тканей. Учебное пособие Чита, 2015 ббк 28. 07252. 5 Удк 577. 1 616008 Никитина Л. П., Гомбоева А. Ц., Соловьева Н. В
 Скачать 2.39 Mb. Скачать 2.39 Mb.
|
|
Глава 2. Кровь – вариант соединительной ткани Кровь – жидкая соединительная ткань, включающая суспензию клеток (форменных элементов) в концентрированном растворе белков (альбуминов, глобулинов), образующая волокнистые структуры при свёртывании. 2.1. Физиологические функции крови Среди функций можно выделить: дыхательную, которую выполняют эритроциты, захватывая в лёгких кислород и перенося его к тканям, а в обратном направлении – углекислый газ; питательную – с помощью плазмы осуществляется доставка к клеткам многочисленных необходимых соединений: витаминов, различных ионов, углеводов, аминокислот, высших жирных кислот и их производных; терморегуляторную - плазма крови обладает высокой удельной теплоёмкостью и одновременно хорошей теплопроводностью, что увеличивает потери тепла при испарении воды с поверхности кожи; защитную – а) элементы свёртывающей системы крови защищают организм от неадекватных кровопотерь; б) групповая специфика крови; в) специфический иммунитет – за счёт гамма-глобулинов и других иммунных белков (гуморальный), и неспецифический – с помощью фагоцитоза (нейтрофилов, моноцитов); регуляторную – плазмой крови к клеткам-мишеням транспортируются различные биологически активные вещества (дистантные и тканевые гормоны, витамины); выделительную – продукты метаболизма тканей током крови доставляются к соответствующим системам; поддержание критериев гомеостаза – онкотического давления с помощью белков, осмотического – за счет ионов, низкомолекулярных соединений; кислотно-основного состояния (КОС) с использованием буферных систем (бикарбонатов, фосфатов, протеинов). 2.2. Плазма крови Жидкое межцеллюлярное вещество – плазма – на 90% состоит из воды, 9% приходится на органические соединения и только около 1% на минеральные структуры. Основной вклад в массу первых вносят белки, выполняющие транспортную функцию, а также участвующие в иммунных реакциях и свертывании крови. Среди протеинов – переносчиков особая роль принадлежит альбуминам, которые связывают мало- или нерастворимые метаболиты (ВЖК, стероидные гормоны, билирубин). Компоненты фракции глобулинов используются в иммунном ответе (иммуноглобулины, белки α2 системы комплемента). Гликопротеины (α2-макроглобулины) нейтрализуют токсический эффект ферментов, выделяющихся при повреждении мембран клеток, при воспалении. Белки – коагулянты (фибриноген) и антикоагулянты (антитромбин III) в комплексе с подобными по функции макромолекулами обеспечивают равновесие между процессами формирования и разрушения тромба. 2.3. Клетки крови Форменные элементы крови: эритроциты, лейкоциты, тромбоциты. Последние представляют из себя фрагменты цитоплазмы находящихся в красном костном мозге мегакариоцитов. Кровяные пластинки окружены толстым слоем гликокаликса, богатого кислыми ГАГами. С помощью этих образований возникают фибриллярные мостики между мембранами соседних тромбоцитов при их агрегации. Роль рецепторов адгезии и агрегации выполняют гликопротеины цитолеммы. Содержимое матрикса включает много митохондрий, рибосом, а на периферии регистрируются актин, миозин и другие контрактильные белки, участвующие в округлении тромбоцита и ретракции сгустка. Эти форменные элементы используются в восстановлении стенки сосуда, секретируя ангиогенные факторы. Клетки шаровидной формы – лейкоциты – могут содержать гранулы; в зависимости от этого различают гранулоциты (нейтрофилы, базофилы, эозинофилы) и агранулоциты (моноциты, лимфоциты). В целом лейкоциты участвуют в защитных реакциях: уничтожают микроорганизмы, захватывают инородные частицы и продукты распада тканей, осуществляют этапы гуморального и клеточного иммунитета. Эти клетки имеют в качестве облигатных компонентов сократительные белки (актин, миозин), что позволяет им выходить из кровеносных сосудов и активно перемещаться в тканях. До 70% общего количества лейкоцитов составляют нейтрофилы, при инфицировании их количество может увеличиваться в десятки раз. Распад гликогена, находящегося в цитоплазме, позволяет клеткам существовать в поврежденных тканях, обеднённых О2. В отличие от тромбоцитов митохондрий в них мало. Основная функция нейтрофилов - фагоцитоз и уничтожение микроорганизмов. Для этих целей клетка окружает частицу и образует фагосому, затем выбрасывает туда ферменты лизосом (лизоцим, эластазу, катепсин и другие гидролазы) и пероксисом (пероксидазы), с помощью последних происходит респираторный взрыв, в основе его одномоментное образование АФК (О2˙־, НО˙, Н2О2), приводящее к гибели фагоцита (гнойные клетки). На эозинофилы приходится до 1-5% лейкоцитов, они способны мигрировать в ткани, контактирующие с внешней средой (слизистые оболочки ЖКТ, дыхательных, мочеполовых путей), где участвуют в аллергических, воспалительных реакциях, в уничтожении паразитов, используя респираторный взрыв и выделения содержимого гранул. Ещё меньший вклад в копилку форменных элементов вносят базофилы (0-1%), в гранулах которых содержатся гистамин, гепарин, медиаторы воспаления. При встрече с аллергеном базофил активируется иммуноглобулином Е, повторный контакт базофил провоцирует их агрегацию, сопровождающуюся быстрым экзоцитозом содержимого гранул. Самые крупные из лейкоцитов – моноциты (2-9 %) – фактически незрелые клетки, находящиеся на пути из костного мозга в ткани. Если в организме имеется очаг воспаления или разрушения, – то вещества, в нём образующиеся, активируют моноциты, ещё больше увеличивают их размеры и стимулируют выделение ими БАВ (интерлейкина 1, простагландинов, факторов хемотаксиса нейтрофилов, лизосомных ферментов, АФК), что обеспечивает выполнение функции – фагоцитоза. Лимфоциты составляют 20-45% общего числа лейкоцитов, циркулирующих в крови. Выделяют Т, В-лимфоциты и NК-клетки. Больше всего содержится элементов первого типа, они уничтожают аномальные структуры организма, участвуют в аллергических реакциях, в отторжении чужеродного трансплантата. Активированные В-лимфоциты вырабатывают соответствующие антитела против конкретных антигенов. NК-клетки содержат цитолитические гранулы с перфорином, вызывают гибель трансформированных, инфицированных вирусами и чужеродных клеток. Особую роль среди форменных элементов крови играют малые по объёму, но огромные по количеству образования – эритроциты. 2.4 Эритроциты – важнейшие форменные элементы крови Эритроциты, лейкоциты, тромбоциты и их источник – кроветворная ткань – эмбриогенетически имеют мезенхимальное происхождение и являются разновидностью соединительной ткани. Около половины объёма крови приходится на красные кровяные тельца. В общем пуле эритроцитов на долю молодых приходится 5%, зрелых – 85%, стареющих – 10%. Их функции заключаются в следующем: за счёт карбоангидразы осуществляется взаимодействие диоксида углерода с водой и транспорт углекислоты. Велика роль ионного обмена между эритроцитами и плазмой (обмена протонов на катионы натрия) в регуляции КОС и электролитного баланса организма. Огромна ёмкость гемоглобина как буферной системы. Красные кровяные тельца служат адсорбентами для иммунных комплексов, физиологически предохраняют сосудистую стенку от развития иммунных васкулитов. 2.4.1. Строение мембран эритроцитов Зрелые красные кровяные тельца обладают двояковогнутой формой и большой способностью к деформации, благодаря чему эффективно обеспечивают процессы диффузии газов и могут проходить по просвету капилляров, диаметр которых в 3-4 раза меньше самих эритроцитов. Подобное свойство обусловлено особенностями в структуре мембран этих форменных элементов. Принципы строения цитолеммы эритроцитов классические: основу составляет билипидный слой, в который включены различные протеины. Наружная часть липидов представлена фосфатидилхолином, сфингомиелином, внутренняя поверхность обогащена фосфатидилсерином, фосфатидилэтаноламином, более четверти объёма приходится на ХС, снижающий деформируемость красных кровяных телец. В тоже время их мембраны обеднены фосфолипазами, в связи с чем при альтерации в отличие от других клеток практически не включаются механизмы продукции медиаторов арахидонового каскада. К цитозолю обращена плотная анастомозирующая белковая сеть, состоящая из спектринов, анкиринов, актинов, тропомиозинов, белков 3, 4-й полос, аддуцинов (Рис. 2.1), которые связываясь с интегральными гликопротеидами (гликофоринами), создают жёсткость мембраны и определяют форму эритроцита. 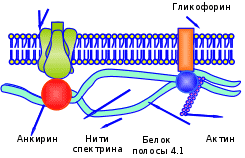 Полоса 3 Рис. 2.1. Белки мембран эритроцитов От степени фосфорилирования спектринов зависит эластичность сети, способность к упругой деформации. Гликофорины, пронизывая липидный слой, с помощью гидрофобных взаимодействий с ФЛ прочно фиксируются; сиаловые кислоты, располагаясь на поверхности цитолеммы форменного элемента, служат групповыми веществами крови: для О(Н) антигена детерминанта фукоза, для А–антигена – N-ацетилгалактозамин, для В – галактоза. Углеводные остатки гликофоринов являются также носителями антигенов групп крови МN-типа и ряда других иммунологических детерминант, служат рецепторами для вирусов гриппа. Присутствие сиаловых кислот придаёт эритроцитам отрицательный заряд, что не позволяет им сближаться и склеиваться. В противном случае усиливается их агрегация, образуются «монетные столбики», провоцируется гемостаз. 2.4.2. Особенности метаболизма эритроцитов Несмотря на отсутствие ядра и других органоидов, красные кровяные тельца – метаболически активные образования, обладающие спонтанной энергопродукцией на уровне 80 пДж на клетку. Энергетика эритроцита основана на анаэробном гликолизе (Рис.2.2). Около 10% всей глюкозы, содержащейся в крови, потребляется этими структурами и её поступление не зависит от присутствия инсулина, осуществляясь путем облегченной диффузии. В процессе Эмбдена-Мейергофа глюкоза распадается до лактата с образованием АТФ путём субстратного фосфорилирования. Кроме того, метаболиты гликолиза работают в следующих направлениях. Его восстановительные потенциалы НАДН при необходимости используются метгемоглобинредуктазой для восстановления железа в метгемоглобине. В отличие от других тканей в эритроцитах в гликолизе возникает много 2,3-дифосфоглицерата (2,3-ДФГК), который служит важным модулятором сродства Нb к О2. Некоторые морфобиохимические особенности красных кровяных телец предопределяют необходимость в высокой антиоксидантной активности: необычные концентрации О2 увеличивают вероятность образования его активных форм; большое содержание ионов переходного металла – железа, может способствовать его использованию в качестве донора электронов (Рис. 2.2); для обеспечения упругой деформации билипидный слой мембран обогащён ПНЖК – субстратами ПОЛ. 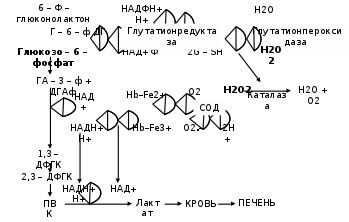 Рис. 2.2. Схема гликолиза и антирадикальной защиты в эритроците Для контроля интенсивности СРО в цитоплазме эритроцитов активно работает антирадикальная защита. Если нарушаются условия диссоциации оксигемоглобина, то происходит отрыв электрона от двухвалентного железа гема с образованием метгемоглобина и супероксидного анион-радикала. Первое соединение восстанавливается с помощью метгемоглобинредуктазы, а радикал кислорода преобразуется под влиянием супероксиддисмутазы (СОД) в пероксид водорода, токсичный для клеток. Поэтому он восстанавливается первоначально с помощью каталазы, позднее – глутатионпероксидазы (ГПО) (её активный центр включает Sе-цистеин, что немаловажно для жителей селенодефицитных местностей) и восстановленного глутатиона (G-SH). Глутатионредуктаза (ГР), восстанавливающая окисленную форму пептида с помощью НАДФН, поддерживает его пул. Необходимую концентрацию кофермента получают путём окисления глюкозо-6-фосфата соответствующей дегидрогеназой (Г-6-Ф-ДГ). При снижении резервного пула восстановленных АО укорачивается жизнь красных кровяных телец, подверженных аутоокислению. 2.4.3. Структура и свойства гемоглобина Практически весь объём цитоплазмы эритроцита занимает гемоглобин (Hb), представляющий 98% протеинов красных кровяных телец. Он включает в свой состав 4 молекулы гема с катионами железа, его глобин содержит 4 полипептидные цепи. Среди аминокислот в нём преобладают лейцин, валин, лизин (на их долю приходится до 1/3 всех мономеров). В норме уровень Нb в крови у мужчин – 140-180 г/л, у женщин – 120-160 г/л. В разные периоды жизни зародыша и ребёнка активно работают различные гены, ответственные за синтез специфических полипептидных цепей глобина. Выделяют 6 субъединиц: α, β, γ, δ, ε, ζ (альфа, бета, гамма, дельта, эпсилон, дзета соответственно). Первая и последняя из них включают по 141, остальные по 146 аминокислотных остатков. Друг от друга они отличаются не только количеством мономеров, но и их составом. Принцип образования вторичной структуры у всех цепей однотипен: они сильно (до 75% длины) спирализованы и удерживаются в такой форме за счет водородных связей. Компактная укладка этой молекулы в пространстве приводит к формированию третичной структуры; при этом создаётся карман, куда и вкладывается гем. Получившийся комплекс стабилизируется за счет гидрофобных взаимодействий между белком и простетической группой. Эта глобула объединяется с тремя сходными субъединицами, образуя четвертичную структуру, имеющую форму тетраэдра. Высокая растворимость Нb сохраняется только при наличии различных пар цепей. Если же объединяются одинаковые субъединицы, то происходит их быстрая денатурация, укорачивающая жизнь эритроцита. В зависимости от природы включённых протомеров различают следующие виды нормальных гемоглобинов. Впервые 20 суток существования эмбриона в ретикулоцитах образуется HbP (Primitive) в виде двух вариантов: HbGower 1, состоящий из дзета– и эпсилон–цепей, соединённых попарно, и HbGower 2, в котором дзета– последовательности уже заменены на альфа. Переключение генеза одного вида структуры на другой осуществляется медленно: вначале появляются отдельные клетки, продуцирующие иной вариант. Они дают стимул клонам новых клеток, синтезирующих другой вид полипептида. Позднее такие эритробласты начинают преобладать и постепенно вытесняют старые. На 8-й неделе жизни зародыша включается синтез гемоглобина F=α2γ2, по мере же приближения акта родов появляются ретикулоциты, содержащие HbA=α2δ2. У новорожденных на его долю приходится 20-30%, у здорового взрослого человека его вклад составляет 96-98% от общей массы этого белка. Кроме того, в отдельных эритроцитах присутствуют гемоглобин HbA2=α2δ2 (1,5-3%) и фетальный гемоглобин HbF(обычно не более 2%). Однако в некоторых регионах, в том числе у здоровых аборигенов Забайкалья концентрация последнего вида бывает повышена до 4%. Свойства гемоглобина Всем известные гемопротеины (Hb, миоглобин, цитохромы, пероксидаза, каталаза) близки по строению не только простетической группы, но и апопротеина. Определённая общность в пространственной укладке обусловливает и сходство в функционировании – взаимодействии с газами, в основном с кислородом, CO2, СO, NO. Главное свойство Hb – способность обратимо присоединять в лёгких (до 94%) и эффективно отдавать в тканях кислород. Но поистине уникальным для этого белка является сочетание прочности связывания O2 при высоких его парциальных напряжениях и лёгкости диссоциации этого комплекса в области пониженных давлений. Кроме того, скорость распада оксигемоглобина зависит от температуры, рН среды. При накоплении углекислоты, лактата и других кислых продуктов происходит более быстрая отдача кислорода (эффект Бора). Также действует и лихорадка. При алкалозе, гипотермии следует обратное смещение, улучшаются условия насыщения Нb кислородом в лёгких, но полнота выхода газа в ткани уменьшается. Подобное явление наблюдается при гипервентиляции, замерзании и т. д. Попадая в условия острой гипоксии, эритроциты активируют гликолиз, что сопровождается увеличением содержания 2,3-ДФГК, последняя снижает сродство гемопротеида к кислороду, активирует дезоксигенацию крови в тканях. Интересно, что фетальный гемоглобин не способен взаимодействовать с ДФГК, сохраняя повышенное сродство к кислороду и в артериальной, и в венозной крови. В зависимости от взаимоотношений с различными газами и некоторыми соединениями Нb принимает следующие формы: 1. Дезоксигемоглобин – свободная от газов форма протеина. 2.Оксигемоглобин _ продукт включения кислорода в молекулу белка. Одна молекула Нb способна удерживать 4 молекулы газа. 3.Карбгемоглобин уносит из тканей СО2, связавшийся с лизином этого протеина. 4. Монооксид углерода, проникая с атмосферным воздухом в легкие, быстро преодолевает альвеолярно-капиллярную мембрану, растворяется в плазме крови, диффундирует в эритроциты и вступает во взаимодействие с окси–и/или дезокси–Hb: 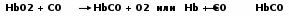 Образовавшийся карбоксигемоглобин не способен присоединять к себе кислород, а угарного газа может связывать 4 молекулы. 5. Важным производным Нb является метгемоглобин, в молекуле которого атом железа находится в степени окисления 3+. Такая форма гемопротеида образуется при действии на него различных окислителей, в результате в крови уменьшается количество функционально важного оксиНb, что нарушает доставку кислорода к тканям, вызывая в них развитие гипоксии. 6. Концевые аминокислоты в цепях глобина способны реагировать с моносахаридами, в первую очередь с глюкозой. В настоящее время выделяют несколько подвидов Нb А (от 0 до 1с), в которых к валину бета-цепей прикреплены олигосахариды. Особенно легко реагирует последний подвид гемопротеида. У образовавшегося при этом без участия фермента гликозилированного гемоглобина увеличивается сродство к кислороду. В норме на долю подобной формы гемоглобина приходится не более 5% от его общего количества. При сахарном диабете его концентрация возрастает в 2-3 раза, что благоприятствует возникновению тканевой гипоксии. |
