Биохимия тканей. Учебное пособие Чита, 2015 ббк 28. 07252. 5 Удк 577. 1 616008 Никитина Л. П., Гомбоева А. Ц., Соловьева Н. В
 Скачать 2.39 Mb. Скачать 2.39 Mb.
|
|
ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ ЧИТИНСКАЯ ГОСУДАРСТВЕННАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ Биохимия тканей Учебное пособие  Чита, 2015 ББК: 28.072+52.5 УДК: 577.1:616–008 Никитина Л.П., Гомбоева А.Ц., Соловьева Н.В. Биохимия тканей: Учебное пособие. – Чита: РИЦ ЧГМА, 2015. – 86 с. В учебном пособии представлены современные сведения об особенностях строения и функциях соединительной, мышечной, нервной тканей. Дана краткая биохимическая характеристика связанных с ними патологий. Каждая глава заканчивается контрольными вопросами и заданиями, а пособие завершается кратким словарём. Данное пособие предназначено для студентов, обучающихся по специальностям лечебное дело, педиатрия и стоматология. Рецензенты: Заведующий кафедрой нормальной физиологии Читинской государственной медицинской академии, д.м.н., профессор Витковский Ю.А. Доцент кафедры биологии Читинской государственной медицинской академии, к.б.н. Ларина Н.П. © Коллектив авторов, 2015 © ЧГМА, 2015
Список сокращений АД – артериальное давление АлАТ – аланинаминотрансфераза АОЗ – антиоксидантная защита АРЗ – антирадикальная защита АсАТ – аспартатаминотрансфераза АТФ – аденозинтрифосфат АФК – активная форма кислорода БАВ – биологически активные вещества ВЖК – высшая жирная кислота ГАМК – гамма–аминомасляная кислота ГГТП – гамма-глутамилтранспептидаза ГКС – глюкокортикостероид ГНГ – глюконеогенез ГПО – глутатионпероксидаза ГР – глутатионредуктаза ГФ – глицеролфосфатид(ы) ГЭБ – гематоэнцефалический барьер ДГ – дегидрогеназа ДГАФ – дигидроксиацетонфосфат ДНК – дезоксирибонуклеиновая кислота ДФГК – дифосфоглицериновая кислота ЖКТ – желудочно-кишечный тракт КоА – коэнзим ацилирования КОС – кислотно–основное состояние КФК – креатинфосфокиназа ЛДГ – лактатдегидрогеназа ЛП – липопротеины ЛПВП – липопротеины высокой плотности ЛПЛ – липопротеинлипаза ЛПНП – липопротеины низкой плотности ЛПОНП – липопротеины очень низкой плотности ЛППП – липопротеины промежуточной плотности ЛХАТ – лецитинхолестеролацилтрансфераза НАД+ – никотинамидадениндинуклеотид (окисленный) НАДН + Н+ – никотинамидадениндинуклеотид (восстановленный) НАД+Ф – никотинамидадениндинуклеотидфосфат (окисленный) НАДФН +Н + – никотинамидадениндинуклеотидфосфат (восстановленный) ОПН – острая почечная недостаточность ПВК – пировиноградная кислота ПНЖК – полиненасыщенная высшая жирная кислота ПОЛ – перекисное окисление липидов ПФП – пентозофосфатный путь РААС – ренин-ангиотензин-альдестероновая система РНК – рибонуклеиновая кислота РЭС – ретикулоэндотелиальная система СД – сахарный диабет СОД – супероксиддисмутаза СРО – свободно-радикальное окисление СТ – соединительная ткань СТГ – соматотропный гормон ТАГ – триацилглицерол ТГФК – тетрагидрофолиевая кислота ТДФ – тиаминдифосфат УДФ – уридиндифосфат УДФГК – уридиндифосфоглюкуроновая кислота ФАД – флавинадениндинуклеотид (окисленный) ФАДН2 – флавинадениндинуклеотид (восстановленный) ФАФС – фосфоаденозинфосфосульфат ФЛ – фосфолипид ФМН – флавинмононуклеотид ХМ – хиломикрон ХС – холестерол ЦНС – центральная нервная система ЦТК – цикл трикарбоновых кислот ЩФ – щелочная фосфатаза ЭТЦ – электронотранспортная цепь Hb – гемоглобин СО – монооксид углерода Введение Любой многоклеточный организм начинает свое развитие с момента слияния двух половых клеток. Их митохондриальный и ядерный геномы отвечают не только за синтез необходимых белков, но и запускают репликацию, стимулируют деление и образование аналогичных клеточных структур. Позднее включаются регуляторные механизмы транскрипции, в первую очередь, репрессия отдельных генов, что провоцирует избирательное фосфорилирование протеинов, обеспечивая индивидуальную специфичность строения и функционирования клеток, т.е. их дифференцировку. Но жизнедеятельность тканей поддерживается общими механизмами: за их энергообеспечение отвечают митохондрии, где локализованы ЦТК, окислительное декарбоксилирование ПВК, β–окисление ВЖК и наконец, ЭТЦ с окислительным фосфорилированием. Кроме митохондрий в цитозоле практически любой клетки присутствуют лизосомы с комплексом ферментов, гидролизующих устаревшие биополимеры; рибосомы, отвечающие за синтез необходимых протеинов; пероксисомы, окисляющие различные вещества. Клетка и часть ее органелл имеют мембраны, ответственные за секрецию, эндоцитоз и другие виды транспорта в зависимости от выполняемых функций. Как отмечено выше, включение различных транскриптонов и приводит к генезу белков в разных тканях, обеспечивая их специфичность. С середины XIXвека по настоящее время сохраняется принцип деления тканей на 4 типа: эпителиальная, мышечная, нервная, внутренней среды. Последняя включает кровь, соединительные и скелетные (хрящевую и костную) ткани. Несмотря на разнообразие, они имеют общие черты: мезенхимный генез, большое количество межклеточного вещества, множество различных клеточных элементов. Глава 1. Физиологические и биохимические особенности соединительной ткани На соединительную ткань (СТ) приходится 50% от массы тела и служит основой для костно-суставной, сердечно-сосудистой систем, кожи, фасций, связочного аппарата, гладких мышц, структурных компонентов различных органов. Ее разновидностями являются собственно соединительные ткани (рыхлая волокнистая, плотная волокнистая – неоформленная и оформленная); ткани, которые имеют особые свойства (жировая, ретикулярная); скелетные твердые (костная и хрящевая) и жидкие (кровь, лимфа). По внешнему виду они очень сильно отличаются друг от друга, но тем не менее действительно представляют единую группу, т.к. имеют общее происхождение развиваются из мезенхимы и одинаковый план строения. Основной характеристикой данной ткани является ее прочность, что позволяет выполнять опорную, защитную (механическую), репаративную, пластическую, трофическую и барьерную (фагоцитоз и транспорт иммунокомпетентных клеток и антител) функции. Основу СТ составляет множество клеток (фибробласты, макрофаги, лейкоциты, тучные клетки и др.) и межклеточное вещество (внеклеточный матрикс, включающий различные макромолекулы, и много волокнистых структур). 1.1. Организация межклеточного матрикса Основное вещество – аморфный, относительно прозрачный материал со свойствами геля включает гликозаминогликаны, протеогликаны, гликопротеины. Их молекулы прочно связаны с волокнами матрикса. Гликозаминогликаны (ГАГ) (гиалуроновая кислота, кератансульфаты, хондроитинсульфаты, дерматансульфаты, гепарансульфаты) – кислые полисахариды, построенные из повторяющихся дисахаридных единиц, одна из которых уроновая кислота, а другая – ацетилированный гексозамин (N-ацетилглюкозамин, N–ацетилгалактозамин), часто сульфатированы. В свободном виде не встречаются, так как из-за полярности мицелл они способны связываться с большим количеством молекул воды и ионов (в частности Nа+), входящих во внеклеточную жидкость, образуя гель, через который диффундируют метаболиты. Среди многочисленных белково-углеводных комплексов в зависимости от их соотношения выделяют протеогликаны – крупные макромолекулы, где на долю ГАГов приходится 90-95%. В гликопротеидах преобладает белковая компонента, соединенная с разветвленными полисахаридами (последние включают галактозу, маннозу, рамнозу, сиаловые кислоты). Эти сложные мицеллы связывают клетки с внеклеточным веществом, входя в фибриллярные структуры. Среди последних выделяют фибронектин и фибриллин. Фибронектин состоит из двух одинаковых полипептидных цепей, соединенных дисульфидными мостиками. Этот белок, включенный в базальную мембрану, участвует в адгезии клеток, контролирует архитектуру поверхности, а также формирует волокна, связываясь с коллагеном и ГАГами. Таким образом устанавливается морфологическая непрерывность между цитоскелетом и экстрацеллюлярным матриксом. Другой белок – фибриллин входит в состав эластичных фибрилл, обеспечивая их упорядоченное строение, усиливая связи между внеклеточными компонентами. Мутации гена фибриллина приводят к развитию синдрома Марфана. Что касается волокон межклеточного вещества, различают коллагеновые, эластические, ретикулиновые. В большинстве тканей присутствуют коллагеновые волокна, основу которых составляет коллаген. Первичная структура этого белка представлена повторяющейся аминокислотной последовательностью виде гли-Х-У, где Х – позицию занимает пролин, У положение – чаще всего гидроксипролин или гидроксилизин, а каждой третьей аминокислотой служит глицин (гли-). Мицелла данного протеина построена довольно сложно. Вначале происходит обычный синтез левозакрученных про-α-цепей. Затем осуществляется посттрансляционная модификация, включающая гидроксилирование и гликозилирование остатков аминокислот в этих длинных (до 1000 мономеров) спиралях, которые сплетаются с помощью многочисленных поперечных «сшивок» трехгранного шнура (Рис. 1.1). 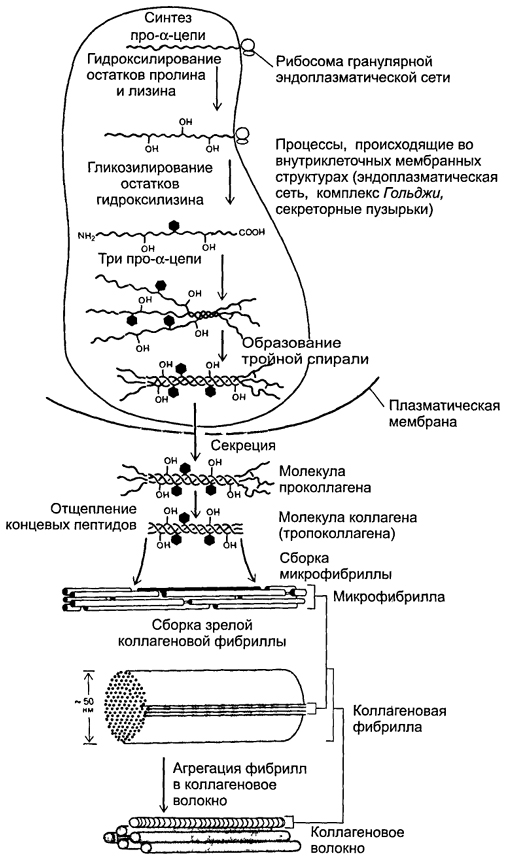 Рис. 1.1. Синтез и созревание коллагена Концевые участки отдельных про-α-цепей соединяются дисульфидными, а сами цепи – водородными связями. Накапливаясь в секреторных гранулах, молекулы проколлагена выделяются во внеклеточное пространство, где под действием специфических пептидаз от них отщепляются концевые фрагменты и образуется тропоколлаген. При последовательном объединении в цепь между хвостовым и головным концами соседних молекул тропоколлагена сохраняется зазор, а каждая цепь смещена относительно рядом лежащей на ¼ ее длины, поэтому образовавшаяся фибрилла имеет поперечную исчерченность. Коллагеновое волокно формируется из многих подобных, параллельно связанных гликопротеинами фибрилл, что обеспечивает их высокую механическую прочность. В обеспечении окончательного формирования волокон участвуют витамин С, НАДФН, пролилгидроксилаза, Fe2+, Zn2+, Cu2+ (Рис. 1.2). Особенно интенсивно идет синтез коллагена в заживающей ране, где образуется рубец, основным компонентом которого является данный белок. 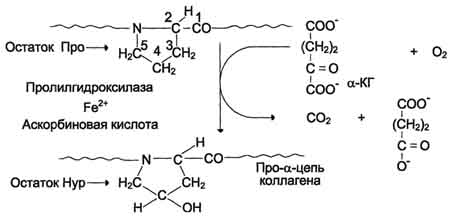 Рис. 1.2.Реакция гидроксилирования остатка пролина в цепи коллагена Каждая α-цепь кодируется отдельным геном, что приводит к большому разнообразию видов коллагена. В настоящее время известно около 30 его разновидностей, до 90 % приходится на I и III типы (Табл. 1.1). Наиболее широко представлен в организме коллаген I типа, он находится повсеместно: в мягких и твердых тканях, костях, коже; механически он самый прочный. Коллаген II типа отражает в основном состояние связочного аппарата, хрящевой ткани. Его аналог III типа – компонент ретикулиновых волокон – реагирует на изменения, происходящие в дыхательной, пищеварительной, сердечно-сосудистой системах. Особенности структуры данного протеина делают его долгожителем, он может функционировать до 1-3-х месяцев. Описаны два пути распада коллагена: специфический и неспецифический. Первый осуществляется коллагеназами, которые гидролизуют амидные связи, образованные между глицином и лизином. Получившиеся пептидные фрагменты подвергаются действию других пептидгидролаз. Неспецифический распад коллагена провоцируется продуктами СРО липидов, а заканчивается обычным протеолизом с участием тканевых протеаз. Маркером интенсивности катаболизма коллагена служит гидроксипролин, который в свободном виде транспортируется кровью, часть выделяется с мочой (у взрослого экскретируется 15-50 мг в сутки, а возрасте 10-20 лет этот показатель может достигать 200 мг). Таблица 1.1 Типы коллагенов, их локализация
Мутация в генах коллагена приводит к развитию различных болезней (несовершенного остеогенеза, синдромов Элерсо–Данло, ахондроплазии). Коллагеновые волокна окружают многие клетки, обеспечивая их связи между собой или за счет наличия рецепторов в их мембранах, или через белки-посредники (Табл. 1.2). Второй вид волокон – эластические, присутствуют в эластическом хряще, коже, легких, сосудах, включают эластин – гликопротеин с молекулярной массой 70 кД. Он, как и коллаген, содержит много глицина и пролина. В создании эластических структур также принимают участие фибриллины, которые формируют микрофибриллярный каркас. Таблица 1.2 Связывающие молекулы между коллагеном и различными типами клеток
После синтеза и созревания белки упаковываются в секреторные гранулы, выделяемые во внеклеточную среду. Особая роль в посттрансляционной модификации принадлежит лизилоксидазе, с помощью которой путем окислительного дезаминирования ε-аминогруппы в остатках лизина между четырьмя отдельными цепями формируются поперечные связи, обусловливающие образование резиноподобных структур, способных после деформации восстановить исходную форму. Последний вид волокон – ретикулиновые – тонкие нити, состоящие из коллагена III типа, связанного с гликопротеинами и протеогликанами. Компоненты этих волокон синтезируются ретикулиновыми клетками, разновидностями фибробластов. Таким образом, коллагеновые волокна придают СТ прочность и позволяют растягиваться, а эластические волокна – возвращают ткань в исходное положение после ее растяжения. Клетки соединительной ткани Соединительная ткань характеризуется следующим разнообразием клеток: фибробласты, фиброциты, хондробласты, хондроциты, остеобласты, остеоциты, макрофаги, лейкоциты, перициты, адипоциты, тучные клетки. Они занимают меньший объем, чем экстрацеллюлярный матрикс этих тканей, и выполняют самые разнообразные функции. Наиболее распространены фибробласты, которые синтезируют компоненты межклеточного вещества (коллаген, эластин, фибронектин, ГАГи, протеогликаны и др.), активные участники заживления ран, способны к пролиферации и миграции. Особую роль в осуществлении защитной функции играют мобильные макрофаги, способные синтезировать более 60 биологически активных веществ. При фагоцитозе выделяется содержимое лизосом, включающие различные гидролазы, АФК (О2˙־, НО˙, Н2О2), обладающие высоким антибактериальным эффектом. В активированных макрофагах интенсивно осуществляется окисление арахидоновой кислоты с образованием простагландинов, лейкотриенов, тромбоксана. Кроме того, в этих клетках синтезируются ферменты, разрушающие внеклеточный матрикс: эластаз, коллагеназ, протеиназ, гиалуронидаз. Макрофаги участвуют в заживлении ран, захватывают из крови денатурированные белки, обломки клеток, состарившиеся эритроциты, пылевые частицы, запускают иммунные реакции, проявляют противоопухолевую активность. Тучные клетки участвуют в воспалительных и аллергических реакциях, продуцируют БАВ: гистамин, гепарин, протеазы, кислые гидролазы, простагландины, лейкотриены и тромбоксаны; их содержание в различных органах подвержено значительным индивидуальным и возрастным колебаниям. Гепарин запасается исключительно тучными клетками, попадая в кровь, связывает антитромбин III, усиливая его антисвертывающую активность. Последний фактор имеет значение и вцелом для соединительнотканных структур. По мере их старения снижается тургор, формируются морщины и т.д. При этом регистрируется обеднение тканей ГАГами, а отсюда – водой с параллельным накоплением грубоволокнистых коллагеновых образований. По мнению отдельных исследователей, в соединительных тканях заложена программа старения организма. Уникальность структуры и функций СТ создает условия для возникновения огромного числа ее аномалий. В настоящее время известно многообразие генетических дефектов, способных привести к появлению признаков повреждений мезенхимальных структур. Они могут происходить вследствие: нарушений синтеза или сборки коллагена; генеза аномального коллагена: ускоренной деградации коллагена; недостаточной прочности поперечных сшивок; аналогичных аномалий в эластиновых волокнах; разрушения тканей посредством аутоиммунных реакций. В группу наследственных коллагенопатий включают синдромы Элерса–Данло, Марфана, Альпорта, несовершенный остеогенез. Скелетные ткани Среди вариантов СТ выделяют костную и хрящевую, также развивающиеся из мезодермы и состоящие из клеток и межклеточного матрикса. Структура и свойства хрящевой ткани Основными клеточными элементами хрящевой ткани являются хондробласты, синтезирующие и секретирующие в экстрацеллюлярный матрикс протеогликаны, которые стимулируют дифференцировку хондроцитов, а также коллагеновые и неколлагеновые белки. Цитозоль хондробластов богат гликогеном и липидами, водой (на нее приходится 75% от массы матрикса) количество последней жидкости определяет упругость хрящевого матрикса. Прочность хрящевой ткани зависит от коллагенов II, VI, IX, XII, XIV типов, которые погружены в макромолекулярные агрегаты протеогликанов. В зависимости от состава, метаболической активности различают гиалиновый, эластический, волокнистый хрящи. Первый служит основой для формирования других, обладает высокоскоростным обменом, содержит много углеводов и липидов, интенсивно синтезирует белки. В матриксе эластического хряща присутствуют эластические волокна, но невысоки значения липидов, углеводов, хондроитинсульфатов. Волокнистый хрящ по своей структуре занимает промежуточное положение между своими аналогами. Его характерная особенность – преобладание коллагеновых волокон I типа, которые располагаются параллельно друг другу, а клеточные элементы – в виде цепочки между ними. Специфичным компонентом хрящевого матрикса является протеогликан – агрекан, который связывается в агрегаты с гиалуроновой кислотой. Среди неколлагеновых белков следует выделить хондрокальцин, отвечающий за минерализацию матрикса; Gla-белок, наоборот, ингибирует этот процесс; хондроадерин – гликопротеин, связывает коллагены с хондроцитами. Формирование, рост, функционирование хрящевой ткани регулируется гормонами, факторами роста, цитокинами. Хондробласты являются клетками – мишенями для тироидных и половых гормонов, СТГ, которые стимулируют их рост. Кортизол тормозит пролиферацию и дифференцировку клеточных образований. 1.3.2. Хрящ как предшественник кости Все закладки костного скелета проходят три стадии: мезенхимную, хрящевую и костную. Механизм обызвествления хряща является очень сложным процессом и до конца ещё не изучен. Физиологическому обызвествлению подвержены точки окостенения, продольные перегородки в нижней гипертрофической зоне зачатков хряща, а также прилегающий к кости слой суставного хряща. Вероятной причиной развития событий служит наличие на поверхности хондроцитов щелочной фосфатазы. В подверженном обызвествлению матриксе образуются матриксные пузырьки, содержащие фермент. Вокруг клеток растет локальная концентрация фосфатных ионов, что способствует минерализации ткани. Гипертрофические хондроциты синтезируют и выделяют в матрикс белок – хондрокальцин, способный связывать ионы кальция. Для подверженных минерализации областей характерны высокие величины фосфолипидов, стимулирующих формирование кристаллов гидроксиапатита в этих местах. В зоне обызвествления хряща происходит частичная деградация протеогликанов. Макромолекулы, которые не подверглись данному процессу, тормозят обызвествление. 1.3.3. Костная ткань – особый вид соединительной ткани Костная ткань составляет основу кости, образует костные пластинки. В зависимости от расположения и плотности различают компактное и губчатое костное вещество. Клеточными элементами этого вида СТ являются остеобласты, остеоциты, остеокласты. Первые клеточные элементы имеют мощный аппарат белкового синтеза (коллагенов, протеогликанов, ферментов – участников продукции ГАГов) – основных компонентов межклеточного вещества. Остеоцит более зрелая клетка, сохраняющая способность к их образованию и секреции. Остеокласт – гигантская многоядерная клетка, способная резорбировать обызвествленный хрящ и межклеточное вещество в процессе развития и перестройки кости. 1.3.3.1. Химический состав костной ткани В межклеточном матриксе компактной кости преобладают минеральные структуры и вода (10%), обратная пропорция между ними регистрируется в губчатых костях. Неорганические вещества, включенные в кристаллы, относятся к гидроксиапатитам – Са10(РО4)6 (ОН)2, имеющим формы палочек и пластин. Кроме кристаллических форм имеется аморфный фосфат кальция Са3(РО4)2, в основном, в детском возрасте. В состав минеральной фазы кости входят также Na+, Mg2+, K+, Cl‾и т. д. Катионы кальция в кристаллической решетке могут замещаться другими двухвалентными катионами, в то время как анионы, отличные от фосфатов и гидроксила, лишь адсорбируются на поверхности кристаллов или растворяются в их гидратной оболочке. Основу органического матрикса составляют коллаген I типа, протеогликаны, ГАГи, в первую очередь, хондроитин-4-сульфат, а также липиды, полинуклеотиды (особенно много РНК, обеспечивающие биосинтетическую функцию). Своеобразной особенностью костного матрикса является высокое содержание цитрата, необходимого для минерализации: он образует комплексные соединения с солями кальция и фосфора, что и провоцирует кристаллизацию. 1.3.3.2. Факторы, влияющие на метаболизм костной ткани Минеральные компоненты костей находятся практически в состоянии химического равновесия с ионами кальция и фосфатов сыворотки крови, что регистрируется сложной системой БАВ. Среди них важная роль принадлежит паратгормону и его антагонисту тирокальцитонину. Гипокальциемия стимулирует секрецию гормона паращитовидных желез, который активирует клеточные системы, ответственные за резорбцию кости: увеличивает число остеокластов и их метаболическую активность. Тирокальцитонин, выделившийся при гиперкальциемии, усиливает минерализацию костной ткани, уменьшает количество остеокластов, т.е. угнетает резорбцию. Активная форма витамина Д – кальцитриол участвует в биосинтезе кальций-связывающих белков, регулируя кальцификацию костной ткани. Транс–ретиноевая кислота (окисленный витамин А) отвечает за продукцию ферментов синтеза хондроитинсульфата. При ее дефиците нарушается рост костей. Под влиянием аскорбиновой кислоты происходит созревание коллагена в остеобластах; также витамин С участвует в синтезе ГАГов: ускоряет продукцию хондроитинсульфатов, параллельно угнетая генез гиалуроновой кислоты. Под действием различных эндогенных и экзогенных факторов могут развиваться многочисленные болезни костей травматические, воспалительные, диспластические, дистрофические. Самая многочисленная группа – переломы, травматические артрозы, деформирующий спондилёз и др. Воспалительные процессы вызываются разными инфекционными возбудителями. Дистрофические поражения могут быть следствием токсических воздействий (фосфорных, фтористых и других отравлений), алиментарных расстройств (цинги, рахита и др.), эндокринных болезней (паратиреоидная остеодистрофия и др.). Примерами недостаточного или избыточного остеогенеза (дисплазия) могут служить гигантизм, остеосклероз, опухоли костей. 1.4. Жировая ткань К соединительным тканям со специфическими свойствами отнесена и жировая ткань, основные элементы которой – адипоциты в зависимости от степени дифференциации делятся на клетки белого и бурого жира. Первые содержат одну крупную каплю жира, оттесняющую на периферию цитозоль и органеллы. Эти адипоциты синтезируют ЛПЛ, которая выходит на поверхность эндотелия и встречаясь с ЛПОНП и ХМ в просвете сосуда, гидролизует ТАГи до глицерина и ВЖК. Данные липиды проникают в адипоциты, ресинтезируются до нейтральных жиров, запасающихся в виде капель. В жировых клетках ВЖК генерируются также из глюкозы и аминокислот. Под действием чувствительной к гормонам липазы, активируемой ц-АМФ, высвободившиеся жирные кислоты поступают в просвет капилляров, где связываются с альбуминами и доставляются в печень. В адипоцитах бурого жира содержится множество мелких жировых капель и крупных митохондрий. Особенностью последних является наличие во внутренней мембране белка термогенина, с помощью которого происходит транспорт протонов из межмембранного пространства в матрикс без прохождения через систему АТФ-синтетазы, т.е. процессы биологического окисления и окислительного фосфорилирования разобщаются, энергия выделяется в виде тепла. Таким образом, белая жировая ткань запасает энергоисточники, а бурая участвует в регуляции температуры тела младенцев. Контрольные вопросы и задания: Какие разновидности соединительной ткани Вы знаете? Охарактеризуйте химический состав, строение и функции коллагена. Как и где происходит образование волокон коллагена? Охарактеризуйте химический состав, строение и функции эластина. Раскройте понятие «межклеточное вещество». Из каких веществ оно состоит? Опишите формулы гетерополисахаридов. Назовите основные функции межклеточного вещества. Какие особенности и состава межклеточного вещества позволяют выполнять эти функции? Какие адгезивные белки присутствуют во внеклеточном матриксе соединительной ткани и какова их биологическая роль? Какие вещества (ферменты, витамины и минеральные вещества) и как влияют на метаболизм соединительной ткани? Назовите основные наследственные и приобретенные патологии соединительной ткани. Раскройте биохимические причины их развития. При заболевании артрозом происходит деградация внеклеточного матрикса – хрящевой ткани. Укажите возможные причины активации процессов деградации и опишите в виде схемы последовательность процессов, происходящих при данном заболевании. У пациента наблюдаются повышенная кровоточивость десен, шатание зубов, уменьшение эластичности кожи, подкожные геморрагии, плохое заживление ран. Дефицит какого витамина может быть причиной этих нарушений? В образовании какого компонента соединительной ткани он участвует? Как называется описываемое состояние? При диффузных заболеваниях соединительной ткани (коллагенозах) выявляется повышенное выделение с мочой гликозаминогликанов и свободного гидроксипролина, в крови повышается активность гиалуронидазы. Чем объясняется повышенное выделение из организма с мочой глюкозаминогликанов и гидроксипролина при коллагенозах? Какими ионами могут заменяться компоненты кристаллической решетки? Чем это грозит? | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
