Биохимия тканей. Учебное пособие Чита, 2015 ббк 28. 07252. 5 Удк 577. 1 616008 Никитина Л. П., Гомбоева А. Ц., Соловьева Н. В
 Скачать 2.39 Mb. Скачать 2.39 Mb.
|
|
2.4.5.4. Дисгемоглобинемии Относительно часто встречаются патологические состояния, в основе которых лежат нарушения баланса различных форм гемоглобина. В эритроцитах здорового взрослого человека уровень метгемоглобина, который не способен переносить О2, не достигает 1-2% от его общего содержания. Если же физиологическая норма превышается, то возникают метгемоглобинемии, различают первичные (наследственные) и вторичные (токсические). Последние могут быть спровоцированы различными оксидами азота, неорганическими нитратами, нитросоединениями (тринитротолуолом, амилнитритом, нитробензолом, нитрофенолом, нитроанилином), аминопроизводными (гидроксиламином, анилином,фенилгидразином, аминофенолами, п-аминобензойной кислотой), хлоратами, хроматами, перманганатами, хинонами, пиридином, нафталином, некоторыми лекарственными средствами (нитроглицерином, анальгетиками, анестетиками, витамином К, антибиотиками, фурадонином, барбитуратами, аспирином и др.), красками, обладающими окислительной способностью. Риск отравления нитритами увеличивается при употреблении овощей, колбасных изделий, мясной тушёнки, некачественной питьевой воды. Под их влиянием резко возрастает концентрация метHb. В результате блокируется перенос кислорода от лёгких к тканям и развивается гипоксия. Все метгемоглобинообразователи, снижая осмотическую резистентность эритроцитов, ускоряют их гемолиз, обусловленный тем, что при окислении Hb генерируются АФК, которые участвуют в процессах окислительного повреждения форменных элементов. Активируется ПОЛ, нарушается обмен липидов мембран красных кровяных телец, смещается баланс в системе ПОЛ–АОЗ. Основным симптомом служит цианоз; если содержание метгемоглобина превышает 30%, возникают слабость, раздражительность, ухудшение памяти, головокружение, тахикардия, головные боли; при его накоплении до 50% появляются симптомы сердечно-сосудистой недостаточности, метгемоглобинурия. Увеличение количества метHb больше 70 % несовместимо с жизнью. Описаны случаи и наследственных метгемоглобинемий (у носителей HbBoston). В их основе лежат: блоки ферментных систем, участвующих в восстановлении окисленного железа в геме; гемоглобинопатии, обусловленные синтезом аномальных Hb группы М. Энзимопенические варианты наследуются по аутосомно-рецессивному типу. Степень выраженности клинических проявлений зависит от количества метНb; пациенты больше «синие», нежели «больные». Венозная кровь имеет шоколадно-коричневый оттенок и не алеет при соприкосновении с воздухом. Общий и биохимический анализы крови без отклонений от нормы. Более редко встречается гемоглобиноз М, наследующийся аутосомно-доминантно. В основе его различных вариантов (МBoston, МKansas)лежат замены аминокислот в области гемового кармана, что может провоцировать окисление катионов железа. Основной симптом: цианоз разной степени выраженности. Продолжительность жизни больных не страдает, имеется лишь косметический дефект – синюшность губ, кожных покровов. К группе кровяных ядов, провоцирующих возникновение патологических пигментов, относится монооксид углерода (угарный газ). Проникая в организм, СО абсорбируется эритроцитами, вступает во взаимодействие с железом гемоглобина, образуя довольно стойкое соединение – карбоксигемоглобин, величины которого у некурящих не превышают 0,25% от общего количества основного белка красных кровяных телец. В крови у курильщиков его цифры возрастают до 10%. При более высоком парциальном давлении угарного газа (карбоксигемоглобинемии) тормозится оксигенация гемопротеида, развивается гипоксия. Кроме того, монооксид углерода обладает способностью вступать в контакты с другими гем-содержащими протеинами (миоглобином, цитохромами, пероксидазой, каталазой), нарушая их функции. 2.4.5.5. Нарушение транспорта гемоглобина в плазме крови Различные обстоятельства, в том числе внутрисосудистый гемолиз, могут способствовать тому, что мембрана эритроцита в отдельных местах оказывается проницаема для гемоглобина. Последний током крови доставляется к почкам. Размеры белка соизмеримы с диаметром почечных пор, поэтому высока вероятность выделения гемопротеида с мочой (гемоглобинурия) с окрашиванием её в красно-коричневый цвет. Довольно крупные мицеллы Hb, застревая в канальцах, тормозят в них фильтрацию, провоцируя острую почечную недостаточность. Для предотвращения подобного явления в организме, в печени синтезируется специфический гликопротеид – гаптоглобин. Попадая в плазму крови, он комплексируется с гемоглобином. Образовавшаяся структура решает следующие задачи: предотвращает проникновение плазменного гемоглобина в почки и его выделение; служит физиологическим субстратом для гем-альфа-метинилоксигеназы – фермента. Если же баланс этой системы белков нарушается в пользу гемоглобина (при усилении внутрисосудистого гемолиза или при угнетении синтеза гаптоглобина из-за повреждений печёночных клеток), то возникает гемоглобинурия с последующей ОПН. 2.4.6. Старение и распад эритроцитов За свою жизнь, продолжающуюся обычно 90-120 суток, эритроцит «пробегает» около 200 км. Так как синтез белков, в первую очередь ферментов в зрелых красных кровяных тельцах невозможен, постепенно снижается скорость обмена веществ, энергии (уменьшается пул АТФ). Происходит деградация цитозольных и мембранных протеинов, разрываются сети анкирина, спектрина, нарушается форма, теряется эластичность. Модифицированные белки плазмолемм начинают выполнять роль антигенов, что способствует фагоцитированию стареющих эритроцитов. В этом же направлении работает повышение активности мембранной фосфолипазы А2, увеличивающей количество свободных ПНЖК, служащих субстратами в свободно-радикальных реакциях. Иными словами, в конце своего жизненного цикла данные форменные элементы характеризуются рядом особенностей: меньшими размерами, снижением эластичности и деформируемости мембран, большей плотностью концентрации гемоглобина, увеличением цитоплазматической вязкости, уменьшенным количеством сиаловых кислот, липидов в плазматической мембране, экспрессией особого неоантигена, не характерного для молодых и зрелых клеток. Активные формы кислорода вызывают образование липопероксидов в плазмолемме эритроцитов. В этих условиях в красных кровяных тельцах провоцируется их осмотическое набухание и даже эритродиерез. Основная масса стареющих эритроцитов попадает в клетки РЭС (около 57% телец подвергаются распаду в костном мозге, 35% - в печени, 8% - в селезёнке). Сигналом к эндоцитозу служит удаление сиаловых кислот из гликопротеинов эритроцитарной мембраны, что повреждает её архитектонику, делает проницаемой для гемоглобина, гема. Последнее соединение связывается с плазменным белком гемопексином, с его помощью доставляется в печень, где, распадаясь, высвобождает ионы железа, которые могут вновь использоваться для синтеза гема. 2.4.6.1. Метаболизм билирубина у здорового человека Свободный Hb при попадании в плазму транспортируется обязательно в комплексе с гаптоглобином, который в клетках РЭС используется в качестве субстрата ферментом гем-α-метинилоксигеназой (Рис.2.6). Под её влиянием происходит разрыв метинового мостика, выделяется СО (карбонмонооксид) и образуется вердохромальдегидоглобин. Соединение непрочное, распадается с отщеплением ионов железа и белковой части, которая окончательно гидролизуется. Под влиянием биливердинредуктазы с участием восстановленного НАДФ синтезируется биливердин, преобразующийся в билирубин. В физиологических условиях в организме человека (массой 70 кг) за сутки образуется около 250-300 мг билирубина. Причём 70-80% его общего количества получается при распаде гемоглобина; 10-20% являются продуктами распада других гемопротеидов. Так как билирубин является конечным продуктом распада гема, следовательно, он должен быть выведен из организма. Местом образования этого амфифильного соединения чаще всего служит костный мозг, ему требуется помощь в транспорте к органам выделительной системы. Чтобы обеспечить растворимость билирубина в плазме крови, с ним связываются альбумины. При снижении рН (гиперкетонемии, гиперлактацидемии) сродство белков к билирубину уменьшается. В подобных условиях желчный пигмент может комплексироваться с липидами плазмы, плазмолемм, с коллагеном матрикса. Использование в физиологических условиях альбуминов с целью транспорта билирубина необходимо ещё и потому, что последний, являясь амфифилом, легко преодолевает цитоплазматические и органоидные мембраны. 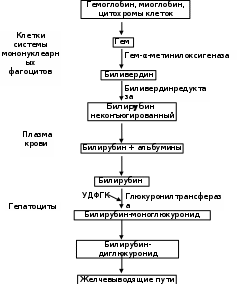 Рис. 2.6. Основные этапы метаболизма билирубина Попадая в митохондрии, он способен вмешиваться в происходящие в них электрические процессы, нарушая сопряжённость биологического окисления и окислительного фосфорилирования, тем самым повреждая динамику энергетического ресурса. Отсюда, чтобы предупредить потенциальное токсическое воздействие данного жёлчного пигмента, он доставляется к печени внутри альбуминов. Печень человека выполняет в обмене билирубина три важнейшие функции: захват его из крови гепатоцитом; комплексирование с глюкуроновой кислотой; выделение конъюгированной фракции в желчные капилляры. Билирубин выходит из центров связывания с альбумином и взаимодействует со специфическими белками-транспортёрами – У, Z-протеинами (лигандинами), которые и доставляют его в гладкий эндоплазматический ретикулум, где билирубин под действием уридиндифосфоглюкуронилтрансфераза (УДФГК-ТФ) с уридилдифосфоглюкуроновой кислотой (УДФГК). Процесс протекает в две стадии: сначала образуется билирубинмоноглюкуронид, затем – билирубиндиглюкуронид. Образованный пигмент хорошо растворимым в воде, и не токсичен. Подходя к жёлчному полюсу гепатоцита, связанный (конъюгированный) с глюкуроновой кислотой билирубин выходит из клетки с помощью сложной системы активного транспорта (с использованием энергии АТФ и различных белков-переносчиков). Попадая в жёлчные капилляры, связанный билирубин в составе жёлчи устремляется через фатеров сосочек в тонкую кишку, где подвергается действию микробной бета-глюкуронидазы, которая гидролизует его до свободной формы, а затем под влиянием специфической бактериальной редуктазы, он восстанавливается до бесцветных уробилиногенов (d, i, l – изомеров). У лиц, болеющих холециститом, инфекция локализуется в жёлчевыводящих путях, поэтому гидролиз связанного билирубина начинается уже в них. Высвободившийся при этом пигмент плохо растворим в воде, что делает серьезной опасность его осаждения с последующей агрегацией в камни. Судьба разных вариантов уробилиногенов различна. D-форма образуется в незначительных количествах, непрочна, легко превращается в другие виды. I-изомер без труда всасывается и по системе воротной вены доставляется в печень, где инактивируется, распадаясь до дипиррольных колец. Основная форма – l-уробилиноген спускается без изменений в нижние отделы толстого кишечника, где окисляется кислородом воздуха до коричневого l-уробилина, который экскретируется с фекалиями (иногда его называют стеркобилином от слова stercos – кал). Малый процент l-уробилина всасывается в геморроидальные вены, попадает в общий кровоток, и так как хорошо растворяется в воде, в почках легко фильтруется в мочу. За сутки с этой биологической жидкостью его выделяется не более 4 мг. В целях диагностики патологии изучают спектр показателей пигментного обмена. В плазме крови здоровых людей общее содержание билирубина колеблется в пределах 8 – 20 мкмоль/л. Обычно преобладает так называемая свободная форма (билирубин, окунувшийся в альбумин). В старых клинических руководствах её называют «непрямой билирубин», так как, чтобы доказать присутствие его с помощью реактива Эрлиха, требовалось сначала осадить альбумины, окружающие пигмент. У здорового человека на долю свободной фракции приходится не менее 75% от его общего количества. Оставшуюся четверть составляет связанный (конъюгированный) билирубин. В старых источниках он известен под термином «прямой билирубин», так как сразу давал окрашивание с реактивом Эрлиха. В плазме крови в норме можно обнаружить следы l-уробилина. Кал и в меньшей степени – моча окрашены за его счёт. Нарушения функций эритроцитов полиэтиологичны и многочисленны, но среди их последствий можно выделить два основных: анемии как результат угнетения синтеза гема, гемоглобина, эритропоэза и желтухи, развивающиеся из-за усиления гемолиза или повреждения метаболизма билирубина. Иногда оба направления сливаются в одно (гемолитическая анемия и гемолитическая желтуха). 2.4.7. Особенности патогенеза желтух В судьбе билирубина можно выделить три стадии: до-, печёночную, постпечёночную. Нарушения того или иного этапа сопровождаются обычно гипербилирубинемией. Причём это соединение обладает высоким сродством к различным белкам, особенно к коллагену, также к ГАГам, поэтому при движении по кровяному руслу билирубин легко взаимодействует с ними и отсюда задерживается в эпителиальных, соединительнотканных образованиях. Если содержание данного жёлчного пигмента в крови достигает 40-50 мкмоль/л, опытные врачи регистрируют пожелтение склер. Когда же его значения превышают 50-80 мкмоль/л, кожа ярко окрашивается. Подобное изменение цвета за счёт накопления билирубина носит название «желтуха» (icterus). Таким образом, желтуха – это состояние, характеризующееся избыточным содержанием в крови и интерстициальной жидкости билирубина, что обусловливает специфическое окрашивание кожи (от лимонно-жёлтого, зелёного, оливково-жёлтого до оранжево-жёлтого), слизистых оболочек и мочи. По степени тяжести различают лёгкую (уровень билирубина поднимается до 85 мкмоль/л), среднетяжёлую (количество пигмента колеблется в пределах 86-169 мкмоль/л) и тяжёлую (гипербилирубинемия выше 170 мкмоль/л) формы. Многообразие факторов, вызывающих желтухи, заставляет их классифицировать. Наиболее часто применяют следующий вариант деления: • гемолитическая (надпечёночная); • паренхиматозная (печёночная); • механическая (обтурационная, постпечёночная) желтухи. Причём среди каждой из них обычно выделяют наследственные, врождённые, приобретённые желтухи. 2.4.7.1. Гемолитическая желтуха Данный синдром развивается при усиленном эритродиерезе, когда вместо обычных 100-120 суток продолжительность их жизни сокращается до 40-50, а иногда до 9-12 суток. Общим следствием данного процесса будет развитие гемолитической анемии. Классической причиной врождённой гемолитической желтухи может служить Rh-конфликтная ситуация матери и плода. Сюда же можно отнести единственную icterus, которая встречается у здорового человека. При рождении ребёнок резко меняет свою среду обитания, начинает дышать, парциальное давление кислорода в его лёгких сильно возрастает – всё это требует гемоглобина, обладающего меньшим сродством к О2. Поэтому после родов в организме происходит массовый гемолиз эритроцитов, содержащих HbF и мощный выброс из костного мозга красных кровяных телец с гемоглобином А. Естественно, это проявляется в виде желтухи, длящейся обычно с четвёртых по 12-14-е сутки после рождения. В крови регистрируется гипербилирубинемия (85-100 мкмоль/л) в основном за счёт свободной формы. У детей, родившихся раньше времени, многие системы ещё не готовы к функционированию, в том числе преобладают эритроциты, содержащие HbF, не созрел сурфактант в лёгких, что не даёт расправляться альвеолам и в достаточной мере дышать. Последнее явление благоприятствует инфицированию, заставляя неонатологов назначать новорождённым различные лекарственные препараты. Среди последних много амфифилов, что вынуждает их при поступлении в кровоток комплексироваться с белками плазмы, конкурируя с билирубином. Данный жёлчный пигмент, не находя доступных свободных протеинов, образует с липидами мицеллы, которые легко преодолевают ГЭБ и оседают в митохондриях ядер головного мозга. Билирубин вмешивается во взаимоотношения между биологическим окислением и окислительным фосфорилированием, нарушая биоэнергетические процессы и функционирование нейронов. Возникающая ядерная желтуха сопровождается энцефалопатией. Среди причин наследственных гемолитических желтух можно выделить: ● генетические повреждения мембран эритроцитов; ● мутации, приводящие к дефектам структуры гемоглобина; ● генетические альтерации цитозольных белков, чаще ферментов. К первой группе наследственных гемолитических анемий принадлежит относительно часто встречающаяся болезнь Минковского-Шаффара. Обычно поражает европейцев Скандинаво-балтийского региона (до 20 случаев на 100 тысяч населения), наследуется аутосомно-доминантно, носит семейный характер. В основе – дефект примембранных белков цитоскелета эритроцита. При этом обычно снижено содержание спектрина, который обеспечивает каркас двояковогнутой цитолеммы. Подобная аномалия повреждает крепление к спектрину других протеинов, что подавляет способность мембраны удерживать форму, изменяет ионный баланс, уменьшает осмотическую стойкость эритроцитов. Усиленное при этом поступление в клетку ионов натрия и кальция, захватывающих с собой молекулы воды, превращает форменный элемент в сфероцит (отсюда другое название недуга – наследственный микросфероцитоз). Ко второй группе принадлежат все болезни, обозначаемые термином гемоглобинопатии, т.е. страдания, являющиеся результатом точечных мутаций в гене глобина (серповидно-клеточная анемия и другие гемоглобинозы), следствием дефицита синтеза полной цепи белка (талассемии) плюс наследственные заболевания, в основе которых лежат повреждения в генезе гема (порфирии). Последнюю группу наследственных гемолитических желтух (описано около 20 вариантов) обычно относят к ферментопатиям, так как их причинами служат генетические дефекты, обусловливающие изменения в структуре того или иного энзима. Чаще всего обнаруживается блок глюкозо-6-фосфатдегидрогеназы (Г-6-ФДГ). Зона распространения этой патологии: Средиземноморье, Азербайджан, Грузия; в США среди афро-американцев встречается до 10-13% больных недостаточностьюГ-6-Ф-ДГ. По данным ВОЗ, в мире насчитывается более 200 млн. человек, являющихся гомозиготами по данной патологии, преимущественно – мужчины. В обычной ситуации они практически здоровы, но при определённых обстоятельствах (употребление в пищу бобов, гороха, папоротника, крыжовника, чёрной смородины; лечение аспирином, амидопирином, парацетамолом, сульфаниламидами, анальгетиками, ГАМК и др.; вдыхание паров нафталина) у них развиваются следующие изменения. Нарушение активности Г-6-ФДГ – фермента АОЗ способствует накоплению радикалов, которые связывают HS-группы гемоглобина, что вызывает его преципитацию, повреждает цитоскелет, усиливает гемолиз, провоцирует симптомы анемии, желтухи, увеличивает количество Hb в плазме крови, вероятность развития гемоглобинурии. Эта же группа включает болезни дефицита ферментов гликолиза – пируваткиназы, гексокиназы, Г-6-Ф-изомеразы, фосфофруктокиназы, альдолазы и др. Блок первого энзима вызывает повреждения в синтезе АТФ путём субстратного фосфорилирования, что уменьшает жизнеспособность эритроцита. Другие патологические состояния тоже характеризуются нарушением резистентности красных кровяных телец, так как все они являются следствием повреждения скорости единственного энергетического процесса – гликолиза. В этих клетках снижена производительность калий-натриевого насоса и других градиент-создающих систем, раньше экспрессируют антиген стареющих клеток и имеют укороченный жизненный цикл. Обращает на себя внимание то, что при всех вышеперечисленных патологиях усиливается скорость ПОЛ и снижается количество восстановленного глутатиона. Среди приобретённых гемолитических желтух самые частые – аутоимунные, а также изоимунные – развивающиеся после переливания несовместимой группы крови. Сюда же относят желтухи, формирующиеся после действия гемолитических агентов. Последние могут иметь растительное, микробное или животное происхождение. К ним относятся яды грибов, змей, пчёл, включающие в свой состав протеазы, фосфолипазы, разрушающие плазмолеммы эритроцитов. Гемолиз может усилиться после отравления нитробензолом, уксусной, муравьиной кислотами, соединениями свинца, мышьяка, некоторыми лекарственными средствами (сульфаниламидами, противомалярийными препараторами и др.), и быть следствием дефицита витамина Е. Причины данного вида желтух очень разнообразны. Среди них – ожоговая болезнь, различные инфекции (сепсис, грипп, лейшманиоз, малярия, крупозная пневмония), обширные кровоизлияния во внутренние органы, протезирование сосудов и сердечных клапанов, синдром сдавления. В последних случаях распад эритроцитов усилен из-за их механических повреждений. Несмотря на такую полиэтиологичность, основные клинико-биохимические признаки данного вида желтух довольно общие: высокий уровень ретикулоцитов, лейкоцитоз, эритроцитопения, гипербилирубинемия, в первую очередь, за счёт свободной фракции (80% и больше от всего содержания); рост количества l-уробилина, возможно появление его i-изомера (если очень силён гемолиз, а печень слаба функционально), рост в плазме крови величин свободного гемоглобина, ионов железа (Табл. 2.2). У таких больных интенсивно окрашен кал за счёт избытка l-уробилина (стеркобилина); подобные изменения претерпевает моча, причём в ней может появиться гемоглобин (гемоглобинурия). Особенно часто последний симптом развивается у детей, так как у них многие функции печени ещё довольно слабо развиты, поэтому она не способна в данной ситуации синтезировать гаптоглобин в необходимых количествах. Если гемолиз носит хронический характер (например, при различных наследственных желтухах), то формируется тканевый гемосидероз. Остро развивающийся гемолиз клинически проявляет себя гемолитическим кризом: резким подъёмом температуры, потерей сознания, ОПН с гемоглобинурией, тромбгеморрагическим синдромом, спленомегалией. 2.4.7.2.Паренхиматозная желтуха Паренхиматозная желтуха – патологическое состояние, которое возникает при нарушении пигментного обмена в гепатоцитах; может носить наследственный и приобретённый характер. Крайне редко регистрируются врождённые формы, одной из которых является врождённый гигантоклеточный гепатит. Синдром Жильбера – одна из довольно часто встречающихся наследственных паренхиматозных желтух. Причина – генетические повреждения в белках-лигандинах (Y или Z) гепатоцитов, передаётся по аутосомно-доминантному типу. Это доброкачественно протекающая семейная желтуха, характеризующаяся пароксизмальным развитием гипербилирубинемии (например, при голодании), абдоминальными болями, астеноневротическими симптомами. Подъём уровня жёлчного пигмента в плазме крови не очень высок (не превышает 80-90 мкмоль/л за счёт свободной фракции). Более совершенным методом верификации синдрома является прямая ДНК-диагностика. Частота встречаемости заболевания 3-7%, страдают в основном мужчины. Прогноз благоприятный. После 35 лет характерно самоизлечение. Синдром Клиглера-Найяра – тяжёлое наследственное повреждение обмена билирубина. Вследствие блока фермента УДФГ-трансферазы (Рис. 2.4.) билирубин, попав в гепатоцит, не способен к коньюгированию и обезвреживанию. Потеряв связь с альбумином, он для своего транспорта вынужден взаимодействовать с липидами. Такой комплекс, как отмечено выше, легко преодолевает ГЭБ и, откладываясь в центральных серых ядрах головного мозга, нарушает их функционирование. Заболевание злокачественное, дети часто погибают до года. Выделяют два типа: I(аутосомно-рецессивная передача) сопровождается гипербилирубинемией до 300-500 мкмоль/л. При II типе (аутосомно-доминантном) рост величин пигмента не превышает 400 мкмоль/л поражение ядер ЦНС развивается редко. Продлевают жизнь за счёт терапевтических средств: воздействием световых волн разрушают накапливающийся в коже билирубин, но выздоровления можно достичь хирургическим способом с помощью трансплантации печени. Синдром Дабина-Джонсона – хроническое доброкачественное заболевание, характеризующееся непостоянной желтухой, возникающей при накоплении в плазме крови связанного билирубина с последующим развитием билирубинурии. Наиболее часто диагностируется среди иранских евреев (передаётся по аутосомно-доминантному типу). В его основе лежит генетическое нарушение выделения в жёлчь многих органических ионов (в том числе билирубинглюкуронида) из-за дефекта АТФ-зависимой транспортной системы. Иных биохимических повреждений в крови обычно не регистрируется. Доминирующими симптомами служат желтуха и диспепсические расстройства. Синдром Ротора – сходное по патогенезу с последним страдание, даже клинически ничем не разнится, его отличают лишь морфологические признаки (отсутствие коричневых пигментов в гепатоцитах). Нередки и приобретённые паренхиматозные желтухи. Часто они являются следствием действия на печень различных ядов: хлороформа, алкоголя, мышьяка, токсинов грибов или вирусов (все варианты гепатитов А, В, С и т.д.) и других микроорганизмов (брюшного, возвратного тифов, сифилиса, сепсиса, токсоплазмоза). Опасно применение грудничкам парацетамола, тетрациклина, эритромицина, что может серьёзно сказаться на функционировании печени. В результате в гепатоцитах нарушается не только метаболизм билирубина, но и многие другие механизмы, за которые ответственен данный орган (Рис. 2.7). Так как печень выполняет около 500 различных функций, а яды действуют специфично, повреждая отдельные из них, то клинико-биохимические симптомы, сопровождающие различные приобретённые паренхиматозные желтухи, самые разнообразные. Вторая стадия характеризуется дальнейшим углублением альтерации гепатоцитов, их мембран, добавляется сдавление жёлчных капилляров. Проявления: выход связанного билирубина (гипербилирубинемия, билирубинурия), холемия. В третью стадию резко снижается процесс глюкуронизации пигмента. В крови увеличивается содержание его свободной фракции, уменьшаются цифры l-уробилина в крови, моче, фекалиях, вплоть до исчезновения. Прогрессирует печёночная недостаточность, чреватая развитием комы. 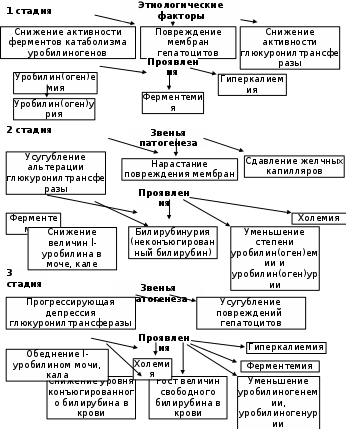 Рис. 2.7.Основные звенья патогенеза различных стадий приобретённой паренхиматозной желтухи Врачи обращают особое внимание на рост активности в плазме аминотрансфераз АсАТ, АЛТ. Если процесс хронический, то особенно страдает синтетическая функция печени, поэтому в плазме крови уменьшается уровень альбуминов (гипоальбуминемия, диспротеинемия). 2.4.7.3.Механическая желтуха Механическая (обтурационная) желтуха называется так потому, что в её основе лежит нарушение транспорта жёлчи из печени в 12-пёрстную кишку. Она может носить врождённый характер вследствие внутриутробных дефектов жёлчевыводящих путей (деформаций, стеноза, атрезий, гипоплазий). Причины пороков развития могут быть физическими (рентген-, ультрафиолетовое излучение), химическими (лекарства, алкоголь, бензин, фенол, соли тяжёлых металлов), биологическими (вирусы краснухи), генетическими (поражение половых клеток), а также являться следствием маловодия, миомы матки у будущих матерей. Но чаще симптомы механической желтухи проявляются как следствие заболеваний близлежащих органов (опухолей головки pancreas, фатерова сосочка, панкреатита, различных стриктур, увеличение лимфоузлов и т.д.), в результате происходит сдавление ductus choledochus communis. Наиболее распространён синдром холестаза при закупорке жёлчевыводящих путей различными камнями (жёлчнокаменная болезнь), реже гельминтами (клубком аскарид, пузырём эхинококка). Патогенез развивающихся при этом симптомов (недомогания, быстрой утомляемости, тошноты, иногда рвоты) однотипен (Рис. 2.8). В общем кровотоке регистрируются все компоненты жёлчи (холемия – жёлчекровие). Наблюдающаяся при этом гипербилирубинемия очень высока, причём увеличение идёт за счёт связанной фракции, отсутствует l-уробилин. Регистрируется гиперхолестеринемия, растёт количество глицерофосфатидов. Избыток холестерина поглощается макрофагами и накапливается в виде ксантом (в коже кистей, предплечий, стоп) или/и ксантелазм (в коже вокруг глаз). Соли жёлчных кислот возбуждают отделы парасимпатикуса, что сказывается на функционировании сердечно-сосудистой системы (развитие гипотонии, брадикардии). Мало того, они раздражают афферентные нервные окончания в коже, вызывая зуд, а выделяясь с мочой, провоцируют образование пены. 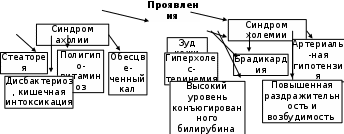 Рис. 2.8. Основные проявления механической желтухи Повышенное гидростатическое давление жёлчи в капиллярах не только вызывает слущивание поверхностных участков мембран холангиоцитов, но и оказывает токсический эффект на гепатоциты, повреждая их функции. Это выявляется в крови путём обнаружения повышенной активности щелочной фосфатазы (ЩФ), гамма-глутаминилтранспептидазы (ГГТП), 5'-нуклеотидазы, локализующихся обычно в плазмолеммах клеток жёлчевыводящих протоков. Длительная механическая желтуха, сопровождающаяся гипертензией и уменьшением печёночного кровотока, провоцирует гипоксию в гепатоцитах, дегенерацию фосфолипидов в их цитолеммах вплоть до некроза. Наряду с этим нарушается деятельность ЖКТ. Из-за отсутствия компонентов жёлчи в кишечнике кал не приобретает окраски (ахоличен – бесцветный). Дефицит солей жёлчных кислот препятствует эмульгированию липидов и активации ферментов их гидролиза, отсюда они не перевариваются и не всасываются, обусловливая жирную консистенцию фекалий. Вышеописанные нарушения в переваривании мешают абсорбции липовитаминов (А, Д, Е, К, F), что проявляется соответствующими симптомами их недостатка. В отличие от кала, который при механической желтухе теряет цвет, моча сохраняет окраску, но с несколько изменёнными оттенками и интенсивностью, т.к. они обусловлены не уробилином, а коньюгированным билирубином (Табл. 2.2). Таблица 2.2 Сравнительная характеристика биохимических показателей при различных видах желтух
Контрольные вопросы и задания: Перечислите основные компоненты и функции крови. Каков химический состав плазмы (белки, низкомолекулярные органические и неорганические компоненты плазмы)? В чем специфика строения мембраны эритроцита? Каковы метаболические особенности зрелых эритроцитов? Какие варианты патологии анаболизма гемоглобина Вы знаете? Какой фермент начинает распад гемоглобина? Что он делает? Назовите основные формы билирубина. Какая из них преобладает в крови здорового человека? Почему в норме не наблюдается билирубинурия? Приведите причины гипербилирубинемий. Укажите причины приобретённой гемолитической желтухи. Что может спровоцировать усиленный гемолиз эритроцитов при дефиците Г-6-ф ДГ? Назовите вероятные причины наследственных гемолитических желтух. Какая из наследственных паренхиматозных желтух имеет наиболее тяжёлое течение? Почему? Укажите причины механической желтухи. Почему при обтурационной желтухе в крови повышается активность щелочной фосфатазы? Почему в разгар механической желтухи у больных наблюдается замедление свёртывания крови? Как по картине крови можно отличить механическую желтуху от гемолитической? У больного 43 лет через 2 дня после подъема температуры до 38оС появилось желтушное окрашивание кожи и слизистых, моча потемнела, кал обесцветился. В крови уровень общего билирубина - 60 мкмоль/л, связанного - 25 мкмоль/л. В моче обнаруживается билирубин. Какой вид желтухи можно предположить? | ||||||||||||||||||||||||||||||||||||
