химия. Семинарские заняти по орган химии. Учебное пособие для студентов химических специальностей и направлений Сургут Издательство Сургу 2007
 Скачать 2.08 Mb. Скачать 2.08 Mb.
|
3. Дополнительные задачиКакие соединения называют ацеталями, полуацеталями? Что такое аномерный атом углерода? Что общего между понятиями мутаротация, аномеризация, эпимеризация и чем они отличаются друг от друга? Все монозы - альдозы и кетозы - являются восстанавливающими сахарами. Правильно ли это утверждение? Какими причинами можно объяснить наибольшую распространенность глюкозы среди сахаров? Могут ли подвергаться инверсии следующие биозы: мальтоза, лактоза, целлобиоза? Для биоз, подвергающихся инверсии, написать соответствующие химические реакции. Какие дисахариды вступают в реакцию мутаротации: сахароза, манноза, лактоза, целлобиоза? Ответ поясните. В чем общность и в чем различие между инверсией и мутаротацией углеводов? Покажите цикло-цепную таутомерию мальтозы, лактозы, целлобиозы, сахарозы. Семинар 20. Гетероциклические соединенияПРОГРАММАСтроение и свойства 5- и 6-членных гетероциклов. Ароматические гетероциклические соединения. Пятичленные гетероциклы с одним гетероатомом (фуран, тиофен, пиррол). Общие методы синтеза и взаимопревращения (Юрьев). Сравнительная характеристика химических свойств фурана, тиофена, пиррола и бензола. Химические свойства индола как аналога пиррола. Участие 5-членных гетероциклов в реакциях электрофильного и нуклеофильного замещения. Реакции присоединения. Шестичленные ароматические гетероциклы. Ароматичность и основность пиридинового цикла. Реакции электрофильного и нуклеофильного замещения в ядре пиридина и его N -окиси. Хинолин, синтез Скраупа. 1. Общие вопросыКакие типы органических соединений относятся к гетероциклическим соединениям? Объясните, почему пиридин является основанием, а пиррол практически не обладает такими свойствами. Почему пиррол неустойчив к действию сильных кислот (ацидофобность)? Расположите соединения в порядке уменьшения ароматичности: пиррол, тиофен, бензол и фуран. Какое соединение ряда бензола больше всего напоминает пиридин по отношению к электрофильным и нуклеофильным реагентам? Сравните электронное строение пятичленных гетероциклов - фурана, пиррола, тиофена - и поясните, почему они обладают свойствами ароматических соединений? Укажите направление дипольных моментов в этих соединениях. Почему фуран и пиррол (но не тиофен) для проведения реакций электрофильного замещения требуют использования специальных модифицированных электрофильных реагентов (ацетилнитрат, пиридинсульфотриоксид и т.д.)? У какого соединения: фурана, пиррола или тиофена более сильно выражены свойства диена с сопряженными связями? Напишите для него реакцию Дильса-Альдера с малеиновым ангидридом. Тиофен загрязняет каменноугольный бензол и не отделяется от последнего при перегонке. Напишите реакцию, применяемую для химической очистки бензола от тиофена. Сравните отношение пиррола и индола к электрофильным реагентам. Объясните причину имеющихся различий. Как разделить смесь тиофена и сильвана (α - метилфуран), не используя перегонку (каждый из компонентов должен быть выделен в индивидуальном состоянии)? 2. Основные задачиРасположите по возрастанию легкости вступления в реакции электрофильного замещения следующие соединения: а) пиррол, б) бензол, в) толуол, г) тиофен, д) фуран, е) мезитилен. Охарактеризуйте отношение фурана, пиррола и тиофена к действию электрофильных реагентов. Приведите механизм реакции электрофильного замещения в общем виде. Сравните устойчивость σ-комплексов, образующихся при атаке в положения 2 и 3. Сделайте вывод о преимущественном направлении этих реакций. Напишите реакции: а) бромирования при 100 оС 2-фуранкарбоновой кислоты (пирослизевой); б) нитрования фурфурола смесью азотной и серной кислот. Объясните, почему в таких же условиях нельзя проводить бромирование и нитрование фурана? Какие исходные вещества нужно использовать для синтеза Скраупа, чтобы получить 8-оксихинолин? Расшифруйте следующую схему превращений: 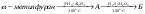 Какие вещества А и Б образуются в результате следующих реакций: а) 2,5-диметилфуран + уксусный ангидрид 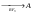 б) тиофен + уксусный ангидрид 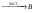 Приведите схему взаимного превращения фурана, пиррола и тиофена по Ю.К. Юрьеву. Заполните схему превращений, назовите полученные соединения: а) пиридин 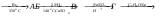 б) β-метилпиридин (β -пиколин) 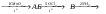 Какие соединения получаются при осуществлении синтеза пиридиновых оснований по Чичибабину, если исходным веществом служит пропионовый альдегид? В какие положения идет моно- и динитрование α - метоксипиридина? |
