этик. Учебное пособие для студентов лечебного, педиатрического, стоматологического и фармацевтического факультетов Тверь, 2006 г Лекции Гормоны и гормоноподобные вещества
 Скачать 0.67 Mb. Скачать 0.67 Mb.
|
ОБЩИЕ СВЕДЕНИЯ О ГОРМОНАХБазальная концентрация гормонов в крови (т.е. нестимулированная) чрезвычайно низкая и варьирует в пределах от микромолярных (10-6) до пикомолярных величин (10-12). Однако при стрессе и других чрезвычайных обстоятельствах их концентрация в течение нескольких секунд может увеличиваться на несколько порядков (например, в 1000 раз возрастает уровень адреналина при стрессе). Выполнив функции, гормоны должны также быстро инактивироваться. Происходит это под влиянием ферментов, которые катализируют их распад до конечных продуктов. Из этого следует, что для проявления своих биологических функций (регуляции обмена веществ, физиологических функций) гормоны должны быстро синтезироваться, активироваться, секретироваться, осуществлять свое биологическое действие и также быстро инактивироваться. Из этого правила есть исключение, например, половые и тиреоидные гормоны. Максимум их активности наблюдается лишь через несколько часов или даже дней. Эти особенности образования и действия гормонов важно помнить врачу при назначении пациентам гормонотератии. Среди перечисленных классов гормонов следует различать липофильные(III,IV) и гидрофильные (белково-пептидные – I, II) гормоны, т.к. их транспорт к месту действия и механизм регуляции обмена веществ, и физиологических функций различные. Транспорт гормонов Гормоны переносятся в потоке крови (кроме гормонов АПУД системы) от эндокринной железы к органам-мишеням. Растворимые в воде гормоны I и II класса циркулируют в свободном виде. Не растворимые в воде гормоны (стероидные и тиреоидные) находятся в сыворотке крови в комплексе со специфическими для них белками. Транспортные белки создают в крови как бы подвижный резерв гормонов. В соединении с белками они не разрушаются и не удаляются из кровяного русла. Но в этом случае они неактивны. Биологическая активность присуща только свободному, не связанному с белком гормону. Мишенью для каждого гормона чаще всего являются одна или несколько тканей. Например, щитовидная железа является мишенью для ТТГ, кора надпочечников для АКТГ, яичники и семенники - для гонадотропных гормонов гипофиза, инсулин - для скелетных мышц и жировой ткани. Как гормон находит место своего действия? Биологический эффект действия гормонов чаще всего начинается с их связывания со специфическими рецепторами, расположенными либо на поверхности мембран или ядре (для гидрофильных), либо в цитоплазме клеток (для липофильных), и завершается, как правило, диссоциацией комплекса на гормон и его рецептор. Все рецепторы гормонов имеют, по меньшей мере, два функционально разных домена (участка). Домен узнавания, который присоединяет специфический ему гормон, а второй домен генерирует сигнал в определенные внутриклеточные химические процессы. Количество рецепторов, участвующих в связывании гормона составляет несколько тысяч на клетку. Гормон-рецепторное взаимодействие зависит от рН среды, t0, концентрации солей и наличия большого числа органических молекул, присутствующих в клетке. Связывание гормона и рецептора обеспечивается гидрофобными и электростатическими механизмами и потому оно легко обратимо. Важно обратить ваше внимание, что количество рецепторов и их чувствительность к гормону находится в динамическом состоянии. Оно регулируется физиологическими механизмами и изменяется при заболевании и назначении врачом терапевтических средств Ответ на гормон наступает тогда, когда часть рецепторов клетки соединится с гормоном. Наличие другой части рецепторов, не соединенных пока с гормоном (резервные рецепторы) обеспечивает чувствительность клетки к разной концентрации гормонов. . В настоящее время синтезированы различные вещества, не идентичные по химическому строению гормонам, но они способные связываться с их специфическими рецепторами и вызывать гормоноподобный эффект или, наоборот, блокировать действие гормона. Эти химические соединения (лекарства), которые влияют на чувствительность клетки к гормонам можно разделить на 3 группы: - агонисты - вещества, которые соединяются с рецепторами и стимулируют максимальный ответ клетки на действие гормона (оральные контрацептивы – агонисты эстрогенов и прогестинов); - вещества - частичные агонисты - соединяются с рецептором и вызывают ослабленный ответ клеток на гормон; - антагонисты - вещества, которые соединяются с рецептором гормона, образуя с ним неактивный комплекс, и препятствуют действию гормона (противоопухолевые препараты). После того, как была выяснена роль рецепторов в действии гормонов, стало очевидно, что причиной эндокринного заболевания могут стать не только нарушения в функции эндокринной железы (биосинтезе гормона, секреции, его содержания и трансформации из неактивной формы в активную), но также действия антагонистов и других веществ на рецепторы. Возможна и наследуемая патология, когда дефект в гене приводит к образованию рецептора с нарушенной специфичностью к гормону или не образуется достаточного числа рецепторов. МЕХАНИЗМ ДЕЙСТВИЯ ГОРМОНОВ. Он различен для липофильных и гидрофильных гормонов, в связи с тем, что первые могут проникать через билипидный слой мембран клеток, вторые – нет. Механизм действия липофильных гормонов (стероидных, тиреоидных). Доказано, что липофильные гормоны диффундируют сквозь плазматическую мембрану всех клеток, но только в клетках мишенях они находят свой специфический рецептор, имеющий высокую степень сродства к гормону. Образуется комплекс гормон-рецептор, который далее активируется (модифицируется в присутствии ионов - изменяет величину, конформацию, заряд) и связывается с хроматином в определенной области ДНК и -либо активирует, -либо ингибирует действие регуляторных генов. Ген, к которому присоединяется гормон, содержит не менее 2-х элементов (сайты регуляции). Первый – промоторный элемент (ПЭ). Он универсален и определяет место прикрепления РНК-полимеразы II к ДНК. Второй элемент – гормон-чувствительный элемент (ГЧЭ). Он примыкает к структурным генам и моделирует инициацию транскрипции, а также процессы элонгации и терминации различных видов РНК. В некоторых случаях этот элемент расположен в самом транскрибируемом гене. В результате избирательного воздействия на транскрипцию генов и синтеза, прежде всего соответствующих мРНК, происходит изменение содержания в клетке-мишени определенных белков-ферментов, что изменяет в ней обмен веществ. Доказано также, что эстрогены и глюкокортикоиды могут влиять даже на мРНК и посттрансляционную модификацию некоторых белков. Механизм действия гидрофильных гормонов. Большинство из них не способны проникать через липофильную клеточную мембрану, и передача информации в клетку осуществляется через специфические для каждого гормона мембранные рецепторы. Рецепторы гидрофильных гормонов – это интегральные мембранные белки (многофункциональные), чаще – гликопротеиды, которые связывают свойственный только им гормон на внешней стороне мембраны, и затем за счет изменения своей конформации генерируют сигнал на внутреннюю сторону мембраны. Различают 3 типа рецепторов гидрофильных гормонов: рецепторы первого типа – это аллостерические ферменты, их контактный с гормоном участок расположен на наружной, а активный центр – на внутренней стороне мембраны. Многие из них являются тирозиновыми протеинкиназами (т.е. они активируют фосфорилирование остатков тирозина в ряде цитоплазматических белков). К этому типу принадлежат рецепторы инсулина, цитокинов и некоторых других гормонов. рецепторы второго типа – это олигомерные мембранные белки, из которых формируется ионный «канал». Связывание гормона ведет к открыванию канала для ряда ионов (Na+, K+или Cl-). Так действуют чаще всего нейромедиаторы – ацетилхолин, γ-аминомасляная кислота и другие. рецепторы третьего типа - передают сигналы с помощью вторичных мессенджеров. Ими являются цАМФ, цГМФ, Cа, инозит-3-фосфат, диглицерол, монооксид азота. Их образование или освобождение стимулируется внутри клетки энзимами только после прикрепления гормона к специфическому рецептору на внешней стороне мембраны. Так действуют катехоламины, глюкагон и др.гормоны белковой природы. Вторичные мессенджеры. цАМФ, цГМФ. Их образование катализируется аденилатциклазами (соответственно, гуанилат – циклазами). Активность последних контролируется, в свою очередь, G-белками, которые сопряжены с рецепторами третьего типа. Когда к ним прикрепляется гормон – ускоряется образование цАМФ и цГМФ. цАМФ является аллостерическим эффектором протеинкиназ А и ионных каналов. Протеинкиназа А стимулирует фосфорилирование и тем самым повышает или понижает активность многих цитоплазматических белков-энзимов (примером может служить механизм мобилизации гликогена адреналином). Ионы кальция. В цитоплазме клеток концентрация ионов кальция очень низкая (10-100 нМ) благодаря действию кальциевого «насоса» (Са-АТФ-аза), которая откачивает Са из цитоплазмы клеток. Резкое повышение концентрации ионов Са2+ до 500-1000 нМ происходит при открывании кальциевых каналов плазматической мембраны под влиянием некоторых гормонов (чаще нейромедиаторов). В клетке Са2+ связывается с белками – кальциевыми сенсорами (кальмодулином, тропонином), которые, изменяя свою конформацию, оказывают влияние на активность ферментов и ионных насосов. Инозит-3-фосфат (ИФ3) и диацилглицерид (ДАГ). Они образуются из фосфолипидов мембран клеток – фосфатидилинозитола под влиянием фосфолипазы С. ИФ3 поступает в цитоплазму и стимулирует высвобождение ионов Са2+ из кальциевых депо. ДАГ активирует протеинкиназу С. Последний энзим, совместно с ионами Са 2+, фосфорилирует различные белки-ферменты и повышает их активность. Принципы регуляции функции. Образование и концентрация гормонов в крови контролируются по принципу: прямой связи; обратной связи (длинная и короткая цепи). Иерархическая система гормональной регуляции (схема см. стр.7): 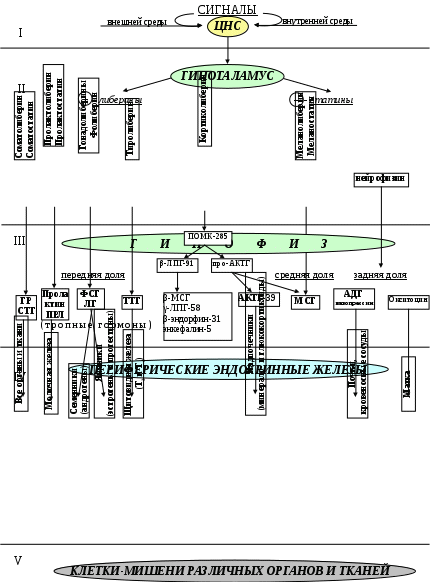    Первый уровень контроля гормональной активности сопряжен с функцией гипоталамуса (где под влиянием сигналов, поступающих из ЦНС или химических агентов внутренней среды организма человека образуются либерины и статины). Второй – в гипофизе (где под контролем либеринов и статинов гипоталамуса образуются тропные гормоны, а также окситоцин и вазопрессин). Третий – связан с функцией периферических эндокринных желез. Под влиянием теперь тропных гормонов гипофиза в коре надпочечников образуются глюко- и минералокортикоиды, в мозговом слое надпочечников – катехоламины, в щитовидной железе – Т3 и Т4, в половых железах – эстрогены, прогестины, тестостерон, и т.д. Далее, гормоны периферических эндокринных желез. Выделяются в кровь, улавливаются специфическими рецепторами органов-мишеней (тканями) и регулируют в них обмен веществ и физиологические функции. Таким образом, эндокринная система представляет собой, как выразились бы в технике, набор реле, через которые слабые сигналы из внешней или внутренней среды через ЦНС, через гипоталамус – гипофиз – периферические эндокринные железы - усиливаются и передаются специальным молекулам (ДНК→ РНК→ энзимы) в клетки органов-мишеней и регулируют в них обмен в нужном направлении. Важно также отметить, что функциональная активность всей эндокринной системы контролируется и регулируется по принципу не только прямой, но и обратной связи. Между всеми уровнями эндокринной системы существуют длинные и короткие цепи обратных связей. Короткая подразумевает обмен информацией между гипофизом и гипоталамусом, длинная – между гипофизом и гипоталамусом с одной стороны и периферическими эндокринными железами с другой. Гормоны гипоталамуса. Координирующим центром всей эндокринной системы является высокоспециализированная область мозга - гипоталамус. Он, в свою очередь, как это было отмечено выше, получает и интегрирует сигналы, поступающие из ЦНС. В ответ на эти сигналы гипоталамус выделяет ряд гормонов (рилизинг-факторов), которые теперь называют либеринами и статинами. По химической природе они являются сравнительно короткими олигопептидами (3 – 40 остатков аминокислот). Либерины и статины не выделяются в кровь, а по системе портальных капилляров достигают гипофиза и там регулируют образование и секрецию гипофизарных гормонов. Либерины стимулируют, а статины, наоборот, ингибируют эти процессы. К настоящему времени, выделены из гипоталамуса ряд - либеринов (кортиколиберин, тиролиберин, соматолиберин, пролактолиберин, фоллилиберин, гонадолиберин, люлиберин и др.) - и статинов (соматостатин, пролактостатин, меланостатин и др.). Либерины и статины, попадая в гипофиз, улавливаются специфическими рецепторами его клеток, и регулируют образование и секрецию гипофизарных гормонов. Инактивация либеринов и статинов осуществляется путем гидролиза их пептидных связей под влиянием тканевых протеиназ. Гормоны гипофиза: гипофиз состоит из 3 анатомических долей: передней, средней и задней, в которых образуются разные гормоны. Гормоны передней доли гипофиза (их называют - тропными гормонами), т.к. они управляют функцией периферических эндокринных желез. Передняя доля гипофиза продуцирует большое количество тропных гормонов, большая часть которых стимулируют функцию периферических эндокринных желез, некоторых из них самостоятельно регулируют различные физиологические и биохимические процессы непосредственно в органах-мишенях. Некоторые гормоны, родственные (по строению и функции) гормонам передней доли гипофиза, образуются в плаценте (ХС, ХГЧ). Все гормоны передней доли гипофиза принято делить на 3 группы: гормоны - простые белки (1-3); гликопротеиновые гормоны; пептидные гормоны семейства про-, опио-, меланокортина; I. Гормоны-белки: гормон роста (ГР) или соматотропный гормон (СТГ), пролактин (ПРЛ), хорионический соматомаммотропин (ХС) в плаценте. Все эти гормоны состоят из 190-199 почти одинаковых аминокислотных остатков. В связи с этим они имеют общие антигенные детерминанты и обладают рост-стимулирующим действием и лактогенной активностью. Гормон роста (ГР) или (СТГ). Концентрация ГР в гипофизе 5-15 мг/г – значительно превышает содержание других гипофизарных гормонов (мкг/г). Это одиночный пептид 191 АК. В организме человека активен только собственный ГР и высших приматов. На секрецию ГР оказывает влияние сон и стресс. Наибольший пик секреции отмечается вскоре после засыпания, что подтверждает поговорку: "Кто не спит, тот не растет". Другими стимуляторами образования ГР является: боль, холод, тревога, физические упражнения, острая гипогликемия, голодание, белковая пища и др. При стрессе в течение нескольких минут уровень ГР может повышаться в 10 раз. Положительным регулятором секреции ГР является соматолиберин и отрицательным - соматостатин. В целом, регуляция образования ГР – это очень сложный и многофакторный процесс. Физиологические и биохимические эффекты ГР. ГР необходим для постнатального роста. Ростовой эффект ГР опосредуется через ИФР-1 (инсулиноподобные факторы роста – I и II), который позднее стали называть соматомедином. Он образуется в печени и по структуре сходен с проинсулином. Помимо того, ГР участвует в регуляции белкового, углеводного, липидного, азотного и минерального обмена: Обмен белков. ГР стимулирует транспорт аминокислот в клетки и образование из них белка. В результате формируется положительный азотистый баланс. При этом усиливаются синтезы РНК и ДНК, поэтому ГР относят к анаболическим гормонам. Углеводный обмен – он антагонист инсулина, (т.е. повышает содержание глюкозы в крови). Гипергликемия при его введении – результат нарушения утилизации глюкозы и усиления глюконеогенеза из аминокислот. При длительном введении ГР возникает опасность развития сахарного диабета, угнетается гликолиз. Липидный обмен. Под влиянием ГР усиливается мобилизация липидов из депо и их окисление в печени, что может стать причиной кетогенеза. Минеральный обмен. ГР способствует положительному балансу [Са, Мg, Р], вызывает задержку Nа, К, Сl. Усиливает образование хряща у детей и рост длинных костей. Патология образования и секреции ГР. Недостаточность ГР. Она особенно опасна у детей, поскольку при этом нарушается их способность к нормальному росту. Значение ГР для роста организма наглядно иллюстрируют различные виды карликовости. Другие метаболические последствия этой недостаточности менее опасны. Гипофизарные карлики с дефицитом ГР нормально реагируют на экзогенный ГР. Однако, описаны случаи резистентности органов-мишеней к гормону (карликовость Ларона). У пигмеев имеется пострецепторный дефект в действии ГР. Избыток ГР (при опухоли гипофиза). Если он возникает до зарастания эпифизарных хрящей – у больного развивается гигантизм. Если после зарастания эпифизарных хрящей – акромегалия (чрезмерный рост стоп ног, кистей рук, черепа – челюсти, носа). Пролактин (ПРЛ) (лактогенный, маммотропин, лютеотропный). Индуктором секреции пролактина является раздражение грудных сосков, стресс, сон, а также сексуальные контакты. Уровень ПРЛ возрастает также на поздних сроках беременности и при лактации. Пролактин инициирует и поддерживает лактацию у животных. Он стимулирует совместно с женскими половыми гормонами рост молочной железы. Способен также поддерживать существование желтых тел, отсюда его другое название – лютеотропный гормон. С избытком образования ПРЛ связано возникновение аменореи (прекращения менструации) и галактореи (истечения молока), а также гинекомастии (увеличения грудных желез) и импотенции у мужчин. Хорионический соматомаммотропин (ХС) – образуется в плаценте и проявляет лактогенную и лютеотропную активность. Метаболические ответы на гормон напоминают действие гормона роста. гликопротеиновые гормоны: (ФСГ, ЛГ, ХГЧ, ТТГ) фолликулостимулирующий (ФСГ), лютеинизирующий (ЛГ), хорионический (ХГЧ), тиреотропный (ТТГ) гормоны. Названные гормоны состоят из 2-х полипептидных субъединиц, которые гликолизированы (олигосахара). ФСГ,ЛГ, и ХГЧ – относят к гонадотропным гормонам. Гонадотропные гормоны: Фолликулостимулирующий гормон (ФСГ) ≈ 200 АК. Органом-мишенью этого гормона являются фолликулы яичников у женщин и клетки Сертоли семенников у мужчин. У женщин гормон, прикрепляясь к рецептору фолликула, активирует аденилатциклазу и увеличивает образование ц-АМФ. Это стимулирует рост 1)фолликулов, 2) созревание яйцеклетки, 3) овуляцию и 4) секрецию эстрогенов. У мужчин ФСГ стимулирует рост семенных канальцев и семенников, играет важную роль в инициации сперматогенеза. В отсутствии ФСГ семенники атрофируются, и образование спермы не происходит. Концентрация ФСГ в плазме крови низка у детей и возрастает в ходе полового созревания. Появление пульсирующей секреции ФСГ и ЛГ (лютеинизирующего), особенно во время сна, свидетельствует о вступлении организма в период полового созревания. Содержание ФСГ у самок изменяется циклически, причем пик наступает во время овуляции или совсем незадолго до нее и превышает базальный уровень приблизительно в 10 раз. Лютеинизирущий гормон (ЛГ) ≈ 200 АК. ЛГ связывается со специфическими рецепторами плазматических мембран клеток хищников и стимулирует у самок образование прогестерона клетками желтых тел; у самцов тестостерона клетками Лейдинга. Роль мессенджера действия ЛГ выполняет ц-АМФ, которая активирует ферменты и усиливает образование гормона из холестерола. У самок пик секреции ЛГ зависит от концентрации эстрадиола. Максимум концентрации последнего наблюдается в середине менструального цикла, это индуцирует овуляцию и образование желтого тела, представляющего собой трансформированный без яйцеклетки фолликул. Секреция ЛГ передней доли гипофиза необходима для функции желтого тела, которое наряду с эстрадиолом начинает вырабатывать второй гормон яичников прогестерон. После оплодотворения и имплантации яйцеклетки, функция ЛГ гипофиза переходит к гормону плаценты – хорионическому гонадотропину (ХГЧ). Дело в том, что в течение первых 6-8 недель беременность поддерживается прогестероном, образуемым в желтом теле, затем сама плацента под влиянием ХГЧ начинает вырабатывать прогестерон в количестве, достаточном для поддержания беременности. При недостатке образования прогестерона – возрастает угроза выкидыша. Гонадотропные (ФСГ, ПРЛ, ЛГ) гормоны стимулируют также развитие вторичных половых признаков, развитие половых органов, в том числе простаты, семявыводящих протоков и семенных пузырьков. Избыток ЛГ у женщин может индуцировать образование ряда андрогенов и в частности тестостерона. Так, например, у больных с поликистозом яичника (синдром Штейна - Левенталя) обнаруживается повышенное содержание ЛГ, которое стимулирует продукцию андрогенов. Это приводит к снижению фертильности (плодовитости) увеличению массы тела, усиленному росту волос на теле и лице женщины. В) Хорионический гонадотропин человека (ХГЧ). Этот гликопротеид синтезируется клетками синцитио-трофобластами плаценты. Содержание ХГЧ в крови и моче возрастает вскоре после прикрепления оплодотворенного яйца в эндометрии матки и поэтому его определение лежит в основе методов диагностики беременности. Регуляция секреции ФСГ и ЛГ. Секреция ФСГ и ЛГ носит эпизодический волновой характер. Содержание обоих гормонов в плазме сильно варьирует; пик наблюдается в середине менструального цикла. Это ведет к увеличению образования и содержания половых гормонов (эстрадиола, а затем прогестерона), которые по принципу обратной связи подавляют секрецию ФСГ и ЛГ. В результате наступает физиологическая атрофия яичников в период менопаузы. В крови понижается содержание эстрогенов и прогестинов. Это снова стимулирует гиперсекрецию обоих гонадотропинов (ФСГ, ЛГ). Высвобождение ФСГ и ЛГ стимулируется также гипоталамическим фактором – гонадолиберином. Образование гонадолиберинов, как и гонадотропных гормонов (ФСГ, ЛГ), тормозится тестостероном у мужчин и эстрадиолом у женщин. На этом примере мы видим принцип регуляции эндокринной активности короткой и длинной цепями обратной связи. г 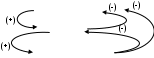 ипоталамус гонадолиберины ипоталамус гонадолибериныгипофиз ФСГ, ЛГ яичники эстроген, прогестин Г) Тиреотропный гормон (ТТГ, тиреотропин) две цепи: 96 и 112 АК. Это гликопротеид. Подобно другим гормонам этой химической природы ТТГ связывается со специфическими ему рецепторами на плазматической мембране клеток только щитовидной железы и активирует аденилатциклазу. Повышение содержания ц-АМФ стимулирует биосинтез тиреоидных гормонов (Т3, Т4). Этот эффект проявляется уже через несколько минут. Наряду с этим, формируется долговременный эффект. Он проявляется увеличением размеров и количества тиреоидных клеток. Регуляция секреции ТТГ в свою очередь контролируется тиролиберином (трипептид), вырабатываемым гипоталамусом. В связи с быстрым исчезновением из плазмы тиролиберина (t1/2= 4 мин), он не используется для длительной терапии заболеваний щитовидной железы. III. Семейство пептидов: проопиомеланокортин (ПОМК) передней доли гипофиза Это семейство полипептидов, действующих либо как гормоны (АКТГ, липотропин, меланоцитстимулирующий гормон), либо как нейромедиаторы (эндорфины). Предшественник всех этих гормонов собран из 285 аминокислотных остатков. Этот одиночный полипептид, который называют ПОМК, далее делится на фрагменты, которые модифицируются в АКТГ, β-липотропин, β-эндорфин и т.д. Перечисленные пептиды претерпевают множественные модификации (гликозилирование, фосфорилирование и т.д.) прежде чем стать гормоном. Контролирует образование и высвобождение ПОМК из передней доли гипофиза кортиколиберин гипоталамуса. Стимулирующий эффект кортиколиберина прекращается с повышением в крови глюкокортикоидных гормонов. В связи с этим нужно предупредить лечащих врачей о том, что длительное введение с терапевтической целью глюкокортикоидов приведет к ингибированию секреции АКТГ и нарушению функции коры надпочечников (принцип обратной связи). А) АКТГ – полипептид, собранный из 39 остатков аминокислот. Он регулирует рост и функцию коры надпочечников. АКТГ, прикрепляясь к рецепторам клеток коры надпочечников, повышает активность аденилатциклазы и образования ц-АМФ, что усиливает превращение эфиров холестерина в прегненолон, а затем в глюко- и минералокортикоиды, а также предшественников андрогенов. АКТГ через ц-АМФ стимулирует также липолиз, активируя ТГ-липазу. При избыточном образовании АКТГ (при опухоли гипофиза) развивается синдром Кушинга, который характеризуется: отрицательным азотистым, калиевым и фосфорным балансом; задержкой Nа, которая сопровождается увеличением АД, отеками; нарушением толерантности к глюкозе и развитием сахарного диабета; повышением в плазме содержания ВЖК; уменьшением количества эозинофилов и лимфоцитов; Возникающие метаболические нарушения обусловлены гиперпродукцией стероидов коры надпочечников. Б) β-Липотропин (β-ЛПТ) состоит из 91 аминокислотного остатка и содержит последовательности: β-меланоцитстимулирующего гормона, γ-липотропина, β-эндорфина и мет-энкефалина. β-ЛПГ стимулирует прежде всего липолиз и мобилизацию ВЖК, отсюда и его название, однако, ведущее его значение – предшественник эндорфинов. В) Эндорфины. Это прежде всего β-эндорфин. Он представляет собой участок β-липотропина и содержит 31 аминокислотный остаток, из него далее образуются α- и γ-эндорфины. Для образования α- и γ-эндорфинов требуется отщепление от С-конца β-эндорфина соответственно 15 и 14 аминокислотных остатков. Эти пептиды обнаруживаются в гипофизе. Выделяясь, они модифицируются и прикрепляются к рецепторам органа-мишени – клеткам ЦНС и играют важную роль в эндогенной регуляции чувствительности к боли. Причем они обладают более высокой активностью, чем морфин (18 – 30 раз). Гормоны задней доли гипофиза (вазопрессин и окситоцин). Х   имическая природа этих гормонов изучена подробно. Оба гормона являются олигопептидами (вернее нонапептидами) и собраны из 9 почти одинаковых аминокислот: имическая природа этих гормонов изучена подробно. Оба гормона являются олигопептидами (вернее нонапептидами) и собраны из 9 почти одинаковых аминокислот:Вазопрессин: Цис – Тир – Фен – Гли – Асн – Цис – Про – Арг – Гли Окситоцин: Цис – Тир – Иле – Гли – Асн – Цис – Про – Лей - Гли Отличия: в вазопрессине остатки Фен и Арг, а в окситоцине – Иле и Лей. Синтезируются эти гормоны в действительности в гипоталамусе, затем переносятся в нервные окончания задней доли гипофиза, из которых секретируются в кровоток. Каждый из этих гормонов перемещается по аксону в связанной форме со специфическим белком - переносчиком (нейрофизин). В крови этот белок отщепляется, и тогда через 2-4 минуты гормоны проявляют свою активность. А) Вазопрессин получил свое название благодаря его способности повышать АД. Правильнее его называть антидиуретическим гормоном (АДГ), поскольку его самое важное физиологическое значение – стимуляция реабсорбции воды в дистальных почечных канальцах и регуляция осмолярности плазмы. Эффект опосредуется через осморецепторы гипоталамуса, а также барорецепторы, расположенные в сердце и др. отделах сосудистой системы. Повышение осмолярности плазмы стимулирует образование АДГ. Снижение осмолярности вызывает противоположный эффект, т.е. понижение образования АДГ. Мишенью для АДГ являются рецепторы эпителиальных клеток дистальных извитых канальцев и собирательных трубочек почек. В отсутствие АДГ клетки этих протоков относительно непроницаемы для воды. Моча не концентрируется и может выделяться в количествах, превышающих 20 л/в сутки. АДГ, присоединяясь к рецепторам этих клеток, стимулирует образование ц-АМФ, что усиливает деполимеризацию гиалуроновой кислоты, увеличивает проницаемость клеток для воды, и это способствует ее реабсорбции. Объем мочи тогда не превышает 1,0-1,5 л/сутки. Описанное физиологическое действие послужило основанием, чтобы назвать этот гормон "антидиуретическим". Несахарный диабет, связанный с дефицитом АДГ, обычно развивается при повреждении гипоталамо-гипофизарного тракта при переломах основания черепа, опухоли или инфекции. Гиперсекреция АДГ, наоборот, ведет к увеличению реабсорбции воды из первичной мочи и выделению мочи гипертонической, что угрожает развитием мочекаменной болезни. Б) Окситоцин получил название в связи с ускорением под его влиянием родов. Он усиливает сокращение гладких мышц матки. Наряду с этим, гормон стимулирует секрецию молока из молочной железы. Механизм действия окситоцина неизвестен. В клинике используется для стимуляции родовой деятельности. Мембранные рецепторы для окситоцина обнаружены в тканях матки и молочной железы. К настоящему времени получены многочисленные аналоги окситоцина. Гормоны средней доли гипофиза (меланотропины) В ней образуются и секретируются в кровь гормоны меланотропины, стимулирующие рост меланоцитов и биосинтез ими пигментов (меланинов), от которых зависит окраска волос, кожных покровов и радужки глаз. |
