|
|
этик. Учебное пособие для студентов лечебного, педиатрического, стоматологического и фармацевтического факультетов Тверь, 2006 г Лекции Гормоны и гормоноподобные вещества
Разные ткани по-разному реагируют на адреналин:
- мозг - усиление кровотока и повышение обмена глюкозы;
- сердечно-сосудистая система – увеличение частоты и силы
сокращения сердца, сужение периферических сосудов;
легкие – расширение бронхов, увеличение вентиляции, улучшение снабжения тканей кислородом;
мышцы – усиливается гликогенолиз, происходит повышение мышечной активности;
печень – глюконеогенез, гликогенолиз – усиливаются, а синтез гликогена, наоборот, снижается;
жировая ткань – повышение липолиза и увеличение в крови СЖК;
кожа – снижение в ней кровотока;
кровь – в ней повышается содержание глюкозы и высших жирных кислот.
В целом, гормоны мозгового вещества надпочечников – катехоламины – обеспечивают адаптацию организма к острым и хроническим стрессам. Адреналин, норадреналин и дофамин в связи с этим называют гормонами «борьбы и бегства». Все это делает адреналин ценнейшим лечебным средством, особенно в критических ситуациях, например, при сердечном коллапсе. Обратный захват катехоламинов нейронами – важный механизм, обеспечивающий:
быстрое прекращение гормональной активности и
сохранения гормонов в синапсах.
Мозговой слой надпочечников не может обратно захватывать катехоламины. Большая часть катехоламинов инактивируется с образованием метанефрина и ванилинминдальной кислоты, которые выделяются с мочой и используются для диагноза заболеваний, связанных с нарушением функции мозгового слоя надпочечников.
При феохромацитоме – опухоли мозгового слоя надпочечников – в крови повышается содержание адреналина и норадреналина. Если повышается первый, наблюдается гиперметаболизм, если второй – гипертензия. В моче при феохромацитоме концентрация метанефрина повышается у 95% больных.
Гормоны половых желез (стероидные гормоны)
Половые железы – яичники и семенники – бифункциональные органы. Они продуцируют:
зародышевые клетки
половые гормоны.
I. В яичниках образуются яйцеклетки и эстрогены; а в трансформированной яйцеклетке (желтом теле) - прогестины. В семенниках образуются сперматозоиды и тестостерон. Следовательно, нормальное функционирование половых желез - важнейшее условие, обеспечивающее размножение и выживание видов.
Помимо этого, половые гормоны обладают анаболическим эффектом действия, в эмбриональном периоде они контролируют дифференцировку тканей, в постнатальном рост и развитие особи.
II. Образуются половые гормоны, как и другие стероидные гормоны, из холестерина (или из ацетил-КоА), через стадию образования прегненолона. Скорость их образования регулируется гонадолиберинами и гонадотропинами (ФСГ и ЛГ), а также с помощью петлей обратной связи.
Мужские половые гормоны
В семенниках функционируют три типа клеток:
сперматогонии - ответственны за образование сперматозоидов;
клетки Лейдига – продуцируют тестостерон;
клетки Сертоли – секретируют белок, связывающий андрогены.
Помимо тестостерона, в семенниках у мужчин образуются дигидротестостерон, а также небольшое количество женского полового гормона – эстрадиола. Роль последнего у мужчин не установлена, возможно, с его помощью контролируется образование ФСГ гипофиза.
Суточная секреция главного мужского полового гормона тестостерона составляет 5 мг в сутки. В плазме крови гормон связывается со специальным белком СГСГ (секс-гормон-связывающим глобулином). Образуется этот белок в печени. Небольшая часть тестостерона связывается в плазме крови также с альбумином. Биологически активным является только свободный, не связанный с белками гормон. Его доля составляет всего 1-3% от общего содержания гормона. СГСГ – очевидно служит мобильным депо для гормонов.
До пубертатного периода в сыворотке крови содержится очень мало тестостерона. С возрастом усиливаются, особенно ночью, импульсы секреции ФСГ и ЛГ. Они стимулируют стероидогенез и образование тестостерона путем связывания с рецепторами на плазматической мембране клеток Лейдига, активирует аденилатциклазу, образование с-АМФ, что ускоряет отщепление от холестерина боковой цепи и образованиеиз него вначале прегненолона, а затем тестостерона.
Тестостерон и дигидротестостерон участвуют в :
половой дифференцировке на этапе эмбриогенеза;
развитии вторичных половых признаков;
сперматогенезе;
анаболических процессах, росте и развитии особи;
определяют половое поведение.
Тканями-мишенями для этих гормонов служат:
предстательная железа;
семенные пузырьки
половые органы.
Свободный тестостерон проникает в клетки этих тканей путем пассивной и облегченной диффузии и связывается в цитоплазме со специфическим белком. Далее этот гормон-рецептор комплекс проникает в ядро, прикрепляется к определенным участкам хроматина (к генам) и стимулирует образование т-РНК, м-РНК и р-РНК. Этим андрогены стимулируют рост скелета и увеличение массы мышц.
Анаболическое действие тестостерона явилось предпосылкой использования этого гормона для ускорения роста детей в период, предшествующий половой зрелости.
Тканью-мишенью для андрогенов являются также почки. Это приводит к увеличению массы почек и нормализует их функцию.
Важно также отметить, что при введении мужских половых гормонов у женщин тормозится ответная реакция на женские половые гормоны и, наоборот, у мужчин тормозится реакция на мужские половые гормоны после введения им женских половых гормонов. Этот эффект послужил основой для организации лечения у женщин с помощью тестостерона карциномы молочной железы. У мужчин этот принцип лечения используется при карциноме предстательной железы. Больным назначают эстрогены и удаляют семенники.
Для лечения используют перорально чаще всего синтетический аналог гормона – метилтестостерон. Его активность в этом случае составляет 1/6 от активности гормона, вводимого в инъекции.
Катаболизм (распад) тестостерона осуществляется двумя путями:
окислением в С17 -положении и
восстановлением двойной связи в кольце А и 3-кетогруппы.
В результате образуются неактивные 17-кетостероиды (андростерон и этиохоланолон). Они соединяются в печени с глюкуроновой или серной кислотой, становятся водорастворимыми и выводятся с мочой. Однако, определение в моче содержания 17-кетостероидов слабо отражает гормональный статус, т.к. стероидные гормоны коры надпочечников тоже удаляются из организма с мочой в виде 17-кетостероидов.
Нарушения репродуктивной системы у мужчин
Снижение уровня синтеза тестостерона называют гипогонадизмом. При гипогонадизме у детей - вторичные половые признаки не развиваются. У взрослых - вторичные половые признаки претерпевают обратное развитие.
Первичный гипогонадизм обусловлен процессами нарушения образования ряда ферментов, катализирующих образование гормонов и его рецепторов (наследуемая патология). В настоящее время известны не менее 5 разных генетических дефектов в биосинтезе тестостерона. Степень нарушения половой дифференцировки зависит от тяжести дефицита.
Полное отсутствие одного из ферментов биосинтеза тестостерона обуславливает женский фенотип (совокупность признаков, присущих данному полу) при мужском (ХУ) генотипе (совокупность генов).
При умеренной недостаточности фермента может наблюдаться лишь аномалия в локализации мочеиспускательного канала в половом члене.
При отсутствии рецепторов на тестостерон (гормон синтезируется в достаточном количестве) наблюдается полная феминизация наружных половых органов (синдром тестикулярной феминизации).
Женские половые гормоны (гормоны яичников).
Яичники - трифункциональные органы - продуцируют:
1 Яйцеклетки
2.Эстрогены (эстрадиол, эстрон и эстриол)
3. Прогестины (прогестерон)
Созревание фолликулов у девочек начинается в младенческие годы. На протяжении всего препубертатного периода яичники увеличиваются в размерах в результате увеличения объема фолликулов, но овуляции нет, т.к. незрелые яичники обладают малой способностью синтезировать эстрогены, и в детстве концентрация половых гормонов низка.
В период полового созревания начинается импульсная секреция гонадолиберинов, затем под влиянием ЛГ и ФСГ резко повышается уровень образования и секреции гормонов яичников.
Наиболее активный гормон яичников – эстрадиол.
Основной путь биосинтеза эстрадиола в фолликулах напоминает путь биосинтеза из холестерина других стероидных гормонов. Значительная часть эстрогенов образуется путем периферической ароматизации андрогенов. В период менопаузы источником эстрогенов служат также андрогены надпочечников. В печени у женщин эстрадиол и эстрон превращаются в эстриол.
Прогестины образуются в желтом теле.
Половые гормоны не накапливаются, а сразу же секретируются. В плазме крови они, подобно другим стероидным гормонам, связываются с различными транспортными белками плазмы. Эстрогены связываются с СГСГ (секс-гормон-связывающий глобулин), а прогестин – с КСГ (кортикостерон – связывающий глобулин). Биологической активностью обладает только свободная от белка форма гормона. Связанный с белком - это резервная форма гормона, т.е. белок, выполняет роль буферной системы гормона, противостоящей резким колебаниям уровня гормона в крови.
Основная функция гормонов яичника (эстрогенов и прогестинов) - подготовка структурных компонентов женской половой системы к размножению и вынашиванию плода: а именно они обеспечивают:
Эстрогены:
1. Созревание примордиальных зародышевых клеток;
2. Развитие тканей, необходимых для имплантации бластоцитов;
3. Осуществляют гормональный контроль времени овуляции;
Прогестины:
4. Совместно с плацентарными гормонами они необходимы для поддержания беременности;
Оба:
5. Они контролируют гормональную регуляцию сохранение беременности и родов и лактацию.
Эстрогены – прежде всего стимулируют развитие тканей, участвующих в размножении. Под их влиянием усиливается биосинтез р-РНК, т-РНК, м-РНК, ДНК, белков. Эстрогенная стимуляция обеспечивает пролиферацию эндометрия, созревание ее желез; появление собственной ритмической подвижности миометрия, а также пролиферацию протоков грудных желез.
Эстрадиол оказывает также анаболическое действие на кости и хрящи, способствуя их росту.
Прогестины:
Для проявления активности прогестинов обычно требуется предшествующее или одновременное действие эстрогенов, т. е. гормоны двух этих классов часто функционируют синергично, хотя могут быть и антагонистами (в зависимости от вида клеток и времени действия). Например, прогестины уменьшают стимулирующее действие эстрогенов на пролиферацию эпителия влагалища и способствуют переходу эпителия матки из пролиферативной фазы в секреторную, подготавливая его к имплантации оплодотворенной яйцеклетки.
Прогестины снижают периферический кровоток, уменьшая тем самым теплопотерю. В результате в лютеиновой фазе менструального цикла, температура тела женщины повышается на 0,50С, что используется в качестве показателя овуляции.
Частота овуляции и Менструальный цикл.
Менструальный цикл.
Частота овуляции (менструальный цикл) и возможность беременности определяются ритмом образования и секреции половых гормонов. У животных с моноэстральным циклом овуляция и спаривание происходят раз в году; у видов с полиэстральным циклом овуляция и спаривание повторяется несколько раз в году. У приматов, у которых менструальные циклы происходят с отторжением эндометрия в конце каждого цикла, половое поведение не имеет тесной связи с овуляцией.
Менструальный цикл у женщин обуславливается сложным взаимодействием между гипоталамусом, гипофизом и яичниками. В норме у женщин продолжительность менструального цикла варьирует от 25 до 35 дней (в среднем 28). Его можно подразделить на фолликулярную фазу, лютеиновую фазу и менструацию. В эти периоды уровень образования и секреции выше перечисленных женских половых гормонов резко изменяется, причем неоднозначно.
Фолликулярная фаза.
По каким-то невыясненным причинам под влиянием ФСГ начинает увеличиваться лишь один из фолликулов. В первую неделю фолликулярной фазы содержание эстрадиола остается низким, но затем по мере увеличения фолликула – его концентрация в крови начинает прогрессивно повышаться.
За 24 часа до пика ЛГ (ФСГ) уровень эстрадиола достигает максимума и повышает чувствительность, т. е. сенсибилизирует гипофиз к действию гонадолиберина. За этим следует выброс ЛГ и овуляция. Содержание прогестерона в фолликулярной фазе мало.
Лютеиновая фаза.
После овуляции клетки гранулезы, лопнувшего фолликула, лютеинизируются и образуют желтое тело - структуру, которая вскоре начинает вырабатывать гормон лютеиновой фазы - прогестерон. Он необходим для развития имплатировавшейся бластоцисты. На первых этапах для сохранения и функции желтого тела требуется присутствие ЛГ, и гипофиз примерно в течение 10 дней выделяет его. Если имплантация оплодотворенной яйцеклетки произошла (22-24 день), функцию ЛГ берет на себя хорионический гонадотропин (ХГЧ). ХГЧ - плацентарный гормон, по химическому строению очень близкий к ЛГ. Он поддерживает синтез прогестерона желтым телом до тех пор, пока плацента сама не начнет продуцировать большие количества этого стероида.
В отсутствие имплантации оплодотворенной яйцеклетки, т.е. отсутствие (ХГЧ), желтое тело деградирует и наступает менструация.
После отторжения эндометрия начинается новый цикл. Лютеиновая фаза всегда длится 14+\-2 дней. Колебания продолжительности цикла во всех случаях обусловлены различиями в фолликулярной фазе.
Беременность и плацентарные гормоны.
Имплантированная бластоциста образует трофобласт, который впоследствии организуется в плаценту. Именно плацента обеспечивает связь между системами кровообращения зародыша и матери, а также вырабатывает ряд гормонов и, прежде всего ХГЧ - (хорионический гонадотропин человека). Этот гормон поддерживает существование желтого тела до тех пор, пока плацента не начнет продуцировать прогестерон в количествах достаточных для нормального течения беременности. ХГЧ обнаруживается уже через несколько дней после имплантации яйцеклетки, что используется для ранней диагностики беременности. Содержание этого гормона достигает максимума к середине первого триместра, постепенно снижаясь на протяжении остальной части беременности.
В первые 6-8 недель беременности главным источником прогестерона служит желтое тело, а затем эту функцию берет на себя плацента. Она вырабатывает в 30-40 раз больше прогестерона, чем желтое тело.
При беременности в крови беременной постепенно повышается также концентрация эстрадиола, эстерона и особенно эстриола. Последний синтезируется в виде предшественника в надпочечниках плода, затем поступает в печень, там модифицируется, перемещается в плаценту, где преобразуется в эстриол. Этот гормон далее перемещается в кровь матери. Выполнив функции, он попадает в печень матери, где коньюгирует с глюкуроновой кислотой и в таком виде выделяется с мочой. В связи с выше изложенным определением содержания в моче беременной эстриола пользуются для оценки хода беременности, оценки состояния плода и матери.
Роды.
Беременность продолжается строго определенное число дней, специфичное для каждого вида животного. Фактор, отвечающий за окончание беременности, не установлен. Возможно, что эту роль выполняют эстрогены и прогестины, а также катехоламины и окситоцин.
Окситоцин стимулирует сокращение матки, и в клинике его используют для стимуляции родов. Содержание рецепторов к окситоцину в матке к концу беременности возрастает более чем в 100 раз.
При родах у матери и плода резко изменяется гормональный статус. После отторжения плаценты содержание в плазме матери прогестерона (в виде прегнандиола) и эстриола быстро понижается.
Развитие молочной железы и лактация.
Некоторое разрастание железистой ткани с отложением в ней жировой ткани, происходит при половом созревании; однако, наибольшего развития
железа достигает при беременности. Тогда железистая ткань подвергается
воздействию высоких концентраций эстрадиола и прогестерона. Для полной
подготовки ткани молочной железы к лактации требуется также действие пролактина, глюкокортикоидов, инсулина, фактора роста, неустановленного химического состава.
Повышение концентрации пролактина играет особо важную роль. На поздних стадиях беременности его содержание увеличивается от 2 нг% до 200 нг% (100 раз). В сумме все перечисленные гормоны стимулируют биосинтез различных белков молока (лакто-альбуминов, глобулинов, казеиногена) путем увеличения содержания специфических м-РНК.
Однако, на поздних стадиях беременности лактация молока подавляется действием прогестерона. Лактация начинается только после родов, когда плацента удаляется содержание этого гормона в крови матери резко снижается.
Содержание пролактина после родов также быстро уменьшается, но возрастает при каждом акте кормления, поддерживая, таким образом, непрерывную лактацию.
Кормление грудью стимулирует также секрецию окситоцина, который усиливает сокращение протоков и способствует выделению молока. Если ребенка не прикладывают к груди, лактация постепенно прекращается. Парентеральным введением больших доз андрогенов до начала вскармливания можно вызвать быстрое прекращение лактации.
Менопауза
У женщин Европы в возрасте около 53 лет менструальные циклы становятся нерегулярными. Из яичников исчезают фолликулы и прекращается их функция. Ароматизация некоторых стероидов надпочечников приводит к образованию эстрона, обладающего весьма слабой эстрогенной активностью. Однако других источников эстрогенов в организме нет. В результате у женщин этого возраста возникает две проблемы:
- эстрон не всегда способен предотвратить атрофию вторичных половых признаков;
- усиливается остеопороз в связи с изменением гормонального статуса.
Выполнив функции, эстрадиол, эстрон и эстриол соединяются с глюкуроновой или сульфатной группой. Коньюгированные стериды водорастворимы, они легко выделяются с желчью, калом и в меньшей степени с мочой. Прогестины – их основной метаболит, обнаруживаемый в моче человека – прегнандиол-глюкуронид- Na.
Синтетические агонисты и антагонисты
эстрогенов и прогестинов.
Некоторые синтетические соединения обладают эстрогенной активностью. Они имеют при этом даже фармакологические преимущества - не влияют на метаболизм веществ в печени.
Агонисты: - диэтилстильбестрол,
- этинилэстрадиол,
- местранол, используемые в качестве пероральных контрацептивов.
Антагонисты: - клофимет-цитрат (кломид),
- нафоксидин,
- тимоксифен,
конкурируют с эстрадиолом за его рецепторы. Соединяясь прочно с ними, блокируют действие гормона и используются для лечения рака молочной железы.
Синтез соединений, которые обладали бы прогестиновой активностью, не оказывая при этом андрогенной или эстрагенной активности, оказался трудным. Предлагаются в настоящее время:
- норэтиндрон
- медроксинпрогестерон-ацетат. Они обладают контрацептивным действием, особенно второй, а также используются для лечения рака эндометрия.
Нарушения женской репродуктивной системы.
1) - первичный гипогонадизм - является результатом поражения яичников (ослабление овуляции, понижение образования гормонов).
2) - вторичный гипогонадизм - обусловлен выпадением функции гипофиза.
3) Синдром поликистозных яичников (синдром Штейна-Левенталя), при котором обнаруживается гиперпродукция андрогенов. Симптомы заболевания: гирсуитизм – избыточное оволосение, ожирение, нерегулярные менструации, пониженная фертильность.
Пузырный занос - следствие наличия остаточной трофобластной ткани (плаценты), продуцируется большое количество ХГЧ, возможна малигнизация.
Половая дифференцировка.
Она включает в себя ряд последовательных процессов, которые совершаются с момента оплодотворения клетки:
I. Хромосомный пол. Это первая фаза половой дифференцировки. Она возникает при оплодотворении яйцеклетки и определяется набором хромосом.
У человека набор половых хромосом ХУ детерминирует мужской пол, а сочетание двух Х-хромосом (генотип - ХХ) предопределяет женский пол. Каких либо данных о способности гормонов влиять на хромосомное предопределение пола не имеется.
II. Гонадный пол. На первых стадиях развития мужские и женские эмбрионы не различаются. На 35-50 день заканчивается образование первичной гонады. Она еще не имеют половых различий. С 56 дня в процесс включаются гормоны, и может начинаться дифференцировка гонад. Если дифференцировки не происходит, то все эмбрионы развиваются в фенотипических женщин.
Дифференцировка первичной гонады в семенник связана с наличием специфического мужского антигена клеточной поверхности, так называемого Н-У - антигена. При отсутствии этого эффекта даже ХУ-хромосомы будут стимулировать развитие женских гонад.
Фенотипический пол. Внутренние мужские половые органы развиваются из вольфовых протоков, женские - из мюллеровых. Будут ли у эмбриона развиваться вольфовые или мюллеровые протоки, зависит от образования особого тестикулярного фактора (фактор ингибирования мюллеровых протоков - ФИМП).
Тип наружных половых органов – определяется присутствием или отсутствием тестостерона. Синтезу последнего – предшествует маскулинизация плода. Для развития вторичных половых признаков мужчин важно наличие в организме плода дигидротестостерона (ДГД).
Гормоны поджелудочной железы
В поджелудочной железе в разных ее клетках образуется 4 гормона:
- инсулин в В -клетках
- глюкагон в А-клетках
- соматостатин в D-клетках
- панкреатический полипептид в F-клетках
Инсулин – по химическому строению – это белок с небольшой молекулярной массой. Он состоит из двух полипептидных цепей А и В (21 и 30 аминокислотных остатков соответственно), объединенных дисульфидными мостиками. В-клетки вначале синтезируют белок-предшественник инсулина. Его называют препроинсулином и состоит он из 104 остатков аминокислот. В течение нескольких минут от него с N-конца отщепляется микросомальными протеазами фрагмент полипептидной цепи и образуется проинсулин. Он переносится в аппарат Гольджи β-клеток, где происходит его «упаковка» в микропузырьки. В этих секреторных гранулах мембранными протеазами в проинсулине выстригается С-пептид, и проинсулин превращается в инсулин. Высвобождение содержимого из зрелых гранул (микропузырьков) происходит путем их перемещения к плазматической мембране В-клеток. После слияния их мембран инсулин и С-пептид выталкиваются во внеклеточное пространство (экзоцитоз) и затем попадают в кровь.
В периферической крови здоровых лиц доля проинсулина не превышает 15% от общего содержания активного инсулина. При патологии доля проинсулина может возрастать до 65-90% от общего количества инсулина плазмы. Однако активность его в 20 раз ниже , чем у инсулина, что вызовет возникновение патологии.
Концентрация инсулина в плазме периферической крови составляет 10-20 миллиЕд/литр.
У больных сахарным диабетом, получавшим с терапевтической целью инсулин других животных (свиной, крупного рогатого скота), выробатываются антитела к этому гормону, и они препятствуют определению инсулина крови методами РИА (радиоиммуннологического) и ИФА (иммуноферментного) анализов. В таких случаях оценить содержание собственного эндогенного инсулина можно лишь через определение С-пептида. В норме соотношение С-пептид/инсулин в плазме крови составляет: 0,9-3,5 / 0,4-0,8 нг/мл (1 мг инсулина содержит 20 МЕ). Количество С-пептида в этом случае дает представление о содержании инсулина в плазме. Если в крови мало С-пептида на фоне высокого содержания инсулина – это экзогенный, чаще свиной, инсулин. Инсулин свиной отличается от гормона человека только присутствием аланина вместо треонина в терминальном положении В-цепи. Бычий инсулин имеет большее число различий в составе аминокислот. Разработан и осуществляется в настоящее время синтез инсулина человека с помощью обратной транскриптазы. Синтетические гены, кодирующие инсулин, объединяют с геномом клетки E.coli, которые начинают синтезировать инсулин человека.
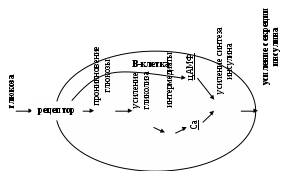
1. Регуляция секреции инсулина. Наиболее мощным регулятором секреции инсулина является глюкоза. Колебания инсулина в плазме крови у здоровых лиц повторяют колебания в ней содержания глюкозы. Повышение уровня глюкозы ведет к усилению секреции и повышению в крови количества инсулина, вслед за снижением уровня глюкозы понижается содержание инсулина. Предложены две гипотезы, объясняющие регуляцию биосинтеза инсулина - метаболическая и мембранная (рецепторная). Общую цепь событий в В-клетке можно описать следующим образом: глюкоза прикрепляется к рецептору на мембране В-клеток и запускает ряд химических реакций, представленных на рисунке:
2. Стимулируют секрецию инсулина помимо глюкозы белки, аминокислоты, триглицериды, НАДН, НАДФН, а также
3. Гормоны желудочно-кишечного тракта:
- гастрин;
- секретин;
- холецистокинин;
- вазоактивный полипептид;
- желудочный ингибиторный полипептид и др. гормоны ЖКТ оказывают стимулирующее влияние на секрецию инсулина.
Действием последних гормонов объясняется тот факт, что реакция поджелудочной железы и содержание инсулина на пероральную нагрузку глюкозой в 2 и более раз превосходит его реакцию на внутривенную нагрузку, хотя в последнем случае уровень глюкозы в крови возрастает больше.
Врачу важно обратить внимание на двухфазность реакции В-клеток. Начальный, небольшой, но быстрый «всплеск» секреции инсулина начинается в пределах 1 минуты после введения глюкозы и достигает максимума ко 2 минуте. Затем начинается вторая фаза. Она характеризуется постепенным приростом уровня инсулина, спустя 5-10 мин после нагрузки глюкозой. Наличие 2-х фаз объясняется, очевидно, тем, что в В-клетках имеется резерв инсулина. Он выбрасывается в первые минуты (I- фаза), а затем начинается стимулируемый глюкозой синтез инсулина (II-фаза).
4. Определенное влияние на секрецию инсулина оказывают и другие гормоны эндокринных желез. Действие некоторых из них является, очевидно, косвенным, через глюкозу. Так, глюкагон, АКТГ, эстрогены, прогестины, тиреоидные гормоны, глюкокортикоиды, повышая в крови содержание глюкозы, стимулируют секрецию инсулина.
Рецепторы инсулина и механизм транспорта глюкозы
Инсулин, как и другие полипептидные гормоны, связывается со специфическими рецепторами на плазматической мембране органов-мишеней.
Инсулиновый рецептор – это компонент клеточной мембраны, который избирательно распознает и связывает высокоспецефичный инсулин. Число таких рецепторов на мембране клетки колеблется от 50.000 (в адипоцитах) до 250.000 (в гепатоцитах).
В покое инсулином занято
10% рецепторов, т.е. у здоровых лиц имеется большой резерв рецепторов, которым определяется чувствительность клеток к инсулину. Количество рецепторов на мембране не постоянно и зависит от многих причин. Так, например, при ожирении или гиперинсулинемии число инсулиновых рецепторов уменьшается, а при гипоинсулинемии и голодании оно увеличивается. Эффект действия инсулина может также нарушаться вследствие появления антител к рецепторам или изменения их структуры - сродства к инсулину.
Регуляция транспорта глюкозы при участии инсулина описывается следующим образом. Прикрепляясь к специфическому рецептору на наружной стороне мембраны, гормон стимулирует фосфорилирование той части рецептора, которая находится внутри клетки. Это служит сигналом для извлечения из везикул цитоплазмы клеток белка транспортера глюкозы (Glu-T), который направляется к плазматической мембране клетки, встраивается в нее и обеспечивает транспорт глюкозы. При снижении концентрации инсулина Glu-Т возвращается в состав везикул цитоплазмы клеток.
Биологические эффекты действия инсулина
Инсулин – это основной гормон, который контролирует обмен и накопление (+) поступающих в организм энергетических ресурсов - гликогена, липидов, белков. Секреция инсулина после еды облегчает всасывание, утилизацию и их накопление. Снижение в крови содержания инсулина приводит к мобилизации выше перечисленных эндогенных ресурсов. Действие инсулина на обмен веществ осуществляется во всех органах и тканях, но главными органами мишенями являются: печень, скелетные мышцы и жировая ткань, в которых наиболее эффективно с помощью инсулина регулируется обмен углеводов.
Влияние инсулина на транспорт и обмен углеводов в различных тканях.
Транспорт глюкозы в клетки по градиенту концентрации осуществляется с помощью специальных белков, переносчиков глюкозы, которые обозначаются GluT и нумеруются в соответствии с их распределением в тканях:
GluT-1 – в эндотелии кровеносных сосудов гематоэнцефалического барьера и обеспечивает поток глюкозы в мозг;
GluT-2 – в печени, кишечнике и почках, т.е. органах, которые выделяют глюкозу в кровь, а также в В-клетках;
GluT-3 – в нейронах мозга и обеспечивают к ним приток глюкозы;
GluT-4 – переносчик глюкозы в скелетных мышцах и адипоцитах, где синтезируются, соответственно, гликоген и липиды;
GluT-5 в тонком кишечнике.
GluT существует в двух конформациях: одна до связывания глюкозы на внеклеточной стороне мембраны; вторая – когда глюкоза связывается с рецептором, от этого изменяется конформация GluT- и глюкоза оказывается внутри клетки. Важно обратить внимание на тот факт, что это семейство белков, переносчиков глюкозы по градиенту концентрации, отличается от белков, транспортирующих моносахариды пищи из кишечника против концентрационного градиента (симпорт совместно с транспортом натрия).
Работа белков - транспортеров глюкозы в одних тканях контролируется инсулином, особенно GluT-4 в тканях скелетных мышц и адипоцитах. В других тканях транспорт глюкозы не зависит от инсулина. Отсюда возникло понятие об инсулин-зависимых и -независимых тканях:
– ЦНС , надпочечники, гонады поглощают глюкозу из крови без участия инсулина (инсулин-независимые ткани);
– Скелетные мышцы, липоциты, жировая и соединительная ткань, клетки крови – являются абсолютно инсулинзависимыми, где транспорт глюкозы белком GluT-4 контролируется инсулином;
– Печень, почки, миокард – занимают промежуточное положение. Плазматическая мембрана гепатоцита (в отличие от миоцита и липоцита) свободно проницаема для нейтральной глюкозы.
Полагают, что помимо эффекта действия на транспорт глюкозы, инсулин может путем рецепторного эндоцитоза проникать в клетку и даже клеточное ядро, где взаимодействует с геномом. Среди цитоплазматических посредников действия инсулина лучше всего изучен белок IRS-1, который фиксирует на себе ряд инсулинзависимых энзимов (серин-треониновых киназ) и стимулирует или ингибирует через них активность ферментов обмена углеводов, липидов и белков.
Эффект действия инсулина на обмен углеводов проявляется прежде всего в тканях печени, почек, скелетных мышц и жировой ткани. В них инсулин:
(+) повышает активность ключевых ферментов гликолиза (гексокиназы, глюкокиназы, очевидно, за счет повышения в цитоплазме клеток содержания глюкозы и глюкозо-6-фосфата);
(+) увеличивает скорость пентозофосфатного пути окисления глюкозы. Полагают, что этот эффект обусловлен стимуляцией синтеза жирных кислот, где окисляются коферменты ПФП (НАДФН2);
(+) стимулирует синтез гликогена, прежде всего в печени, за счет повышения содержания глюкозы, глюкозо-6-фосфата и активности гликогенсинтетазы;
( - ) инсулин ингибирует активность фосфорилазы (т.е. распад гликогена);
( - ) инсулин тормозит активность ферментов глюконеогенеза и преж-
де всего тех, которые катализируют превращение пирувата в фосфоенолпируват.
Эти эффекты действия инсулина понижают содержание глюкозы в крови. При недостатке инсулина (гипоинсулинемии) вышеописанные метаболические процессы приобретают противоположное направление, и тогда развивается гипергликемия – главный симптом сахарного диабета.
Основным органом, определяющим поглощение или высвобождение глюкозы, является печень. Ее гликогенсинтетаза и фосфорилаза крайне чувствительны к изменению концентрации глюкозы и инсулина в крови. При повышении уровня глюкозы всего на 15-20% уровень инсулина в крови возрастает на 60-100%, что приводит к полному прекращению выхода глюкозы из печени.
Таким образом, можно признать, что в регуляции баланса глюкозы в крови принимают участие, как сама глюкоза, стимулирует образование инсулина, так и инсулин. Эффекты их действия реализуются, прежде всего, в печени и меньше в скелетных мышцах и жировой ткани.
Влияние инсулина на обмен липидов
У человека липогенез (синтез ВЖК) происходит в основном в печени, а не в жировой ткани. Липиды затем переносятся в составе ЛПОНП в жировую ткань, где используются для биосинтеза триглицеридов.
Инсулин:
1. (+) стимулирует синтез ВЖК в печени, путем повышения скорости гликолиза, ЦТК, ПФП, повышения содержания интермедиатов, используемых на пути биосинтеза ВЖК (НАДФН2, а-ГФ, малонил-КоА и др.)
2. (+) повышает скорость этерификации жирных кислот;
3. (+) стимулирует синтез ЛПОНП;
4. (+) активирует на поверхности клеток эндотелия и жировой ткани липопротеинлипазу и облегчает этим поглощение тканями триглицеридов из плазмы крови;
( - ) ингибирует в липоцитах жировой ткани активность триглицеридлипазы и этим ограничивает гидролиз триглицеридов и выход продуктов их распада в кровяное русло.
Антилиполитические действия инсулина проявляются даже при низких концентрациях гормона, которые недостаточны для регуляции обмена углеводов.
Инсулин понижает также уровень кетоновых тел в крови. Это объясняется тем, что инсулин понижает способность печени окислять жирные кислоты и образование из них ацетил-КоА, а затем кетоновых тел. Более того, он ускоряет их окисление.
|
|
|
 Скачать 0.67 Mb.
Скачать 0.67 Mb.
