этик. Учебное пособие для студентов лечебного, педиатрического, стоматологического и фармацевтического факультетов Тверь, 2006 г Лекции Гормоны и гормоноподобные вещества
 Скачать 0.67 Mb. Скачать 0.67 Mb.
|
90%) СД является первичным.Влияние инсулина на обмен аминокислот, белков и нуклеиновых кислотИнсулин увеличивает белковые запасы организма путем: 1. (+) увеличения поглощения тканями аминокислот; 2. (+) стимуляции синтеза белков за счет увеличения скорости образования в клетке ДНК и РНК; 3. ( - ) ингибирования катаболизма белков; 4. ( - ) снижения скорости окисления аминокислот. Влияние инсулина на обмен электролитов и водыИнсулин понижает в сыворотке крови содержание калия. Это объясняется усилением поглощения одновременно и глюкозы и калия печенью и мышечной тканями. И, наоборот, при снижении в крови содержания инсулина, т.е. у больных сахарным диабетом, концентрация К в плазме увеличивается (не поглощается ни глюкоза, ни калий). Однако при терапии инсулином у больных может резко возрастать поглощение К тканями, что опасно для функции миокарда. В связи с этим, при лечении сахарного диабета принято инсулин вводить совместно с калием. Инсулин понижает экскрецию натрия с мочой. Это действие инсулина лежит в основе отеков, которые появляются иногда у больных диабетом после инсулинотерапии. Инактивация и разрушение. Скорость секреции инсулина поджелудочной железой в покое составляет | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Пациент | I | II | III | ||||
| Дата исследования, мес/год | 10/70 | 1/71 | 9/70 | 12/70 | 10/71 | 1/72 | 12/72 |
| Масса тела, кг | 119 | 92 | 177 | 129 | 104 | 91 | 102 |
| Инсулин, мкЕд/мл | 70 | 20 | 58 | 22 | 56 | 19 | 37 |
Из данных, представленных в таблице, видно, как важно контролировать массу тела (ожирение) в проблеме профилактики сахарного диабета.
При ожирении создаются такие потребности в гормоне, которые превышают секреторные возможности В-клеток.
У некоторых больных СД обнаруживается гиперинсулинемия, что свидетельствует о снижении у них чувствительности к инсулину, т.е. наличии инсулинрезистентности. Веским доказательством инсулинрезистентности является снижение эффективности вводимого экзогенного инсулина, когда для предотвращения гипергликемии и кетоацидоза приходится назначать 200 и более мЕД инсулина ежедневно. Это обусловлено:
- уменьшением числа инсулиновых рецепторов на поверхности каждой клетки;
аномалией рецепторов и снижением их сродства к инсулину;
блокадой рецепторов действием антагонистов и антител;
пострецепторные блоки в клетках-мишенях (белка IRS-1)
усилением действия контринсулярных гормонов (глюкагона, глюкокортикоидов, гормона роста и др.)
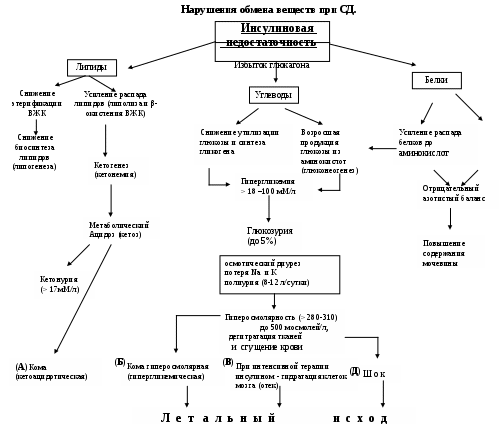
Нарушения обмена веществ при сахарном диабете
и их последствия (схема стр. 43).
В доинсулиновую эру больные с инсулинзависимым сахарным диабетом редко жили больше нескольких лет или даже месяцев. Смертность у них в 40 % случаев наступала от диабетического кетоацидоза (А).
В настоящее время на долю кетоацидоза (А) и гиперосмолярной комы (Б) приходится не более 1 % случаев смерти. Главными причинами смерти при СД стали осложнения.
Осложнения сахарного диабета
Ангиопатии (вследствие усиления гликозилирования белков базальных мембран капилляров)
Поражаются при этом:
почки (диабетическая нефропатия);
сетчатка глаза (диабетическая ретинопатия);
сосуды дистальных отделов нижних конечностей;
сосуды головного мозга (диабетическая нейропатия);
коронарные сосуды. (диабетическая кардиопатия)
Снижение биосинтеза белков
(+)
(-)
(Г)
Глюкагон – это полипептид, содержащий 29 аминокислотных остатков. В отличие от инсулина глюкагон у всех видов животных сохраняет одну и ту же аминокислотную последовательность. Местом биосинтеза глюкагона являются α-клетки островков Лангерганса. Вначале синтезируется проглюкагон, который, концентрируется в секреторных гранулах α-клеток и выделяется путем экзоцитоза. В последние годы доказано существование в крови кишечного глюкагона, который синтезируется в слизистой всего пищеварительного тракта.
Содержание глюкагона (0,07 – 0,15 мкг/л), определяемого иммунореактивным методом, колеблется от 75 до 150 пг/мл. Однако, это, очевидно, лишь небольшая часть биологически активного гормона. Другая, большая, полагают, находится в соединении с альбуминами (большой глюкагон плазмы) и лишена биологической активности. Очевидно, это подвижный резерв гормона.
Основным физиологическим стимулом секреции глюкагона является белковая пища и физическая нагрузка, а также низкий уровень глюкозы в крови.
У здоровых лиц обычно наблюдается бигормональная реакция организма, т.е. происходит повышение одновременно уровня, как глюкагона, так и инсулина, что обеспечивает сохранение концентрации и использования глюкозы на стабильном уровне.
Правильнее, очевидно, говорить, что гомеостаз углеводов управляется не концентрацией названных гормонов, а молярным соотношением инсулин/глюкагон (И/Г). Однако, другие авторы ставят под сомнение такое утверждение.
Механизм действия глюкагона.
Глюкагон – контринсулярный гормон, т.е. он, вызывает увеличение концентрации глюкозы в крови. Органами-мишенями для глюкагона являются печень, миокард, жировая ткань, но не скелетные мышцы. Гипергликемический эффект обеспечивается стимуляцией одновременно гликогенолиза и глюконеогенеза, т.е. усилением распада гликогена и биосинтеза глюкозы, в основном в печени.
Механизм действия глюкагона во многом напоминает действие адреналина. Прикрепляясь к специфическому рецептору, глюкагон активирует:
аденилатциклазу, которая
повышает содержание ц-АМФ; последний в свою очередь,
активирует протеинкиназу, которая
активирует киназу фосфорилазы.
Этот каскад химических реакций вызывает фосфорилирование 2-х энзимов: фосфорилазы гликогена и гликогенсинтетазы. Активность первого фермента возрастает, и ускоряется процесс распада гликогена.
Активность второго фермента гликогенсинтетаза, наоборот, понижается, и синтез гликогена из глюкозы снижается. В результате в кровь из печени усиленно выделяется глюкоза. В отличие от адреналина, глюкагон тормозит распад глюкозы до молочной кислоты, способствуя тем самым развитию гипергликемии.
Гипергликемический эффект глюкагона обусловлен не только усилением распада гликогена, но и возрастанием в печени скорости глюконеогенеза из аминокислот. Эффект этот обусловлен усилением синтеза энзимов этого пути и, прежде всего ключевого фермента этого процесса – фосфоенолпируваткарбоксикиназы.
Глюкагон принимает участие в регуляции скорости кетогенеза. Он стимулирует, в отличие от инсулина, кетогенез, т.е. синтез кетоновых тел.
Выполнив функции, глюкагон разрушается (гидролизуется до аминокислот), в основном, в почках.
ГОРМОНЫ ЩИТОВИДНОЙ ЖЕЛЕЗЫ
Щитовидная железа вырабатывает 2 основных йодсодержащих гормона Т3 – трийодтиронин и Т4 – тетрайодтиронин (тироксин), а также в особых С-клетках – кальцитонин.
Биосинтез тиреоидных гормонов
Главным структурным элемпонентом щитовидной железы является фолликул. Он представляет собой замкнутый пузырек, стенки которого образованы однослойным эпителием.
Клетки эпителия продуцируют в просвет этого мешочка сложный белок, который называют тиреоглобулином. Он состоит примерно из 5000 остатков аминокислот, среди них – 115 остатков тирозина! 8-10 % углеводов и 0,2-1,0 % иодида (J-). Причем, около 70% иодида в этом белке находится в составе неактивных предшественников – моно- и дийодтирозинов (МИТ и ДИТ) и 30% J+ присутствует в составе Т3 и Т4 коллоидного содержимого фолликула. Если йод поступает в организм в достаточном количестве – отношение Т4/Т3 составляет 7:1. При недостаточности йода это соотношение, как и ДИТ/МИТ понижается.
Щ
NH2
|
C=S
|
NH2
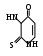 итовидная железа обладает уникальной способностью – концентрировать J- против высокого электрохимического градиента. Молочная железа, плацента и слюнные железы тоже способны концентрировать J-. Это энергозависимый процесс. Активность J--"насоса" можно ингибировать соединениями типа:
итовидная железа обладает уникальной способностью – концентрировать J- против высокого электрохимического градиента. Молочная железа, плацента и слюнные железы тоже способны концентрировать J-. Это энергозависимый процесс. Активность J--"насоса" можно ингибировать соединениями типа: - тиомочевины, - тиоурацила, пропилтиоурацила, метимазола.
Отношение количества йода в щитовидной железе к количеству йода в сыворотке крови отражает активность этого «насоса». У людей, потребляющих с пищей нормальное количество йода (150 – 200 мкг), это отношение составляет 25:1.
Щитовидная железа обладает еще одной уникальной способностью – с помощью тиреопероксидазы, Н2О2, окислять йод до состояния с высокой валентностью, что необходимо для органификации йода и биосинтеза гормонов. Если йод окислился, он реагирует с остатком тирозина в составе тиреоглобулина с образованием йодтиреоглобулина. Йодируется вначале 3, а затем 5 положение тирозина. После йодирования тиреоглобулина йод уже не может покинуть щитовидную железу.
После стимуляции ЩЖ тиреотропином уже через несколько минут усиливается протеолиз кислыми протеазами и пептидазами йодтиреоглобулина на аминокислоты, включая МИТ и ДИТ. Ежедневная секреция органифицированного гормонального йода щитовидной железой составляет ≈ 50 мкг. С учетом, что йод захватывается в желудочно-кишечном тракте с эффективностью в 25-30 % - суточная потребность в йоде колеблется в пределах 150-200 мкг.
Конденсация 2-х молекул ДИТ или МИТ + ДИТ может происходить, очевидно, как в составе йодтиреоглобулина, так и после их освобождения из этого сложного белка с образованием Т3 и Т4.
Выделяющийся из МИТ и ДИТ йодид I-, очевидно, может использоваться также для йодирования тиронинов с образованием Т3 и Т4.
Реакции конденсации и образования Т3 и Т4 подавляются теми же агентами (тиомочевина и др.), что и реакции транспорта и окисления йода (тиомочевина, тиоуроцил).
Образовавшиеся гормоны находятся в составе коллоида фолликул ЩЖ и секретируются в кровь по мере необходимости.
Транспорт и метаболизм гормонов ЩЖ
Приблизительно ½ или ⅓ Т3 и Т4 находятся вне ЩЖ, причем большая часть циркулирует в крови в связанной форме с 2-мя белками:
тироксин-связывающим глобулином (ТСГ) или ТСГ образуется в печени.
тироксин-связывающим проальбумином (ТСПА).
При нормальных условиях почти все молекулы Т3 и Т4 связаны с ТСГ.
Между тем, биологическая активность обуславливается несвязанной, т.е. свободной фракцией Т3 и Т4, концентрация которых в крови невелика.
Содержание Т3 и Т4 в плазме крови:
| Общее содержание мг% | Свободный гормон | Период полураспада в днях | ||
| в % от общего содержания | в нг% | в молях | ||
| Т 4 8,0 | 0,03 | 2,24 | 3·10-11 | 6,5 |
| Т3 0,15 | 0,3 | 0,4 | 0,6·10-11 | 1,5 |
Следовательно, ТСГ (тироксин-связывающий глобулин) выступает в качестве еще одного способа регуляции содержания Т3 и Т4. Это обстоятельство важно учитывать при диагностическом тестировании функции ЩЖ, поскольку большинство методов определения Т3 и Т4 позволяют измерять общее количество гормонов в плазме, а не их свободную фракцию.
Полагают, что метаболически наиболее активной формой гормона является Т3. Внетиреоидное дейодирование приводит к превращению ≈ 80% циркулирующих в крови Т4 в Т3 (трийодтиронин 3, 5, 3). Его сродство к рецепторам клеток-мишеней в 10 раз выше, чем у Т4. Другая конформация Т3 – 3, 3, 5 называется реверсивный трийодтиронин. Он представляет собой слабый агонист гормона. Важно обратить внимание еще на одно обстоятельство – время полужизни Т4 в 4-5 раз больше, чем у Т3. Пропилтиоурацил и пропанолон ингибируют превращение Т4 в Т3.
Регуляция синтеза и высвобождение гормонов ЩЖ
Главными компонентами, определяющими регуляцию синтеза и высвобождения гормонов ЩЖ, являются тиролиберин, тиреотропин, ТСГ (тироксин-связывающий глобулин), Т4 и Т3, в свою очередь, при избытке тормозят собственный биосинтез по принципу обратной связи, т.е. они ингибируют образование тиреотропина в гипофизе ( - ) и тиролиберина в гипоталамусе ( - ).
г
 ипоталамус
ипоталамус(тиролиберин)
гипофиз
(тиреотропин)
ЩЖ
(Т3 и Т4)
Снижение содержания Т3 и Т4 в крови служит сигналом повышения образования тиролиберина и тиреотропина, что приводит к усилению биосинтеза Т3 и Т4.
Важно отметить еще одно обстоятельство. ЩЖ содержит запас ранее образованного гормона, достаточного для его поставки в кровь на протяжении нескольких недель.
Инактивация гормонов ЩЖ
Выполнив функцию (см. ниже), Т3 и Т4 инактивируются путем дейодирования, дезаминирования и декарбоксилирования.
Далее в печени эти продукты инактивации соединяются с глюкуроновой или серной кислотой, что приводит к образованию более гидрофильных молекул, которые выделяются с желчью, всасываются в кишечнике, и через почки выделяются с мочой.
Механизм действия тиреоидных гормонов
Гормоны ЩЖ (липофильные) проникают в цитоплазму и связываются с цитоплазматическими рецепторами клеток-мишеней. Сродство Т3 к ним примерно в 10 раз превышает сродство Т4. Однако, активностью обладают оба гормона. Они стимулируют экспрессию генов, повышают скорость транскрипции и синтеза белков-энзимов.
- Главная метаболическая функция гормонов ЩЖ состоит в повышении поглощения кислорода, т.е. в усилении основного обмена. Эффект наблюдается во всех органах, кроме мозга, ретикуло-эндотелиальной системы и гонад. Особое внимание привлекают к себе митохондрии, в которых Т4 вызывает морфологические изменения, что разобщает окислительное фосфорилирование. Однако эти эффекты требуют наличия больших количеств гормона и почти наверняка не имеют места в физиологических условиях.
- Согласно гипотезе Эдельмана большая часть энергии, утилизируемой клеткой, используется для работы Na\K-АТФ-азного насоса. Гормоны ЩЖ Повышают эффективность этого насоса.
- Гормоны ЩЖ, подобно стероидам, индуцируют синтез белков путем активации механизма генной транскрипции. По-видимому, по этой причине при введении Т3 и Т4 усиливается синтез белка и формируется положительный азотистый баланс. Однако, очень высокие концентрации Т3 подавляют синтез белка и обуславливают отрицательный азотистый баланс.
- Гормоны ЩЖ известны также как важные модуляторы процессов развития. Это особенно ярко проявляется в их действии на метаморфоз амфибий. Тиреоидные гормоны необходимы для превращения головастика в лягушку. Доказано, что гормоны ЩЖ необходимы также для нормального умственного развития человека. Гипотиреоз у плодов или новорожденных приводит к кретинизму, который характеризуется множественными врожденными нарушениями и тяжелой необратимой задержкой умственного развития.
Патология функции ЩЖ
Зоб
Зобом называют любое увеличение ЩЖ.
Простой зоб является результатом «попытки» организма компенсировать сниженное образование тиреоидных гормонов Т3 и Т4 - гипотиреоз. Поэтому все случаи простого зоба сопровождаются повышением уровня тиреотропина.
Причинами таких нарушений могут быть недостаток иодида в пище, недостаточность ауторегуляторных механизмов и другие дефекты биосинтеза гормона:
нарушение йодирования тирозина и тиронина;
нарушение конденсирования;
высокая активность дейодиназы;
недостаточность ТСГ;
образование аномальных йодированных белков;
нарушение транспорта гормона.
Недостаточность любых перечисленных выше функций может вызвать снижения содержания Т3 и Т4 - простой зоб у взрослых людей.
Простой зоб лечат экзогенными тиреоидными гормонами.
При специфических формах зоба рекомендуют увеличение или наоборот в зависимости от патогенеза, ограничение потребления йода.
Гипотиреоз
Наблюдается при дефиците Т3 и Т4. Обычно это связано с недостаточной функцией ЩЖ, но может также быть результатом заболевания гипофиза или гипоталамуса.
При гипотиреозе снижается основной обмен, а также скорость других вышеперечисленных процессов, зависящих от тиреоидных гормонов.
У взрослых гипотитеоз характеризуется:
низкой частотой сердечных сокращений;
диастолической гипертензией;
вялостью, сонливостью;
запорами;
чувствительностью к холоду;
сухостью кожи и волос;
бледностью.
У детей:
О кретинизме (выраженным умственном отставании в развитии) при дефиците Т3 и Т4 говорилось выше. У детей старшего возраста при кретинизме наблюдается отставание в росте без задержки умственного развития. Различные формы гипотиреоза лечат заместительным введением тиреоидных гормонов.
Гипертиреоз
или тиреотоксикоз, обусловлен избыточным образованием тиреоидных гормонов Т3 и Т4. Существуют множество причин и форм этой патологии.
Болезнь Грейвса является результатом образования тиреоидстимулирующего иммуноглобулина (Ig G), активирующего рецептор тиреотропина. Это приводит к диффузному разрастанию ЩЖ и избыточной неконтролируемой продукции Т3 и Т4.
Патология проявляется:
учащением сердцебиения;
увеличением пульсового давления;
нервозностью;
бессонницей;
похуданием;
слабостью, потливостью;
повышенной чувствительностью к теплу;
гиперемией и влажностью кожи.
Лечение сводится к подавлению биосинтеза гормонов, что достигается применением антитиреоидных средств (тиомочевина, тиоуроацил и др.), блокированием функции ЩЖ *J131 или комбинацией этих двух приемов. Иногда производят хирургическое лечение.
Гормоны, регулирующие метаболизм Са и Р.
Ионы кальция регулируют ряд важнейших физиологических и биохимических функций:
– нейромышечное возбуждение;
– свертывание крови;
– сокращение скелетных мышц;
– контролируют процессы секреции;
– обеспечивают поддержание целостности мембран и транспорт веществ через мембраны;
– регулируют многие ферментативные реакции;
– способствуют высвобождению гормонов и нейромедиаторов;
– обеспечивают внутриклеточные действия ряда гормонов (мессенджеры);
– обеспечивают минерализацию костей
– и это далеко не все функции кальция.
В связи с этим аномальные концентрации Са2+ в организме могут служить причиной множества патологий и даже гибели.
Общее содержание Са в организме человека составляет ≈1кг: – 99% его сосредоточено в костях, где он совместно с фосфатом образует кристаллы апатитов – неорганической части скелета. Большая часть Са кости не может свободно обмениваться с кальцием внеклеточной жидкости (ВЖ), т.к. в составе кристаллов апатитов он плохо растворим.
Около 1% Са организма составляет легкообменивающийся пул, и ≈1% от общего количества Са находится в периостальном пространстве (надкостнице). Вместе эти два последних источника составляют мобильный пул Са2+.
В плазме крови содержится 2,2-2,8 мМ/л (9-11 мг%) Са. Присутствует он в ней в 3 формах:
в комплексе с органическими и неорганическими кислотами (≈6%);
в связанной с белками форме (≈45%);
в ионизированном виде (≈45%).
Ионизированный Са, концентрация которого у большинства млекопитающих поддерживается в пределах 1,1 –1,3 ммоль/л – это биологически активная фракция кальция.
Организм животных обладает очень малой толерантностью к отклонениям уровня Са от указанных границ нормы. В случае снижения уровня Са у животного нарастают явления повышенной возбудимости вплоть до возникновения тетанических судорог и летального исхода. Заметное повышение Са в плазме может привести к смерти из-за паралича мышц и комы.
Ион Са и парный ему ион фосфата присутствуют в плазме крови в концентрациях близких к пределу растворимости их соли.
Связывание Са белками предупреждает возможность образования осадка и эктопической кальцификации. В связи с этим с изменением уровня плазменных белков (прежде всего альбумина) в плазме совершаются изменения в содержании Са. При снижении, например альбумина, на каждый грамм в плазме на 0,8 мг% снижается уровень Са, и, наоборот, при повышении уровня белков в плазме повышается также и содержание Са. Связывание Са с белками зависит от рН среды. Ацидоз способствует переходу Са в ионизированную форму, а алкалоз повышает связывание Са с белками, и при этом понижается содержание ионизированного Са.
У современных многоклеточных организмов Na+ и Са2+ являются основными ионами внеклеточной среды, а К+ и Mg2+ – внутриклеточными ионами. В результате потребовался механизм ограничения концентраций Na+ и Са2+ в цитоплазме клеток при условии сохранения К+ и Mg2+.Таким механизмом стали связанные с мембраной Na- и Са-насосы (белки), способные поддерживать высокий (1000-кратный в случае с Са) градиент концентрации ионов между цитозолем и внеклеточной жидкостью.
Переход от водной среды, относительно богатой ионом Са2+, к наземной, где этот элемент в пище относительно дефицитен, был сопряжен с развитием сложного механизма гомеостаза этого элемента, обеспечивающего всасывание Са2+ из продуктов питания и предотвращения его потери, путем реабсорбции из первичной мочи и экстракции из костной ткани.
В этот механизм контроля содержания кальция включены 3 гормона:
паратиреоидный (ПТГ) – паращитовидной железы;
кальцитонин (КТ) – С-клетки щитовидной железы.
кальцитриол (1,25(ОН)2-Д3) – печень, почки;
Эти гормоны действуют на три органа: кости, почки и кишечник.
Паратиреоидный гормон (ПТГ)
Это одноцепочечний пептид (84 аминокислотных остатка). Область 1 – 34 аминокислот ответственна за гормональную активность, а 25 – 34 – за связывание гормона с рецепторами.
Синтезируется гормон в виде предшественника проПТГ, содержащего дополнительно гексопептид. Предшественником проПТГ оказался препроПТГ, у которого цепь еще длиннее. После синтеза, ПТГ поступает в секреторные пузырьки (везикулы), и где этот гормон может накапливаться или немедленно секретироваться, оказывая физиологическое действие.
Гормон:
1) повышает скорость растворения кости (вымывание как органических, так и неорганических компонентов, что обеспечивает переход кальция во ВЖ;
2) снижает почечный клиренс, т.е. экскрецию Са с мочой, способствуя ресорбции тем самым повышению концентрации этого катиона во ВЖ;
3) посредством стимуляции образования кальцитриола увеличивает эффективность всасывания Са в кишечнике.
Быстрее всего гормон оказывает действие на почки, но значительный сильный эффект проявляется за счет воздействия на кость. Этим предотвращается развитие гипокальциемии при недостаточности Са в пище.
Суммарный эффект ПТГ на кость – деструкция кости, которая сопровождается высвобождением Са, Р, а также элементов органического матрикса, в том числе продуктов распада коллагена. Клетками, ответственными за этот процесс, могут быть: -остеокласты. Доказано, что они разрушают кость при хронической стимуляции этих клеток ПТГ; - остеоциты также способны резорбировать кость.
Возможно, что ПТГ стимулирует дифференцировку клеток - предшественников и их превращение в клетки, резорбирующие кость. Однако, мы, очевидно, должны признать, что при концентрациях, соответствующих физиологическим, ПТГ оказывает анаболический эффект, так как разрушая он ответственен за перестройку и обновление костной ткани. При этих концентрациях гормона наблюдается увеличение числа остеобластов, возрастание активности Щ. фосфатазы, свидетельствующие о формировании новой костной ткани. ПТГ повышает включение серы в хрящ. В действии ПТГ на кость пермиссивную роль может играть кальцитриол.
Влияние ПТГ на почки – опосредуется через его влияние на транспорт ионов кальция через мембраны почечных канальцев. Доказано, что до 90% Са, содержащегося в клубочковом фильтрате, подвергается реабсорбции. ПТГ увеличивает эту величину до 98% и более. Реабсорбция фосфата в норме составляет 75-90% в зависимости от диеты и некотрых др. факторов. ПТГ – тормозит ресорбцию фосфата.
Инактивация (протеолиз)гормона протекает в купферовских клетках печени.
Патофизиология . Недостаток ПТГ называют гипопаратиреозом. В сыворотке крови понижается содержание Са ионизированного и повышается уровень фосфата. Это повышает нейромышечную возбудимость. Тяжелая,острая гипокальциемия ведет к тетаническому параличу дыхательных мышц, ларингоспазм, сильным судорогам и смерти. Причиной гипопаратиреоза обычно служит случайное удаление или повреждение паратиреоидных желез при операциях на шее, но иногда болезнь является следствием аутоиммунной деструкции паратиреоидных желез.
Псевдогипопаратиреоз наблюдается, когда железой продуцируется биологически активный гормон в достаточном количестве, но органы-мишени к нему резистентны. В результате возникают те же биохимические и клинические сдвиги, что и при гипопаратиреозе. У молодых пациентов задерживаются рост и умственное развитие.
Гиперпаратиреоз возникает вследствие аденомы паратиреоидных желез, но может быть также следствием гиперплазии их клеток, либо эктопической продукции ПТГ злокачественной опухолью.
Биохимические проявления гиперпаратиреоза – повышение уровня ионизированного кальция и снижение фосфата в сыворотке крови. В запущенных случаях гиперпаратиреоза можно наблюдать выраженную резорбцию костей скелета и различные повреждения почек (камни), частое инфицирование мочевых путей и снижение функции почек.
Вторичный гиперпаратиреоз можно наблюдать у больных с почечной недостаточностью. Полагают. что развитие патологии обусловлено снижением синтеза 1,25 (ОН)2-Д3 в измененной паренхиме почек, и, как следствие, нарушением всасывания кальция в кишечнике. Это вызывает компенсаторную реакцию организма – усиление образования и секрецию в кровь ПТГ для поддержания нормального уровня Са во ВЖ.
Кальцитонин (КТ).
Это пептид (32 аминокислоты).
Образуется и секретируется он С-клетками щитовидной (реже паращитовидной) железы. Существует большая межвидовая вариабельность в аминокислотной последовательности КТ. Однако, КТ других животных активен при введении человеку, особенно КТ лососевых.
Регуляция секреции. Уровни секреции КТ и ПТГ связаны обратной зависимостью и регулируются содержанием ионизированного кальция (Mg) во ВЖ. Секреция КТ возрастает пропорционально увеличению концентрации кальция в крови (при изменении последнего от 9,5 до 15 мг%).
Механизм действия. До сих пор не изучен. В тест-системах первичной мишенью КТ служит кость, где этот гормон тормозит резорбцию матрикса и тем самым снижает высвобождение Са и фосфата. Более того, он способствует входу фосфата в клетки кости и периостальную жидкость, снижая этим выход кальция из костей в плазму крови. Вход фосфата стимулирует вход кальция. Такое действие КТ, наряду с его способностью тормозить опосредованную остеобластами резорбцию костей, позволяет объяснить эффективность применения данного гормона при гиперкальциемии у больных раком, локализованным в костной ткани.
Клиническое проявление недостаточности КТ не выявлено. Избыточность КТ наблюдается при тиреокарциноме. Уровень КТ может у таких больных в 1000 раз превышать норму, однако это не сопровождается гипокальциемией.
Кальцитриол.
Изучение этого гормона связано с давно известным заболеванием – рахитом.
Рахит – заболевание детей, характеризующееся нарушением минерализации скелета и деформацией костей, был широко распространен в прошлых и в начале ХХ веков. Было обнаружено, что рахит можно предотвратить добавлением в пищу жира печени трески. Фактор предупреждения рахита обозначили как жирорастворимый витамин Д. Было также обнаружено, что облучение организма УФ предупреждает развитие заболевания.
В последующем у взрослых было выявлено заболевание эквивалентное рахиту, его назвали остеомаляцией. Вызванное нарушением минерализации костей, оно также поддавалось лечению витамином Д. И совсем недавно было доказано, что эффектом действия обладает не сам витамин Д, а его производное - кальцитриол.
Кальцитриол – во всех отношениях гормон. Он образуется в сложной последовательности химических реакций, протекающих к тому же в разных тканях. Пища содержит небольшие количества витамина Д. Большая часть его образуется в эпидермисе кожи из 7-дегидрохолестерола в ходе неферментативной, зависимой от УФ света, (реакция фотолиза). Активность процесса находится в прямой зависимости от интенсивности облучения и в обратной - от степени пигментации кожи. С возрастом содержание 7-дегидрохолестерола в эпидермисе снижается, что служит причиной отрицательного баланса Са у стариков.
Специфический транспортный белок связывает витамин Д и переносит его от кожи или кишечника в печень, где он подвергается 25-гидроксилированию. Продукт реакции поступает в плазму крови, при участии особого белка переносится в почки, где он гидроксилируется уже в С-1 положении. 1,25(ОН)2-Д3 – самый активный из природных метаболитов витамина Д, каторый стали называть гормоном.
Регуляция метаболизма и синтеза КТ.
Подобно другим гормонам, кальцитриол является объектом точно сбалансированной (жесткой) регуляции его биосинтеза по механизму обратной связи. У интактных животных низкое содержание Са в пище и гипокальциемия вызывают усиление биосинтеза кальцитриола. В механизме этого эффекта участвует ПТГ, который стимулирует образование кальцитриола.
Механизм действия кальцитриола.
Кальцитриол функционирует подобно другим липофильным стероидным гормонам. На поверхности клеток-мишеней (кишечных ворсинок) кальцитриол соединяется со специальными рецепторами. Далее он проникает в клетку и соединяется в ядре с хроматином, стимулирует транскрипцию генов и образование м-РНК, и затем усиливается биосинтез кальцийсвязывающих белков (КСБ), которые стимулируют всасывание Са.
Роль кальцитриола в гомеостазе.
Основная биологическая роль кальцитриола - это стимуляция всасывания кальция и фосфата в кишечнике. Кальцитриол – единственный гормон, способствующий транспорту Са против концентрационного градиента, существующего на мембране клеток кишечника. Этот механизм, очевидно, не зависит от содержания Са в пище. За счет усиления под влиянием КТ всасывания Са и Р в организме поддерживаются такие концентрации названных элементов, которые необходимы для образования кристаллов гидроксиапатитов, откладывающихся в коллагеновых фибриллах кости.
При недостаточности витамина Д замедляется формирование новых костей и нарушается обновление костной ткани. В регуляции этих процессов участвует также ПТГ, воздействующий непосредственно на костные клетки, а также образование кальцитриола.
Патофизиология.
Рахит – заболевание детского возраста, которое характеризуется низким уровнем Са и Р в плазме крови и нарушением минерализации костей, ведущим к деформации скелета. Чаще всего рахит является следствием недостатка витамина Д. Различают также 2 типа наследственного вит. Д-зависимого рахита.
Тип-I обусловлен нарушением превращения 25-ОН-Д3 в кальцитриол – в почках.
Тип-II является следствием отсутствия рецепторов на кальцитриол.
У взрослых недостаток витамина Д вызывает остеомаляцию. Это является результатом снижения всасывания Са и Р в кишечнике и уменьшения уровня этих ионов во внеклеточной жидкости. Вследствие этого нарушается минерализация остеоида и формирование кости, что обуславливает формирование их структурной слабости.
Остеомаляция может наблюдаться также, когда значительно повреждена патологическим процессом или утрачена функция паренхимы почек. Образование кальцитриола в почках снижается и, соответственно, уменьшается всасывание Са. Формирующаяся гипокальциемия вызывает компенсаторное увеличение секреции ПТГ, который усиливает резорбцию костной ткани, чтобы повысить содержание Са во внеклеточной жидкости и усугубляет этим патологический процесс - остеопороз.
Лечение витамином Д на ранних стадиях позволяет ослабить проявление болезни.
Простагландины
Простагландины образуются или активируются в ответ на раздражение во всех клетках тканей и органов организма и отличаются высокой активностью.
Впервые упоминание об этих веществах было опубликовано в 1930 г. американскими гинекологами Kirzrok и Lieb, которые отметили специфическое влияние спермы на матку. В 1934 – 35 гг. Yoldbat в Америке и Van Culer в Швеции выделил из спермы человека и барана кислотоустойчивые вещества, которые назвали простагландинами (простата). Строение последних было выяснено только в 1962 г.
О
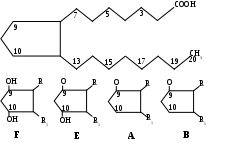 казалось, что в их основе лежит простаноевая кислота, которая образуется из арахидоновой.
казалось, что в их основе лежит простаноевая кислота, которая образуется из арахидоновой.
Арахидоновая кислота является основным предшественником простагландинов, только после того, как под действием фосфолипазы А2 отщепляется от фосфолипидов мембран необратимо поврежденных клеток. Эта самая медленная реакция пути биосинтеза ПГ, поэтому она является скоростьлимитирующей реакцией. Кортикостероиды ингибируют этот фермент, поэтому они обладают противовоспалительным действием.
Аспирин и индометацин также обладают противовоспалительным действием, т.к. ингибируют простагландинсинтетазу и снижают концентрацию простагландинов в очаге воспаления.
Типы простагландинов зависят от:
типа и числа О-заместителей,
р

асположения двойной связи в пятичленном кольце.
Роль простагландинов
Образуются в каждой клетке в ответ на любое раздражение.
Стимулируют (ингибируют) синтез ц-АМФ, влияют на гипофиз, кору надпочечников, щитовидную железу, яичники, головной мозг.
Медиаторы воспаления: увеличивают содержание гистамина, повышают проницаемость сосудистой стенки, кожи и слизистых оболочек.
Повышение (понижение) артериального давления.
Усиление (торможение) секреции желудочного сока.
Медиаторы аллергических реакций.
Расслабление (сокращение) гладких мышц бронхов, матки (родостимулирующее действие).
Пирогенное действие
С
ТО
ужение кровеносных сосудов и повышение артериального давления.
А
ПЦ
ЛТ
грегация (склеивание) тромбоцитов.
Расширение кровеносных сосудов и понижение артериального давления.
Увеличение объема мочи и выведения натрия (препятствие развитию гипертонии).
Скопление лейкоцитов в месте воспаления, прилипание к стенке сосуда (ферменты лейкоцитов лизируют бактерии).
Кинины
Кининами, или кининовыми гормонами, были названы вещества полипептидной природы, обладающие высокой биологической активностью.
Они не производятся специализированными клетками, а возникают из неактивных предшественников, находящихся в плазме крови или в тканях.
Основными кининами являются брадикинин и лизилбрадикини (каллидин):
Arg - Pro - Pro - Gly - Phe - Ser - Pro - Phe - Arg
брадикинин
Lys - Arg - Pro - Pro - Gly - Phe - Ser - Pro - Phe - Arg
лизилбрадикинин (каллидин)
Брадикинин образуется из кининогена, присутствующего в α2-глобулиновой фракции сыворотки крови. Калликреины, катализирующие его расщепление, толже образуются путем частичного протеолиза из прекалликреина. Это происходит в крови под действием полипептидных фрагментов фактора Хагемана, которые образуются под действием специфических протеаз или плазмина, а активный фактор Хагемана образуется из неактивного предшественника при контакте с межклеточным веществом (коллагеном), базальной мембраной сосудов или эндотоксинами.
Калликреин-кининовая система

Период полураспада брадикинина в большом круге кровообращения равен 17-24 сек. Это обусловлено наличием в крови высокоактивных кининаз, осуществляющих физиологический контроль уровня кининов. Они гидролизуют отдельные пептидные связи в молекуле брадикинина и тем самым переводят его в неактивные продукты.
Между выработкой калликреина и активацией фактора ХП А (Хагемана) существует обратная положительная связь. Калликреин не только активирует образование брадикинина, но и является участником запуска каскадных реакций образования тромба.
Активация кининовой системы или нарушение утилизации брадикинина из кровяного русла под влиянием кининаз является одной из патогенетических причин развития воспалительных реакций, что проявляется в увеличении проницаемости капилляров и возникновение отека, а также в появлении боли из-за прямого действия брадикинина на болевые рецепторы.
Количество брадикинина в крови регулируется как с помощью фермента кининазы (карбоксипептидазы крови), так и ингибиторов ферментов. Эту функцию может выполнять α2-макроглобулин, являясь своеобразной ловушкой (капканом) для молекул брадикинина. В медицинской практике используются ингибиторы калликреина: контрикал (трасилол) или гордокс (в противошоковой терапии).
Пчелиный или змеиный яд содержат калликреиноподобные пептидазы. Факт появления боли и отека в месте укуса - одно из возможных последствий активации кининовой системы.
