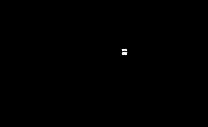качество и безопасность продуктов питания. КАЧЕСТВО И БЕЗОПАСНОСТЬ ПРОДУКТОВ ПИТАНИЯ (1). Учебное пособие Минск 2008 Авторы З. В. Ловкис, докт техн наук, профессор
 Скачать 7.39 Mb. Скачать 7.39 Mb.
|
Ботулизм. Clostridium botulinum продуцирует токсины, представляющие особую опасность для человека (приложение). Эти микроорганизмы являются облигатными анаэробами с термостабильными спорами. Различают A, B, C, D, E, F, и G виды ботулотоксинов, причем наибольшей токсичностью обладают токсины A и E. Ботулотоксины имеют белковую природу, молекулярная масса порядка 150 кДа.Они поражают рыбные, мясные продукты, фруктовые, овощные и грибные консервы при недостаточной тепловой обработке и в условиях резкого снижения содержания кислорода (герметично закупоренные консервы). Кроме того, ботулотоксины характеризуются высокой устойчивостью к действию протеолитических ферментов (пепсин, трипсин), кислот (в частности, к кислому содержимому желудка), низких температур, но инактивируются под влиянием щелочей и высоких температур (80С – 30 мин; 100С – 15 мин). Высокая концентрация хлорида натрия не инактивирует ботулинический токсин. Если в пищевом продукте уже накопился токсин, то консервирование продукта – соление, замораживание, маринование не инактивируют его. Обычно при развитии микробов органолептические свойства продукта заметно не изменяются, иногда лишь ощущается слабый запах прогорклого жира, значительно реже продукт размягчается и изменяется его цвет. В консервах в результате развития микробов и гидролиза белковых и других веществ могут накапливаться газы, вызывающие стойкое вздутие донышка банки (бомбаж). Ботулизм встречается довольно часто и летальность достигает 7–9%. К токсинообразующим микроорганизмам, вызывающим пищевые отравления у человека, относятся также Clostridium perfringens – спорообразующие анаэробные грамположительные бактерии, которые продуцируют большое число энтеротоксинов. Споры обычно сохраняются в продуктах и блюдах после их термической обработки (споры термоустойчивых штаммов типа A и F выдерживают кипячение от 1 до 6 ч). При длительном хранении готовой пищи в тепле споры могут прорасти и в течение короткого времени накопиться в огромном количестве. В связи с этим продукты из мяса, молока, рыбы и др., даже хорошо термически обработанные, подлежат быстрой реализации. Эшерихиоз или кишечная колиинфеция. Эшерихиоз или кишечная колиинфеция – острая кишечная инфекция, вызываемая патогенными (диареегенными) штаммами кишечных палочек, протекающая с симптомами общей интоксикации и поражения желудочно-кишечного тракта (приложение). Возбудители принадлежат к виду Escherichia coli, роду Escherichia, семейству Enterobacteriaceae, представляют собой грамотрицательные подвижные и неподвижные палочки. Названы они в честь открывшего их в 1885 г. немецкого ученого Т.Эшериха E.coli является обычным обитателем кишечника многих млекопитающихся, поэтому ее часто называют кишечной палочкой. В организме человека E.coli выполняет полезную роль, подавляя рост вредных бактерий и синтезируя некоторые витамины. Однако, существуют разновидности E.coli, способные вызывать у человека острые кишечные заболевания. В настоящее время выделяют более 150 типов патогенных (так называемых «энтеровирулентных») палочек E.coli, объединенных в четыре класса: энтеропатогенные (ЭПЭК), энтеротоксикогенные (ЭТЭК), энтероинвазивные (ЭИЭК), энтерогеморрагические (ЭГЭК). Патогенные штаммы E.coli (кишечная палочка) являются продуцентами термостабильных токсинов полипептидной природы с молекулярной массой от 4 до 10 кДа и способны вызывать как острые токсикоинфекции, так и являться причиной хронической почечной недостаточности. Бактерии группы кишечной палочки не устойчивы к высокой температуре: при 60ºС гибель их наступает через 15 мин, при 100ºС – мгновенно. Сохраняемость кишечной палочки при низких температурах и в различных субстратах внешней среды изучена недостаточно. Бактерии хорошо растут на обычных питательных средах, активно ферментируют углеводы. Устойчивы во внешней среде, месяцами сохраняются в почве, воде, испражнениях. По некоторым данным в воде и почве кишечная палочка может сохраняться несколько месяцев. Хорошо переносят высушивание. Обладают способностью к размножению в пищевых продуктах, особенно в молоке. Быстро погибают при кипячении и воздействии дезинфицирующих средств. Обычные дезинфицирующие вещества (фенол, формалин, сулема, едкий натр, креолин, хлорная известь и др.) в общепринятых разведениях быстро убивают кишечную палочку. Из путей передачи инфекции ведущее место занимает пищевой, особенно молоко и молочные продукты, мясные продукты. Протеи. Бактерии рода Proteus широко распространены в природе и известны как гнилостные бактерии. Протейные бактерии подвижные, бесспоровые, факультативные анаэробы. Оптимальная температура развития их от 20 до 37С, однако размножение может происходить и при температуре от 6 до 43С. Эти микроорганизмы могут размножаться при pH 3,5–12; выдерживают нагревание до 65С в течение 30 мин; устойчивы к высыханию и высокой концентрации хлорида натрия. Органолептические свойства продукта при массивном обсеменении бактериями рода Proteus не изменяются. Среди многих представителей протейной группы только отдельные виды способны вызывать пищевые токсикоинфекции. Протейная палочка длительное время сохраняет жизнеспособность во внешней среде, в том числе и в пищевых продуктах. Пищевыетоксикоинфекции, вызванные микробами группы протея, возникают преимущественно при употреблении рыбных и мясных блюд, особенно измельченных. Протеи вызывают заболевание у людей только в тех случаях, когда они выходят за пределы своей экологической ниши (пищеварительный тракт). Их нередко обнаруживают при хронических инфекциях мочевыводящих путей, а также при бактериемиях, пневмониях и очаговых поражениях у ослабленных больных или у больных. Гигиенические нормативы по микробиологическим показателям продуктов питания включают контроль за 4 группами микроорганизмов: санитарно-показательные, к которым относятся: количество мезофильных аэробных и факультативно-анаэробных микроорганизмов и бактерий группы кишечных палочек (колиформы); условно-патогенные микроорганизмы, к которым относятся E.coli, S.aureus, бактерии рода Proteus, B.cereus и сульфитредуцирующие клостридии; патогенные микроорганизмы, в том числе сальмонеллы; микроорганизмы порчи – в основном это дрожжи и плесневые грибы. Регламентирование по показателям микробиологического качества и безопасности пищи осуществляется для большинства групп микроорганизмов по альтернативному принципу, т.е. нормируется масса продукта, в которой не допускаются бактерии группы кишечных палочек, большинство условно-патогенных микроорганизмов, а также патогенные микроорганизмы, в том числе сальмонеллы. В других случаях норматив отражает количество колониеобразующих частиц в 1 г (мл) продукта (КОЕ/г, мл). При получении неудовлетворительных результатов анализа хотя бы по одному из микробиологических показателей по нему проводят повторный анализ удвоенного объема выборки, взятого из той же партии. Результаты анализа распространяются на всю партию. В качестве примера определения микробиологических показателей продуктов питания и для демонстрации особенностей микробиологического анализа по сравнению с химическим анализом уместно привести методику исследования молочных продуктов. Молоко и молочные продукты относятся к продуктам высокой пищевой и биологической ценности. Молоко содержит необходимые для организма пищевые и биологические активные вещества в оптимальном соотношении, что позволяет рассматривать его как универсальный продукт, обеспечивающий нормальный рост и развитие организма. Однако вследствие богатого химического состава, высокого содержания воды молоко является благоприятной средой для развития микроорганизмов, которые могут вызывать нежелательные изменения его. На состав и свойства молока могут влиять различные факторы, основными из которых являются: период лактации, возраст, условия кормления и содержания, состояние здоровья животного, условия доения и транспортировки, переработки и сроки реализации. Отбор проб для микробиологического анализа. Пробы для микробиологических анализов отбирают в стерильную посуду с помощью стерильных приспособлений. Отбор проб и перемешивание продукта перед отбором производят отборником, черпаком, ложкой, металлической трубкой, щупом, шпателем или другим соответствующим приспособлением, которые каждый раз перед использованием должны быть пастерилизованы фламбированием или в автоклаве. Микробиологический анализ проводят не более, чем через 4 ч с момента отбора проб. Пробы должны храниться и транспортироваться до начала исследования в условиях, обеспечивающих температуру продуктов не выше 6С, не допуская подмораживания, а для мороженого – не выше минус 2С. Подготовка к анализу.Перед проведением анализа на дистиллированной воде готовят питательную среду Кесслера (модифицированную), состоящую из пептона, стерильной желчи, лактозы и содержащую кристаллический фиолетовый. Приготовленный раствор разливают в пробирки с поплавками по 5 см3 или колбочки с поплавками по 40–50 см3 и стерилизуют при (1212)С в течение (101) мин. Готовая среда должна иметь темно-фиолетовый цвет. Подготовка пробы к анализу зависит от того, какой молочный продукт исследуется. Для молока, творога, сыра, мороженого и других продуктов ГОСТом предусмотрены способы подготовки проб. Методы анализа. Метод определения редуктазы с метиленовым голубым. Метод основан на восстановлении метиленового голубого окислительно-восстановительными ферментами, выделяемыми в молоко микроорганизмами. По продолжительности обесцвечивания метиленового голубого оценивают бактериальную обсемененность сырого молока. В пробирки наливают по 1 см3 рабочего раствора метиленового голубого и по 20 см3 исследуемого молока, закрывают резиновыми пробками и смешивают путем медленного трехкратного переворачивания пробирок. Пробирки помещают в редуктазник с температурой воды (371)С. При отсутствии редуктазника можно пользоваться водяной баней, помещаемой в термостат с температурой (371)С. Вода в редуктазнике или водяной бане после погружения пробирок с молоком должна доходить до уровня жидкости в пробирке или быть немного выше. Температуру воды поддерживают в течение всего времени определения (371)С. Для предотвращения влияния на реакцию света редуктазник должен быть плотно закрыт крышкой. Момент погружения пробирок в редуктазник считают началом анализа. Наблюдение за изменением окраски ведут 40 мин, 2 ч 30 мин, 3 ч 30 мин с начала проведения анализа. Окончанием анализа считают момент обесцвечивания окраски молока. При этом остающийся небольшой кольцеобразный окрашенный слой вверху (шириной не более 1 см) или небольшая окрашенная часть внизу пробирки (шириной не более 1 см) в расчет не принимаются. Появление окрашивания молока в этих пробирках при встряхивании не учитывают. В зависимости от продолжительности обесцвечивания молоко относят к одному из четырех классов, указанных в таблице 3.1. Таблица 3.1. – Классы молока в зависимости от продолжительности обесцвечивания
Определение общего количества бактерий. Метод основан на способности мезофильных аэробных и факультативно-анаэробных микроорганизмов размножаться на плотном питательном агаре при температуре (371)С в течение 72 ч. Количество выросших колоний подсчитывают на каждой чашке, поместив ее верх дном на темном фоне, пользуясь лупой. Каждую подсчитанную колонию отмечают на чашке. При большом числе колоний и равномерном их распределении дно чашки Петри делят на 4 и более одинаковых секторов. Подсчитывают число колоний в 2–3 секторах, находят среднее арифметическое, умножают на общее количество секторов всей чашки. Таким образом, находят общее количество колоний, выросших на одной чашке. Общее количество бактерий в 1 см3 или в 1 г продукта (Х) в единицах вычисляют по формуле: X = n·10m,
За окончательный результат принимают среднее арифметическое, полученное по всем чашкам Петри. Определение бактерий группы кишечных палочек (БГКП). Метод основан на способности БГКП сбраживать в питательной среде лактозу с образованием кислоты и газа при температуре 37С в течение 24 ч. По 1 см3 соответствующих разведений продукта засевают в пробирки с 5 см3 среды Кесслера. Пробирки с посевами помещают в термостат при 37С на 18–24 ч. Просматривают пробирки с посевами и по наличию газообразования в них определяют количество БГКП. При отсутствии газообразования через 18–24 ч продукт считают незагрязненным БГКП. По изменению окраски судят о наличии кислоты. Наличие кислоты и газов указывает на наличие БГКП. Контрольные вопросы: Какие группы микроорганизмов обязательно контролируются в продуктах питания? Какими патогенными микроорганизмами могут быть загрязнены продукты питания? Каково воздействие отдельных видов микроорганизмов на человека? Каковы причины возникновения сальмонеллеза и какие продукты наиболее опасны в этом плане? Что такое ботулизм? Какие продукты чаще всего содержат ботулотоксины и какие условия способствуют поражению ими продуктов? §3.2. Микотоксины Микотоксины. Микотоксины (от греч. mukes – гриб и toxicon – яд) – токсичные продукты жизнедеятельности микроскопических плесневых грибов, обладающие выраженными токсическими свойствами. Плесневые грибы – повсеместно распространенные микроорганизмы. Их роль в возникновении порчи при хранении известна точно так же, как и их применение в ферментативных процессах при изготовлении отдельных видов сыров или при микробиологическом синтезе лимонной кислоты и пенициллина. Токсичность заплесневелых пищевых продуктов и кормов известна сравнительно давно. Проблема микотоксинов известна с глубокой древности. Периодически случались отравления людей и животных при употреблении продуктов, содержащих микотоксины. Наиболее известна гибель 14 тысяч человек в Париже в 1129 г. от употребления хлеба, содержащего микотоксин (эрготоксин) спорыньи злаков. В России также отмечены случаи массового отравления людей и животных зерном и хлебом, содержащим микотоксины возбудителя фузариоза. Приблизительно с 60-х годов 20-го века проблема микотоксинов приобрела глобальный характер в связи с нарушением экологического равновесия при интенсивных технологиях возделывания сельскохозяйственных культур, а также из-за повышения содержания фотооксидантов в атмосфере (воздушного загрязнения), из-за чего растения теряют устойчивость к фитопатогенам. Возрастание микотоксикоза сельскохозяйственных продуктов связано также с широким применением азотных удобрений и пестицидов. Имеет значение и ограниченное количество генотипов сортов сельскохозяйственных культур. В настоящее время нет эффективных химических способов борьбы с загрязнением продуктов урожая злаковых культур микотоксинами. Распространение микотоксинов в пищевых продуктах зависит от их образования специфическими штаммами грибов и подвержено влиянию таких факторов, как влажность и температура. Таким образом, загрязнение пищевых продуктов может изменяться в зависимости от географических условий, методов производства и хранения, вида продукта. Грибы-продуценты микотоксинов широко распространены в природе и способны развиваться практически на всех продуктах как растительного, так и животного происхождения с образованием токсинов на любом из этапов их производства – в полевых условиях, при уборке, транспортировке, хранении урожая, в процессе кулинарной обработки. Токсины не удаляются из пищевых продуктов обычными способами кулинарной обработки. Снижения содержания токсинов в продуктах можно добиться правильным хранением урожая, применением устойчивых сортов, пестицидов. Характерно, что семена, в которых концентрируются токсины, отличаются окраской и их можно и нужно отделить. Микотоксины являются важнейшими вторичными метаболитами микроскопических грибов, которые в течение последних 35–40 лет признаны одними из наиболее вредных для здоровья человека и животных агентов, введены в перечень веществ, регламентированных в пищевых продуктах, кормах и сырье. Высокая опасность микотоксинов выражается в том, что они обладают токсическим эффектом в чрезвычайно малых количествах и способны весьма интенсивно диффундировать вглубь продукта. Выделено более 300 микотоксинов, продуцируемых представителями 350 видов микроскопических грибов, однако практическое значение как загрязнители пищевых продуктов имеют лишь около 20. Многие из них обладают мутагенными (в том числе канцерогенными) свойствами. Среди микотоксинов, представляющих опасность для здоровья человека и животных, наиболее распространены афлатоксины (формула I и II), трихотеценовые микотоксины, или трихотецены (III–IV), охратоксины (V), патулин (VI), зеараленон и зеараленол (VII), формулы представителей которых приведены в таблице 3.2. Большинство микотоксинов – кристаллические вещества (табл. 3.3), термически стабильны, хорошо растворимые в органических растворителях. Микотоксины (за исключением охратоксинов) достаточно устойчивы к действию кислот, разрушаются щелочами с образованием нетоксичных или малотоксичных соединений. Для многих из микотоксинов установлена структура, изучены свойства и биохимический механизм действия, разработаны методы выделения, идентификации и количественного определения. К их числу относятся афлатоксины, охратоксины, патулин, цитринин, зеараленон, трихотеценовые микотоксины. Учитывая, что микотоксины, помимо общетоксического действия, обладают мутагенными, тератогенными и канцерогенными свойствами, а также существенно влияют на иммунный статус теплокровных, их следует рассматривать как одну из важнейших медицинских проблем. Потенциальная и реальная опасность микотоксинов значительно усиливается их высокой стабильностью к различным неблагоприятным Таблица 3.2. – Микотоскины, наиболее распространенные в продуктах питания
Таблица 3.3. – Основные физико-химические свойства микотоксинов
воздействиям, как-то: кипячение, обработка минеральными кислотами, щелочами и другими агентами. География распространения микотоксинов охватывает большинство стран всех континентов. Контаминации микотоксинами подвержены все основные продукты питания, корма, продовольственное сырье, а интенсивные торговые связи между различными странами в значительной степени способствуют распространению как микотоксинов, так и микотоксикозов, поэтому эта проблема имеет глобальный характер. Афлатоксины. В эту группу наиболее опасных микотоксинов входят более 15 их представителей, которые продуцируются грибами Aspergillus flavus и Aspergillus раrasiticus. Эти грибы встречаются повсеместно, чем объясняются значительные масштабы загрязнения ими пищевых продуктов и кормов. Размножение грибов Aspergillus связано с определенным набором условий: высокий уровень углеводов, низкое содержание протеинов, наличие ионов металлов, таких как, Cd2+, Mg2+, Ca2+, Zn2+. Особое значение имеет цинк, потому, что он интенсивно потребляется при синтезе афлатоксинов. На развитие грибов, продуцирующих афлатоксины, влияют влажность продукта и воздуха, температура воздуха, освещенность, рН. Оптимальной температурой для образования токсинов является температура 27–30ºС, хотя синтез афлатоксинов возможен и при более низкой (12–13ºС) или при более высокой (40–42ºС) температуре. Критическим фактором, также определяющим рост микроскопических грибов и синтез афлатоксинов, является влажность субстрата и атмосферного воздуха. Максимальный синтез токсинов наблюдается при влажности выше 18% для субстратов, богатых крахмалом (пшеница, ячмень, рожь, овес, рис, кукуруза), и выше 9–10% – для субстратов с высоким содержанием липидов (арахис, подсолнечник, различные виды орехов). При относительной влажности воздуха ниже 85% синтез афлатоксинов прекращается. По своей химической структуре афлатоксины являются фурокумаринами (табл. 3.3). Афлатоксины слаборастворимы в воде (растворимость порядка 10–20 мг/л), нерастворимы в неполярных растворителях, но хорошо растворяются в растворителях средней полярности, таких как хлороформ, метанол, диметилсульфоксид и др. Афлатоксины обладают способностью сильно флуоресцировать при воздействии длинноволнового УФ-излучения. Афлатоксины В1 и В2 обладают сине-голубой флуоресценцией, G1 и G2 – зеленой флуоресценцией, М1 и М2 – сине-фиолетовой (В1:ех = 265 360 нм, ем = 425 нм). Это свойство лежит в основе практически всех физико-химических методов их обнаружения и количественного определения и позволяет определять афлатоксины в низких концентрациях (М1 в молоке 0,02 мкг/л). Способность флуоресцировать послужила также основой для названия афлатоксинов: группа В – голубая флуоресценция (blue), G – зеленая (green). Подстрочные индексы связаны с хроматографической подвижностью соединения. В виде чистых веществ афлатоксины чрезвычайно термостабильны при нагревании на воздухе, но относительно легко разрушаются под воздействием света, особенно УФ-лучей. Афлатоксины (главным образом токсин В) являются основными загрязнителями пищевых продуктов. Высокой токсичностью обладают афлатоксины В1, В2, G1 и G2 (для афлатоксина B1 ЛД50 = 7,8 мг/кг (макаки, перорально)). Афлатоксины или их активные метаболиты действуют практически на все компоненты клеток. Афлатоксины нарушают проницаемость плазмотических мембран. Токсичное действие обусловлено их взаимодействием с нуклеофильными участками ДНК, РНК и белков. Биологическая активность афлатоксинов проявляется как в виде острого токсического эффекта, так и отдаленных последствий – канцерогенного, мутагенного и тератогенного эффектов. Острое токсическое действие афлатоксинов связано с тем, что они являются одними из наиболее сильных гепатропных ядов, органом-мишенью которых является печень. Особенно опасны афлатоксины для детей, поскольку резко угнетают их рост, физическое и умственное развитие, снижают устойчивость к инфекционным заболеваниям. Понемногу накапливаясь в организме, афлатоксины через десятилетие, два, три могут вызвать рак печени. Одним из доказательств реальной опасности афлатоксинов является тот факт, что в ряде стран Африки и Азии, где наблюдаются острые афлатоксикозы у людей, выявлена прямая корреляция между частотой заболевания населения раком печени и содержанием афлатоксинов в пищевых продуктах. В настоящее время основным токсином, нормируемым в пищевых продуктах, является афлатоксин В1. Его ПДК в Германии составляет 2 мкг/кг, 5 мкг во Франции и 1 мкг в Швеции. В России и РБ норма для всех пищевых продуктов, кроме молока, составляет 5 мкг/кг В1 и для молока и молочных продуктов – 0,5 мкг/кг М1 (при недопустимом содержании в них афлатоксина В1). Допустимая суточная доза – 0,005–0,01 мкг/кг массы тела. В естественных условиях афлатоксины загрязняют арахис, кукурузу, некоторые зерновые, бобы какао, семена масличных культур, продукты их переработки. Афлатоксины могут также накапливаться в зернах какао, кофе и ряде других пищевых продуктов, в кормах сельскохозяйственных животных. Загрязнение афлатоксинами является серьезной проблемой для сельскохозяйственной продукции растительного происхождения из стран и регионов с субтропическим климатом. Оптимальные условия для образования афлатоксинов могут также возникать при неправильном хранении сельскохозяйственной продукции, например, при самосогревании зерна. В естественных условиях встречаются 4 афлатоксина: афлатоксины В1 и В2 и афлатоксины G1 и G2. Среди них высокими токсическими свойствами и наиболее широкой распространенностью выделяется афлатоксин В1. С молоком коров, потребляющих корма, загрязненные афлатоксинами В1 и В2, может выделяться до 3% потребленных афлатоксинов в виде соответствующих гидроксилированных метаболитов – афлатоксинов М1 и М2. Причем афлатоксин М1 обнаружен как в цельном, так и в сухом молоке, и даже в молочных продуктах, подвергшихся технологической обработке (пастеризация, стерилизация, приготовление йогутров, творога, сыров). Ввиду высокой токсичности и канцерогенности афлатоксинов и обнаружения их в значительных количествах в основных продуктах питания, в настоящее время применяют комплекс мероприятий по детоксикации загрязненных продуктов. Различают механические, физические и химические методы детоксикации. Механические методы связаны с отделением загрязненного материала вручную или с помощью электронно-колориметрических сортировщиков. Физические методы основаны на достаточно жесткой термической обработке материала или связаны с ультрафиолетовым облучением и озонированием. Химический метод предполагает обработку материала сильными окислителями. Каждый из указанных методов имеет свои существенные недостатки: применение механических и физических методов не дает высокого эффекта, а химические методы приводят к разрушению не только афлатоксинов, но и полезных нутриентов и, кроме того, нарушают всасывание. Так, химическая детоксикация кормов аммиаком при повышенном давлении и температуре (США, Франция) или пероксидом водорода (Индия) позволяет снизить содержание афлатоксинов до безопасного уровня. При этом, однако, теряется часть питательной ценности корма. Перспективна биологическая детоксикация афлатоксинов и других микотоксинов некоторыми видами микроорганизмов. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||