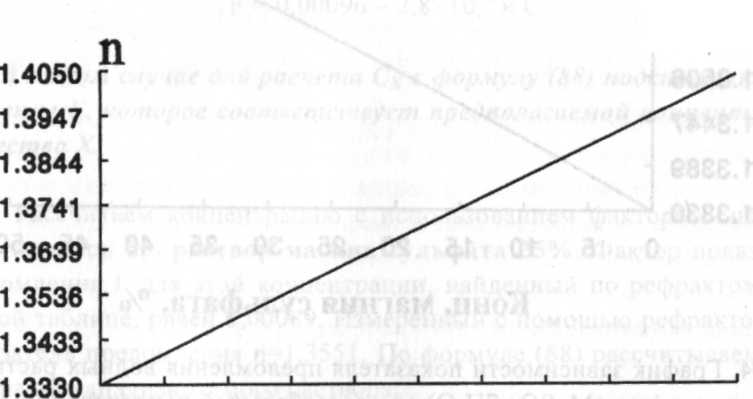
Конц. сахарозы, %Рис. 5. Графики зависимости показателя преломления водных растворов сахарозы от
массообъемной концентрации и от концентрации, выраженной в виде массовой доли.
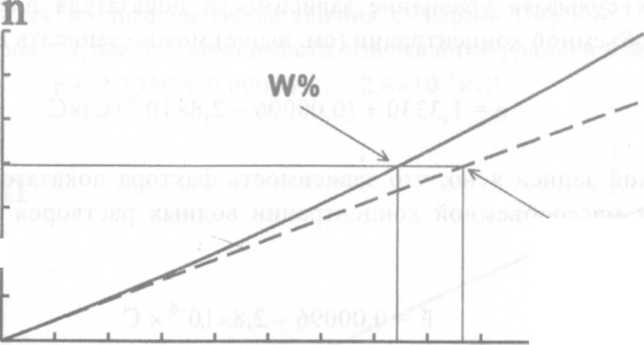
Учет температуры.Для
жидкостей и газов при повышении температуры (t) величина показателя преломления уменьшается, при понижении - увеличивается. Эта зависимость в узком температурном интервале (20°С ± 5°С)
для разбавленных водных растворов приближенно описывается уравнением (92):
п' и п
20 + (20 - t) х 0,0001 , (92)
где 0,0001 - температурный коэффициент
dnldt, °С
-1.
Выражение (92) означает, что при изменении температуры на 1°С показатель преломления разбавленного водного раствора изменяется приблизительно на 0,0001. Отсюда:
п20 * п' - (20 -1) х
0,0001 (93).
Формулу (93) можно использовать вместо термостатирования исследуемой пробы.
На практике чаще применяют другой подход. Поскольку показатель преломления раствора складывает^ из показателей преломления растворителя и растворенного вещества [см. формулу (86)], то и температурный коэффициент раствора в целом
{dnldt) складывается из температурных коэффициентов растворителя
(dn0/'dt) и растворенного вещества
(dnx/dt):dnldt = dnoldt + dnxldt(94)
Однако температурный коэффициент показателя преломления твердых тел в десятки раз меньше, чем у жидкостей. Поэтому для растворов твердых лекарственных веществ величиной можно
dnxldtпренебречь:
dnldt« dn0ldt(95)
Из выражения (95) следует правило:
при колебаниях температуры (в пределах 20°С ± 5°С) показатели преломления растворителя и разбавленного раствора твердого лекарственного вещества изменяются практически на одну и ту же величину. Это позволяет не термостатиро-вать растворы, а
определять показатель преломления растворителя и исследуемого раствора при одной температуре и использовать полученные значения в формуле (88) для расчета концентрации растворенного вещества. Поскольку это правило не распространяется на смеси жидкостей, то оно не может быть применено, например, к спирто-водным растворам при определении концентрации этанола (но может - при определении концентрации твердых веществ в спирте).
ПРОПИСЬ 66
Раствор глюкозы 10% - 100 мл.Измерение показателя преломления раствора при 18°С дало результат 1,3475. Требуется найти концентрацию глюкозы.
Первый подход. По формуле (93) рассчитываем, что при 20°С показатель преломления должен быть равен 1,3473. По рефрактометрической таблице находим (с привлечением метода интерполяции), что такому значению п соответствует концентрация глюкозы 10,07%. Можно также по рефрактометрической таблице найти, что фактор показателя преломления F для растворов глюкозы равен 0,00142, и, используя формулу (38), рассчитать концентрацию глюкозы:
С = (1,3473 - 1,3330) / 0,00142 = 10,07%.
Второй подход. Используя вышеуказанное
правило для водных растворов твердых веществ, измеряем при той же температуре показатель преломления воды очищенной - 1,3332. По рефрактометрической таблице находим, что фактор показателя преломления F для растворов
1П1глюкозы равен 0,00142. Подставляем найденные значения в формулу (88):
С = (1,3475 - 1,3332) / 0,00142 = 10,07%.
Примечания.
Показатель преломления зависит от давления, поскольку оно влияет на плотность вещества. Однако у жидкостей и твердых тел, сжимаемость которых очень мала, увеличение давления даже на 1 атм. вызывает обычно повышение п на несколько единиц 105. Для газов, напротив, влияние давления так же велико, как и температуры, и обязательно учитывается при измерениях показателя преломления.
Часто для расчета содержания глюкозы в водном растворе приводят следующую формулу:
П -По С 0,00142x100 '
где п и п
0 - показатели преломления соответственно раствора и растворителя, а 0,00142 - фактор показателя преломления водных растворов глюкозы. При этом значение 100 в знаменателе служит для перевода концентрации глюкозы из процентов (г/100 мл) в г/мл, чтобы удобнее было сопоставлять получаемые значения концентрации со значениями, приведенными в Государственной фармакопее (в ГФ допустимые пределы содержания глюкозы указаны в г/мл).
3. Ранее в примечаниях к рефрактометрическим таблицам указывалось,
что при использовании в расчетах фактора показателя преломления
безводной глюкозы (0,00142) для окончательного подсчета концен-
трации растворов глюкозы,
предназначенных для внутреннего упот-
ребления, необходимо прибавить 10% к найденной по таблице кон-
центрации. Это было связано с особенностями изготовления раство-
ров глюкозы, применяемых
peros: при расчете необходимого коли-
чества глюкозы не учитывали ее 10% влажность и получали концен-
трацию
водной глюкозы, а реальная концентрация лекарственного
вещества, определяемая каким-либо методом, оказывалась ниже.
Однако с 1 января 1998 года приказом Минздрава РФ № 308 введена
в действие новая «Инструкция по изготовлению в аптеках жидких
лекарственных форм». Согласно этой инструкции все растворы глю-
козы независимо от способа употребления готовятся с учетом 10%
влажности. Это означает, что концентрация инъекционных раство-
ров и растворов для внутреннего употребления - это концентрация
безводной глюкозы и
никакие дополнительные расчеты при количественном определении вести не следует.8.3. АНАЛИЗ МНОГОКОМПОНЕНТНЫХ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ
8.3.1. Анализ жидких лекарственных форм.8.3.1.1. Рефракто-титриметрический анализ.Рефрактометрический анализ смесей лекарственных веществ основывается на правиле аддитивности показателей преломления [сравните с уравнением (86)]:
п = п
0 + п, +п
2...+ rii = no + C,F, + С
2Ғ
2...+ CjFj (96)
То есть показатель преломления раствора равен сумме показателей преломления всех его компонентов - растворителя и растворенных веществ. Из уравнения (46) можно вывести формулу для расчета концентрации одного из компонентов смеси:
_п-(п0+С2Ғ2+---+С,Ғ)(9 Ғ,При
этом имеется в виду, что все остальные компоненты смеси определяются какими-либо другими методами, например титриметрически, и перед проведением расчета по формуле (97) все концентрации, кроме С-1, уже известны.
Если содержание определяемого компонента в препарате необходимо получить в граммах (mi), расчет ведут по формуле (98):
п-(^.+C;F2+ --+C,F,));FnfCT^M /98ч
т Fi100где:
100 - коэффициент, служащий для перевода концентрации
из % (г/100 мл) в г/мл;
^препарата — общий объем препарата, мл.
ПРОПИСЬ 67
Натрия бромида 2,0 Магния сульфата 5,0 Раствора глюкозы 20% - 200,0 млВ этом случае натрия бромид определяют методом аргентометрии (тит-рант - 0,1 н. раствор нитрата серебра, индикатор - бромфеноловый синий), магния сульфат - методом комплексонометрии (титрант - 0,05 М раствор трилона Б, индикатор - индикаторная смесь кислотного хром-черного специального). Глюкозу в присутствии натрия бромида целесообразно определить рефрактометрическим методом. Расчет содержания глюкозы в процентах (Сглк) выполняют по формуле (97):
Сглк
= [п - (по +
CNaBrxFNaBr + CMgso4xFMgS04)] / Ғ
ГЛк , где
n - показатель преломления раствора;
п
0 - показатель преломления воды очищенной, измеренный
при той же температуре; Сшвг - концентрация натрия бромида в растворе, определенная методом
аргентометрии;
FNaBr - фактор показателя преломления раствора натрия
бромида для
найденной концентрации;
CMgso4 - концентрация магния сульфата (MgS0
4'7H
20) в растворе,
определенная методом комплексонометрии;
FMgS04 - фактор показателя преломления раствора
магния сульфата (MgSCv7H
20) для найденной концентрации; Ғглк - фактор показателя преломления раствора глюкозы.
Использование рефрактометрии при изготовлении и анализе раствора глицерина 10% для инъекций.ПРОПИСЬ 68
Раствора глицерина 10% - 1000 млСостав. Глицерина 100,0 г (в пересчете на безводный) Натрия хлорида 9,0 г Воды для инъекций до 1 л.
1. Изготовление. От производителей поступает глицерин (высший
сорт, динамитный) с количественным содержанием 86 - 90% и'94 -
98% и более. Поэтому, чтобы рассчитать количество исходного гли-
церина, необходимо точно знать, какова в нем массовая доля без-
водного вещества. С этой целью применяют рефрактометрию. На-
пример, показателю преломления исходного глицерина п= 1,4569 со-
ответствует массовая доля безводного вещества 89% (или 0,89).
Следовательно, количество исходного глицерина (тглиц, г), которое
требуется для изготовления раствора по прописи 68, равно:
тглиц. = ЮО г / 0,89 = 112,36 г
2. Количественное определение глицерина в растворе.
Концентрацию глицерина в процентах вычисляют по формуле:
Сглиц. = [п - (п
0 + C
NaCixF
NaCi)] / Ғглиц, где
п - показатель преломления раствора;
п
0 - показатель преломления воды очищенной, измеренный
при той же температуре;
CNaCi - концентрация натрия хлорида в растворе, определенная
методом аргентометрии;
FNaci_ фактор показателя преломления раствора натрия
хлорида для найденной концентрации; Ғглиц. - фактор показателя преломления
10% раствора глицерина (0,001156).
{Примечания.
1. Если для одного из веществ, входящих в раствор, фактор показателя преломления неизвестен или незначительная его концентрация не позволяет получить точных данных, то готовят контрольный раствор, содержащий это вещество в той концентрации, которая была определена титриметрическим методом. При расчетах показатель преломления контрольного раствора учитывают как показатель преломления растворителя п
0.
Результаты определения лекарственных веществ в многокомпонентных препаратах рефрактометрическим
методом зависят от того, насколько точно соблюдается правило аддитивности (96) показателей , преломления. Если между компонентами раствора протекают реакции соле- и комплексообразования, показатель преломления смеси веществ не равен алгебраической сумме показателей преломления данных веществ в тех же концентрациях. Например, нельзя рефрактометрически определить ментол в меновазине, так как в спирто-водной среде аминогруппа анестезина взаимодействует с гидрохлоридом новокаина, и показатель преломления смеси будет меньше, чем алгебраическая сумма показателей преломления веществ в тех же концентрациях. Поэтому содержание ментола при расчете получается заниженным.
8.3.1.2. Рефракто-денсиметрический и рефракто-экстракционный методыБывают ситуации, когда титриметрический анализ не позволяет провести количественное определение одного из компонентов. Например, в случае раствора хлоридов натрия и калия можно оттитровать только сумму хлоридов и поэтому нельзя воспользоваться формулой (97). Но рефрактометрический анализ тройных систем, состоящих из растворителя и двух растворенных веществ, возможен и без предварительного количественного определения одного из них. Для решения такой задачи с двумя неизвестными требуется определение второго, помимо показателя преломления, параметра, характеризующего состав системы. Чаще других для анализа тройных систем применяется
рефракто-денсиметрический метод, заключающийся в измерении показателя преломления и плотности раствора. Суть данного подхода состоит в следующем. Одному показателю преломления может соответствовать бесконечно большое множество соотношений двух растворенных веществ. То же самое можно сказать и о плотности. Но одному показателю преломления и одной плотности (для того же раствора) соответствует только одна концентрация каждого из двух растворенных веществ.
Определение состава рефракто-денсиметрическим методом обычно проводится графическим путем. Для этого готовят большое количество тройных смесей точно известного состава и измеряют их показатели преломления и плотности. Затем строят треугольную диаграмму с сеткой изо-рефракт и изоденс (линии равных показателей преломления и линии равной плотности). Для определения состава исследуемого раствора находят точку пересечения изорефракты и изоденсы, отвечающую показателю преломления и плотности смеси. На рис. 6 в уменьшенном виде показана такая диаграмма для анализа тройных смесей этилового и метилового спиртов с водой.
Например, плотности 0,880 и показателю преломления 95,0 (условные деления шкалы рефрактометра) соответствует точка пересечения изоденсы 0,88 и изорефракты 95,0, отвечающая составу 34% воды, 60% этанола и 6% метанола.

Рис. 6. Диаграмма для рефракто-денсиметрического анализа тройной системы этиловый спирт - метиловый спирт - вода.
В настоящее время при массовом использовании вычислительной техники необходимость в таких графических расчетах и связанной с ними длительной подготовительной работе отпадает, так как подобные задачи сводятся к решению систем нелинейных уравнений (например кубических или квадратных).
Рефракто-денсиметрический метод был предложен еще в 1843 году для определения содержания экстрактивных веществ и спирта в пиве. Некоторое неудобство данного метода заключается в необходимости располагать сравнительно большим количеством анализируемой смеси для точного определения плотности.
В рефракто-экстракционном методе один из компонентов количественно удаляется подходящим растворителем, и задача сводится к простому случаю рефрактометрического анализа раствора, содержащего одно растворенное лекарственное вещество. Применимость этого способа ограничивается трудностью подбора соответствующего селективного растворителя.
ПРОПИСЬ 69
Амидопирина 4,0  Скачать 2.86 Mb.
Скачать 2.86 Mb.