ОХТ(шпоры). УКлассификация технологических процессов механические и химические технологии промышленность неорганических веществ промышадность органических веществ (включая производство и переработку пищевых продуктов)
 Скачать 3.28 Mb. Скачать 3.28 Mb.
|
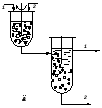
3Реакторы для проведения реакций в системе газ–жидкость (Г-Ж) и жидкость–жидкость (Ж-Ж)Реакторы для проведения процессов в системе газ–жидкость конструируются по принципу абсорбционных аппаратов, имеют большой объем, но относительно просты и легки в эксплуатации. Чаще всего это реакторы непрерывного действия, иногда используются реакторы полупериодические, имеющие непрерывное питание газом, реже применяются периодические реакторы (для системы жидкость–жидкость). На рисунке 4.3 показаны принципиальные схемы аппаратов, используемых для осуществления контакта жидкости с газом и жидкости с жидкостью. Это могут быть аппараты типа колонн с насадкой (рис. 4.3,а), барботажные колонны (рис. 4.3,б,в), либо аппараты оросительного типа (рис. 4.3,г).
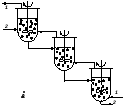
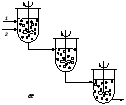
Нужно отметить, что для многих аппаратов, применяемых для проведения реакций в системе Г-Ж (Ж-Ж), характерны режимы вытеснения с параллельными потоками или противотоком (рис. 4.3,а-г). Однако могут быть использованы и аппараты, работающие в режиме смешения – одиночные аппараты с мешалками (система смеситель–сепаратор) (рис. 4.3,д), а также каскады таких реакторов (рис. 4.3,е,ж).
Способы получения. Еще в XIII в. серную кислоту получали в незначительных количествах термическим разложением железного купороса FеЗО.,, поэтому и сейчас один из сортов серной кислоты называется купоросным маслом, хотя уже давно серная кислота не производится из купороса. В настоящее время серная кислота производится двумя способами: нитрозным, существующим более 200 лет, и контактным, освоенным в промышленности в конце XIX и начале XX в. Контактный способ вытесняет нитрозный (башенный). Первой стадией сернокислотного производства по любому методу является получение двуокиси серы при сжигании сернистого сырья. После очистки двуокиси серы (особенно в контактном методе) ее окисляют до трехокиси серы, которая соединяется с водой с получением серной кислоты. Окисление 503 в 503 в обычных условиях протекает крайне медленно. Для ускорения процесса применяют катализаторы. Вконтактном методе производства серной кислоты окисление двуокиси серы в трехокнсь осуществляется на твердых контактных массах. Благодаря усовершенствованию контактного способа производства себестоимость более чистой и высококонцентри рованной контактной серной кислоты лишь незначительно выше, чем башенной. Поэтому в СССР строятся лишь контактные цехи. В настоящее время свыше 80% всей кислоты производится контактным способом. В нитрозном сцособе катализатором служат окислы азота. Окисление S02 происходит в основном в жидкой фазе и осу ществляется в башнях с насадкой. Поэтому нитрозный способ по аппаратурному признаку называют башенным. Сущность башенного способа заключается в том, что полученная при сжигании сернистого сырья двуокись серы, содержащая примерно 9% 503 и 9—10% 02, очищается от частиц колчеданного огарка н поступает в башенную систему, состоящую из нескольких (четырех—семи) башен с насадкой. Башни с насадкой работают по принципу идеаль ного вытеснения при политермическом режиме. Температура газа на входе в первую башню около 350° С. В башнях протекает ряд абсорбционно-десорбционных процессов, осложненных химическими превращениями. В первых двух-трех башнях насадка орошается нитрозой, в которой растворенные окислы азота химически связаны в виде нитрозилсерной кислоты ( При высокой температуре нитрозилсерная кислота гидролизуется по уравнению Двуокись серы абсорбируется водой и образует сернистую кислоту: последняя реагирует с окислами азота в жидкой фазе: Частично S03 может окисляться в газовой фазе: S03, абсорбируясь водой, также дает серную кислоту: 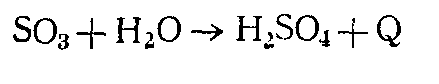 Окись азота десорбируется в газовую фазу и окисляется до двуокиси азота кислородом воздуха: Окислы азота 63 Технология производства аммиака. Фиксация атмосферного азота. Синтез, транспортировка и хранение аммиака. Синтез соединений азота из свободного атмосферного азота был осуществлен в начале XX в. тремя методами: дуговым, цианамидным и аммиачным. Дуговой метод заключается в том, что при высокой температуре азот соединяется с кислородом воздуха по уравнению реакции N2 + 02 = 2NО. Окись азота окисляется до двуокиси, которая поглощается водой с образованием НNO3. Способ был оставлен ввиду малого выхода окиси азота и громадной затраты электроэнергии на образование электрической дуги. Однако в настоящее время подобный метод высокотемпературного окисления азота кислородом воздуха возрождается на основе применения плазменных процессов. Цианамидный метод заключается в том, что тонкоизмельченный карбид кальция при температуре около 1000° С взаимодействует с азотом по уравнениюСаС2+N2= СаСN2 +С настоящее время роль этого метода в промышленности связанного азота незначительна. Аммиачный метод связывания атмосферного азота имеет экономические преимущества перед другими методами. Расход энергии на 1 т связанного азота по этому методу меньше, чем в дуговом и циан амидном методах. Первый завод для синтеза аммиака был построен в Германии в 1913 г. Синтез аммиака протекает по уравнению N2 + ЗН2=2NН3+Q Для синтеза аммиака необходимо иметь азот и водород (азото-водородную смесь) в соотношении N2 : Н2 = 1 : 3. В производстве аммиака азот, необходимый для азотоводородной смеси, получают из воздуха двумя принципиально различными способами: 1) физическим разделением воздуха на азот и кислород и 2) совместно с получением водорода путем связывания всего кислорода воздуха в виде С02 и последующего отделения С02 от азотоводородной смеси. Источником водорода являются метан и его гомологи, водяной и полуводяной газы, коксовый газ, вода. ПОЛУЧЕНИЕ АЗОТА И КИСЛОРОДА РАЗДЕЛЕНИЕМ ВОЗДУХА Основные газы, входящие в состав воздуха (об. %): азот 78,03, кислород 20,95, аргон 0,94. В незначительном количестве в воздухе содержатся С02, Н2, Ne, Не, Кг, Хе. Отдельные газы, входящие в состав воздуха, широко применяются в ряде отраслей народного хозяйства. Разделение воздуха на составные части производится методом ректификации жидкого воздуха и основано на различии температур кипения отдельных газов, входящих в состав воздуха. Сложной частью этого процесса является превращение воздуха в жидкое состояние ПРОИЗВОДСТВО ВОДОРОДА И АЗОТОВОДОРОДНОЙ СМЕСИ ДЛЯ СИНТЕЗА АММИАКА Водород, необходимый для синтеза аммиака, в промышлен ности получают одним из следующих способов; 1) конверсией метана природного газа или его гомологов с последующей конверсией СО; 2) конверсией окиси углерода водяного или полуводяного газа, полученного газификацией твердого или жидкого топлива; 3) раз делением коксового газа путем последовательного сжижения всех компонентов газовой смеси, кроме водорода; 4) электролизом воды или раствора хлорида натрия. До недавнего времени большую часть водорода для синтеза аммиака получали из кокса газификацией с последующей конверсией СО. В настоящее время твердое топливо практически пол ностью заменено газовым сырьем: природным газом, попутными газами нефтедобычи, газами нефтепереработки и остаточными газами получения ацетилена из природного газа. СИНТЕЗ АММИАКА. Теоретические основы синтеза аммиака. Синтез аммиака идет без образования побочных продуктов по уравнению N2+3H2=2NH3+Q Тепловой эффект реакции синтеза аммиака зависит от температуры и давления Как, для смещения равновесия в сторону образования аммиака необходимы высокие давления и низкие температуры. Синтез аммиака без применения катализатора даже при высокой температуре протекает медленно. В производственных условиях для получения требуемой скорости реакции синтез аммиака ведут при температурах не ниже 400—500°С и при участии твердых катализаторов. В качестве катализаторов для этой реакции были испытаны многие элементы и их многочисленные соединения. Для синтеза аммиака катализаторами могут быть железо, платина, осмий, марганец, вольфрам, уран, родий и другие металлы, имею щие в атоме второй снаружи незаполненный электронной слой. Наиболее высокую активность проявляют железо, осмий, рений и уран. В промышленности получил распространение железный катализатор, содержащий три промотора: А1203, К20, СаО. Он показал большую активность и стойкость к перегревам и вредным примесям в азотоводородной смеси. Сероводород и другие содержащие серу соединения отравляют железный катализатор необратимо. Так, при содержании в катализаторе 0,1% серы его актив ность уменьшается на 50%, а для почти полного его отравления Достаточно около 1% серы. Кислород и кислородные соединения (H2О, СО, С02) отравляют железный катализатор очень сильно обратимо. Синтез аммиака —это типичный гетерогенно-каталитический процесс, протекающий через ряд стадий:
с, Промышленные способы синтеза аммиака. В. производстве синтетического аммиака применяется давление от 1-107 до 1-108 Н/м2. В зависимости от применяемого давления различают системы низкого давления, среднего давления и высокого давления. Наиболее распространены системы, работающие при среднем давлении, так как при этих условиях удачно решаются вопросы выделения аммиака при достаточной скорости процесса в контактном аппарате. Азотоводородная смесь при прохождении через слой катализатора неполностью превращается в аммиак. В газе на выходе из контактного аппарата содержание аммиака составляет 14—20%. Газовая смесь, выходящая из контактного аппарата, охлаждается, аммиак конденсируется и отделяется от газа, а непро-реагировавшая азотоводородная смесь при помощи циркуляционного компрессора возвращается вновь в контактный аппарат. Свежая азотоводородная смесь в количестве, отвечающем коли честву образовавшегося в контактном аппарате аммиака, добавляется к оборотной смеси.
Азотная кислота является одной из важнейших минеральных кислот и по объему производства занимает второе место после серной кислоты. Она образует растворимые в воде соли (нитраты), обладает нитрующим и окисляющим действием по отношению к органическим соединениям в концентрированном виде, пассивирует черные металлы. Все это обусловило широкое использование азотной кислоты в народном хозяйстве и оборонной технике. Безводная азотная кислота (моногидрат НNО3) представляет бесцветную жидкость с температурой кристаллизации – 41-60С, температурой кипения – 82-60С и плотностью – 1.513 г/м3. Смешивается с водой во всех отношениях, образуя при этом индивидуальные соединения гидраты состава НNО3*Н2О и НNО3*3Н2О, которые дают три эвтектики. Температура кипения водных растворов азотной кислоты зависит от их концентрации. С увеличением концентрации температура кипения возрастает. Безводная азотная кислота малоустойчива термически и разлагается уже при хранении 4НNО3↔4NО2 +2Н2О +О2 +ΔH Скорость разложения возрастает с повышением концентрации, для 99% кислоты температурный градиент составляет всего 50С. При нагревании процесс ускоряется и протекает по уравнению 2НNО3 ↔ N2О3 +Н2О +О2 +ΔН Выделяющийся оксид азота (4) растворяется в кислоте и окрашивает ее желто-оранжевый цвет. Для удаления оксида азота из кислоты в технологическом процессе ее производства предусмотрена операция «отбелки» кислоты. При растворении оксида азота (4) в кислоте образуется соединение состава НNО3*NО2 (нитроолеум), являющийся промежуточным продуктом в прямом синтезе азотной кислоты. Азотная кислота корродирует и растворяет все металлы кроме золота, платины, титана, тантала, родия, ирридия, однако в концентрированном виде пассивирует железо и его сплавы. Области применения азотной кислоты весьма разнообразны. Большая ее часть расходуется на производство азотных и комплексных минеральных удобрений и разнообразных нитратов, на производство взрывчатых веществ и ракетного топлив,. производство красителей, органическом синтезе и цветной металлургии. В н.в. в промышленных масштабах азотная кислота производится исключительно из аммиака. Поэтому структура сырья азотнокислотного производства совпадает со структурой сырья для производства аммиака. 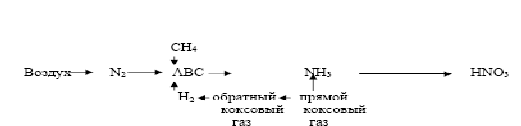 Существует два способа производства азотной кислоты: – получение разбавленной кислоты последующим концентрированием ее в случае необходимости; – непосредственное получение концентрированной азотной кислоты. Наиболее распространен первый способ, что связано с использованием в народном хозяйстве как концентрированной, так и разбавленной кислоты. Методы различаются физико-химическими закономерностями протекающих процессов и технологическими схемами. Однако независимо от схемы, синтез азотной кислоты из аммиака описывается общей химической схемой: NН3 NО NО2 (N2О4) НNО3 [Окисление ] [ доокисление абсорбция ] Конверсия аммиака переработка нитрозных газов Первая стадия процесса одинакова как для получения разбавленной, так и для получения концентрированной кислоты. Вторая стадия отличается рядом особенностей. Решающее значение при выборе параметров той или иной технологической схемы имеет выбор оптимального давления на каждой из стадий производства, позволяет использовать более совершенные массообменные устройства и, в конечном итоге, позволяет снизить капитальные затраты. В то же время повышение давления оказывает и негативное воздействие на экономические показатели работы агрегата: ускоряются побочные реакции на стадии окисления аммиака, снижается степень конверсии. 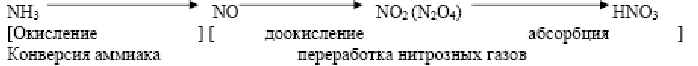 Механизм гетерогенного каталитического окисления аммиака состоит из следующих последовательных стадий: – диффузия молекул аммиака и кислорода из газовой фазы к поверхности катализатора; – активированная адсорбция молекул кислорода на поверхности катализатора с образованием промежуточного соединения – хемосорбция молекул аммиака и образование комплекса; – разложение комплекса с регенерацией катализатора и образованием молекул оксида азота(2) и воды; – диффузия продуктов реакции с поверхности катализатора в газовую фазу. 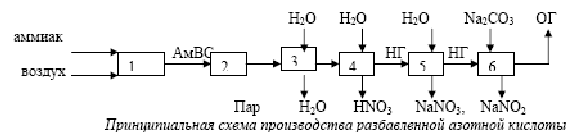 1-очистка аммиака и воздуха и их смешение; 2- окисление аммиака на катализаторе; 3, 4 – охлаждение нитрозных газов с использованием теплоты процесса окисления; 5- окисление оксида азота (2) и образование азотной кислоты; 6- очистка (нейтрализация) отходящих газов; АмВС - аммиачно-воздушная смесь; НГ – нитрозные газы; ОГ – отходящие газы. Поскольку определяющим параметром является давление, все существующие технологические схемы производства разбавленной азотной кислоты делятся на три типа: -при атмосферном давлении (тип 1); -при высоком давлении (тип 2); -с двумя ступенями давления (комбинированные схемы) Технологическая схема производства разбавленной азотной кислоты под высоким давлением имеет следующие основные показатели: – давление на стадии окисления аммиака 0.73МПа; – давление на стадии абсорбции оксида азота(4) 0.65МПа; – катализатор – платиновые сетки; – концентрация азотной кислоты- 0.55 –0.58 мас.дол.; – число агрегатов –3 В схеме предусматриваются: – каталитическая очистка отходящих газов от оксида азота (4), позволяющая снизить его концентрацию с 0.3 до 0.002% об.; – отбелка получаемой азотной кислоты, снижающая содержание в ней оксида азота (4) с 1.0 до 0.2% об.; – утилизация теплоты и потенциальной энергии сжатых газов и, как следствие, энергетическая автономность установки. | |||||||||||||||