ОХТ(шпоры). УКлассификация технологических процессов механические и химические технологии промышленность неорганических веществ промышадность органических веществ (включая производство и переработку пищевых продуктов)
 Скачать 3.28 Mb. Скачать 3.28 Mb.
|
|
Производство минеральных удобрений и ядохимикатов. Классификация удобрений. Комплексные удобрения. Минеральные удобрения классифицируют по трем главным признакам: агрохимическому назначению, составу и свойствам. По агрохимическому назначению удобрения делят на прямые , являющиеся источником питательных элементов для растений, и косвенные , служащие для мобилизации питательных веществ почвы путем улучшения ее физических, химических и биологических свойств. К косвенным удобрениям принадлежат, например, известковые удобрения, применяемые для нейтрализации кислых почв, структурообразующие удобрения, способствующие агрегированию почвенных частиц тяжелых и суглинистых почв и др. Прямые минеральные удобрения могут содержать один или несколько разных питательных элементов. По количеству питательных элементов удобрения подразделяют на простые (односторонние, одинарные) и комплексные.В простые удобрения входит только один из трех главных питательных элементов: азот, фосфор или калий. Соответственно простые удобрения делят на азотные, фосфорные и калийные. Комплексные удобрения содержат два или три главных питательных элемента. По числу главных питательных элементов комплексные удобрения называют двойными (например, типа NP или РК) и тройными (NPK); последние называют также полными. Удобрения, содержащие значительные количества питательных элементов и мало балластных веществ, называют к о н ц е н т р и р о в а н н ы м и. Комплексные удобрения, кроме того, разделяют на смешанные и сложные. Смешанными называют механические смеси удобрений, состоящие из разнородных частиц, получаемые простым тукосмешением. Если же удобрение, содержащее несколько питательных элементов, получается в результате химической реакции в заводской аппаратуре, оно называется сложным. Удобрения, предназначенные для питания растений элементами, стимулирующими рост растений и требующимися в весьма малых количествах, называются м и к р о у д о б р е н и я м и , а содержащиеся в них питательные элементы — м и к р о э л е м е н т а м и . Такие удобрения вносят в почву в очень небольших количествах. К ним относятся соли, содержащие бор, марганец, медь, цинк и другие элементы По агрегатному состоянию удобрения подразделяют на тверд ы е и ж и д к и е 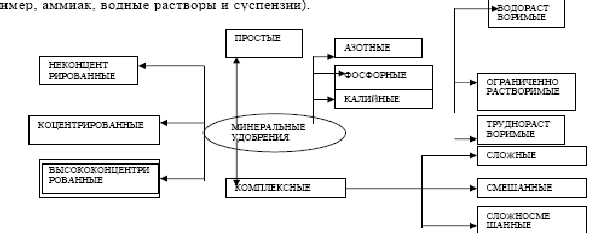 (например, аммиак, водные растворы и суспензии). Классификация МУ по природе питательного элемента, их числу, содержанию. Большое значение имеют физические свойства удобрений. Водорастворимые удобрительные соли должны быть сыпучими, легко рассеиваться, не быть сильно гигроскопичными, не слеживаться при хранении; должны обладать такими свойствами, чтобы сохраняться на почве в течение некоторого времени, не слишком быстро вымываться дождевой водой и не сдуваться ветром. Этим требованиям в наибольшей мере отвечают крупнокристаллические и г р а н у л и р о в а н н ы е удобрения, производство и применение которых непрерывно возрастают. Гранулированные удобрения можно вносить на поля механизированными методами с помощью туковых машин и сеялок в количествах, строго соответствующих агрохимическим требованиям. Эффективным средством для уменьшения слеживания является обработка поверхности гранул поверхностно-активными веществами. В последние годы стали распространенными способы создания вокруг гранул различных оболочек, которые, с одной стороны, предохраняют удобрение от слеживания, а с другой — позволяют регулировать во времени процесс растворения питательных веществ в почвенных водах, т. е. создавать д о л г о в р е м е н н о д е й с т в у ю щ и е у д о б р е н и я
Органический синтез на основе окиси углерода широко применяется в промышленности. Из окиси углерода получают алифатические углеводороды, спирты, альдегиды, карбоновые кислоты и их производные и др. Метиловый спирт (метанол) СНзОН — токсичная жидкость плотностью 796 кг/м3, которая смешивается с водой в любых отношениях, температура кипения 64,7 °С, температура плавления — 95 °С. До 1934 г. в СССР метанол получали сухой перегонкой древесины (древесный спирт). В настоящее время основным методом получения метанола является синтез его из окиси углерода и водорода, протекающий в присутствии катализатора при температуре 230—420°С и давлении 20—32 МПа СО + 2Н3↔СН3ОН + На практике применяют цинкхромовый катализатор, который получают совместным осаждением окислов цинка и хрома на носи теле при соотношении ZnO : Сг203 = 2 : 1 и выпускают в виде таблеток. Образование метанола идет с выделением тепла и уменьшением объема, поэтому для увеличения выхода метанола процесс следует вести при высоком давлении и низкой температуре. Кроме того, на равновесный выход метанола сильно влияет состав газа, т. е. соотношение Н2: СО. При повышении температуры равновесная концентрация метанола снижается и для ее увеличения необходимо повысить давление. Однако с ростом отношения Н2:СО и с повышением давления резко снижается равновесная концентрация СН3ОН, поэтому для достижения максимально возможного выхода метанола поддерживают оптимальные условия процесса. Чаще всего процесс получения метанола ведут при давлении от 20 до 35 МПа, температуре 370—420 °С и объемной скорости 10000—35000 ч-1. Выход метанола в этих условиях составляет 10—20% при времени контакта газа с катализатором 10—40 с. Смесь Н2 и СО в соотношении 4: 1 (применяют и другие соотношения) сжимается в компрессоре до 25 МПа, смешивается в смесителе с непрореагировавшим циркуляционным газом, нагнетаемым компрессором, и поступает в фильтр, где очищается от масла; затем в теплообменнике смесь нагревается до 200 °С и направляется в колонну синтеза метанола. По выходе из нее смесь поступает в межтрубное пространство теплообменника охлаждается, нагревая газовую смесь, поступающую на синтез. Такая организация процесса позволяет вести процесс автотермично. Из теплолообменника газовая смесь, содержащая пары метанола, поступает в водяной холодильник, а затем в сепаратор, где жидкий метанол отделяется от непрореагировавшего газа; последний возвращается циркуляционным компрессоромв смеситель. Метиловый спирт-сырец из сепаратора сливается в сборник и направляется на ректификацию для очистки от различных органических веществ. На 1 т метанола расходуется около 700 м3 окиси углерода и 1400—2000 м3 водорода. Чистый метанол используется для получения формальдегида (около 50%), метилгалогенидов, метиловых эфиров, диметилтерефталата, метилметакрилата и других продуктов, а также в качестве жидкого топлива, растворителя и экстрагента (около 10%). Формальдегид — альдегид муравьиной кислоты — бесцветный газ с резким раздражающим запахом, имеет температуру конденсации— 19°С при атмосферном давлении. Он хорошо растворим б воде, 33—40%-ный водный раствор формальдегида называется формалином. Водный раствор формальдегида при хранении может полимеризоваться, во избежание этого в его состав вводят в качестве стабилизатора 7—12% (масс.) метилового спирта. Формальдегид широко используется для получения фенолокарбамидо и меламино-формальдегидных смол, полиформальдегида, уротропина, изопрена; он образуется в качестве промежуточного продукта в промышленности органического синтеза при получении бутандиола-1,4, пирролидонов, аллилового, и пропилового спиртов. Наиболее распространенным способом получения формальдегида является окислительное дегидрирование метанола в течение 0,01—0,03 с в присутствии катализатора при 500—600 °С СНзОН + 0,502 → НСНО + Н20 Наряду с основной реакцией протекают побочные процессы окисления, дегидрирования и гидрирования до образования окиси и двуокиси углерода и других продуктов. В качестве катализатора применяются медь и серебро в виде сеток либо осажденные на пористом носителе, например, на пемзе. Метанол, содержащий 10—12% воды, из сборника непрерывно поступает в испаритель-подогреватель. Сюда же воздуходувкой подают очищенный в фильтре воздух, который барботирует через слой метанола и насыщается его парами. Для нормальной работы в испарительной системе поддерживается постоянные уровень жидкости и температура (48—50 °С). Образовавшаяся паро - воздушная смесь нагревается до 110 °С в верхней части аппарат и поступает в контактный аппарат с катализатором. Проходя через катализатор, метиловый спирт окисляется с образованием формальдегида, выход формальдегида 80—85% при степени конверсии метанола 85%. Выходящие из контактного аппарата газы содержат 20—22% НСНО, 36—38% N2, СН3ОН, Н2, СО, С02, СН4 и др. В холодильникахони охлаждаются и поступают в поглотительную башню, орошаемую водой и снабженную трубчатым холодильником. Из поглотительной башни б выводится водный 33—40%- ный раствор формальдегида, содержащий 10—12% СН3ОН; газы, состоящие в основном из азота и водорода, выбрасываются в атмосферу. Формальдегид получают также частичным окислением метана. Этот процесс проводят в присутствии катализатора (смесь фосфата алюминия и окиси меди) при температуре 460 °С. При окислении метана образуются помимо формальдегида и другие продукты ре акции, например, НСООН, С02, СО, Н2, поэтому нз реакционной смеси формальдегид выделяют конденсацией или поглощением водой с последующим его выделением. Из окиси углерода и водорода под давлением 2—15 МПа и при температуре 160—450 °С получают также углеводроды парафинового ряда. В зависимости от условий процесса (температуры, давления), состава смеси, катализатора, образуются твердые, жидкие и газообразные углеводороды: 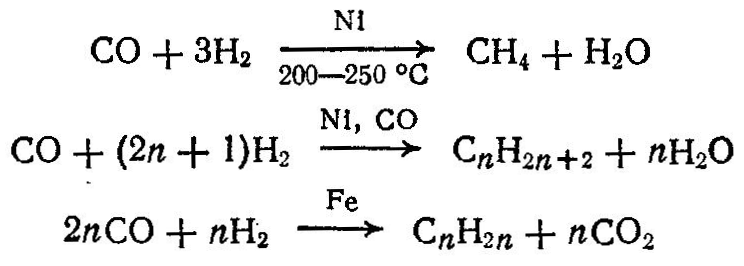
Сырьем для синтеза многих органических продуктов служат предельные углеводороды. Широкое применение из методов переработки предельных углеводородов находит окисление, хлорирование, сульфирование, сульфохлорирование и др. В зависимости от условий процесса при окислении углеводородов получают спирты, альдегиды, кислоты, СО, Н2 и др. Окислением низших парафинов в газовой фазе получают формальдегид, метиловый спирт, ацетальдегид: 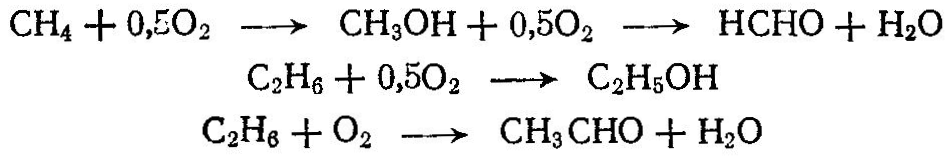 При окислении парафиновых углеводородов С15—-С30 кислородом воздуха получают жирные кислоты, высшие спирты, моющие и поверхностно-активные вещества: 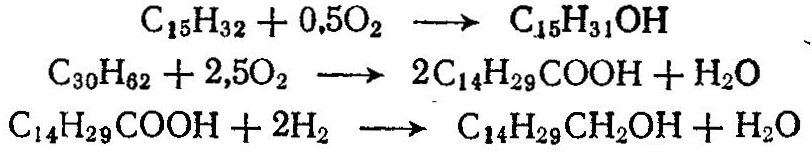 Окислением нафтеновых углеводородов, например циклогексана, получают циклогексанол C6H12О, циклогексанон С6Н10О, адипиновую кислоту НООС—(СН2)4—СООН. Хлорированием предельных углеводородов получают различные хлорзамещенные про дукты, используемые далее для производства высокомолекулярных соединений (хлористый винил, хлоропрен, тетрафторэтилен и др.), полупродуктов органического синтеза (хлористые метил, этил, аллил и бензил, хлорбензол и др.), а также применяемые в качестве растворителей (хлористый метилен, ССЦ и др.), хладоагентов (хлороформ, хлористый этил и др.), для борьбы с вредителями сельского хозяйства, в качестве смазочных масел и т. д. Хлорированию подвергают жидкие (парафиновые, нафтеновые и ароматические) и газообразные (метан, этан, пропан и др.) углеводороды. Для получения хлорированных углеводородов применяют термическое, фотохимическое, каталитическое хлорирование и хлорирование, инициируемое радикалами. Термическое хлорирование проводят при нагревании смеси углеводородов и хлора до температуры диссоциации хлора на атомы (250°С). Чем устойчивее углеводород, тем должна быть выше температура хлорирования, так, например, для хлорирования бутана требуется нагревание до 250 °С, а метана — до 400 °С. При фотохимическом хлорировании молекулы хлора диссоциируют под влияием фотонов или кванта энергии, например: Каталитическое хлорирование ведут в присутствии хлоридов металлов переменной валентности (Cu2Cl2, FeCl3, SbCl5). При жидкофазном хлорировании атомы хлора образуются при действии на молекулу С12 продуктов разложения перекиси или азосоединений, вводимых в жидкие углеводороды, например: 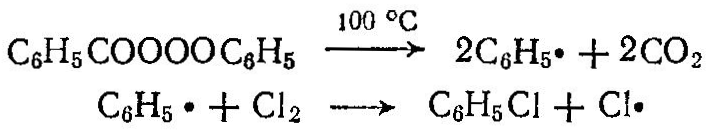 При хлорировании метана образуются хлорсодержащие углево дороды; при этом протекают следующие реакции: 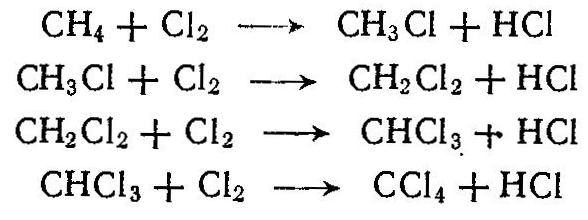 Процесс осуществляют при 400—480 °С в цилиндрических реакторах, футерованных диабазовыми плитками. При хлорировании образуется смесь, содержащая хлористый метил СН3С1, хлористый метилен СН2С12 хлороформ СНС13 и четыреххлористый углерод СС14. Выход этих продуктов [в %(мол.)] зависит от мольного соотношения С12: СН4. Выход товарных продуктов составляет 85—99% от израсходованного метана. При тщательном разделении можно получить продукты 99—99,5%-ной чистоты. Хлорирование этана и пропана проводят при 300—400°С и в избытке углеводорода. При хлорировании этана в основном образуются хлористый этил и небольшое количество дихлорэтана:  При хлорировании пропана образуются монохлориды (2-хлорпропан и 1-хлорпропан) и полихлориды.
Олефины — непредельные углеводороды СnН2n, легко взаимодействующие с хлором, кислородом и водородом, склонны к гидратации и полимеризации. При хлорировании этилена получают дихлорэтан который широко используется как растворитель жиров, каучуков, для получения хлористого винила и др. Хлористый винил образуется по реакции: При хлорировании пропилена получают хлористый аллил и хлориды. Окислением непредельных углеводородов получают окиси углеводородов. Наибольшее применение в органическом синтезе находит окись этилена, которую получают окислением этилена в присутствии серебряных катализаторов: 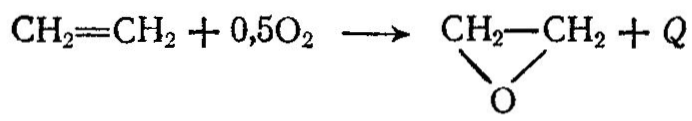 Окись этилена служит сырьем для получения этиленгликоля, этаноламина, эпихлоргидрина, диоксана, ацетальдегида и др. Олефины способны подвергаться гидратации. На этом свойстве основаны процессы получения спиртов (например, этилового спирта С2Н5ОН из этилена), Этиловый спирт—(этанол) кипит при 78,3°С; смесь С2Н5ОН [30% (об.)] с воздухом взрывоопасна; с водой спирт образует азеотропную смесь, содержащую 95,6% С2Н5ОН; кипящую при 78,1 °С. Этиловый спирт широко применяется в пищевой и медицинской промышленности, является компонентом жидкостного ракетного топлива, антифризом и т. д. Особенно широко этанол используется как полупродукт органического синтеза, и, в частности, для получения сложных эфиров, хлороформа, хлораля, ацетальдегида, уксусной кислоты, бутадиена и других продуктов. По объему производства синтетический этиловый спирт занимает первое место среди других органических соединений. Ранее этиловый спирт получали из пищевого сырья — картофельного крахмала и некоторых зерновых культур, однако этот способ связан с большими затратами пищевого сырья. Кроме того, его получают гидролизом древесины (гидролизный спирт). В на стоящее время этанол получают сернокислотной и прямой гидратацией этилена. При сернокислотном способе получения этанола этилен под давлением 1,5—2,5 МПа поступает в абсорбер барботажного типа, орошаемый 97%-ной серной кислотой. Температура в абсорбере 65—75°С. Серная кислота в этом процессе является катализатором и реагентом. Этилен взаимодействует с серной кислотой с образованием моноэтилсульфата C2H50S03H и диэтилсульфата (C2H50)2S02 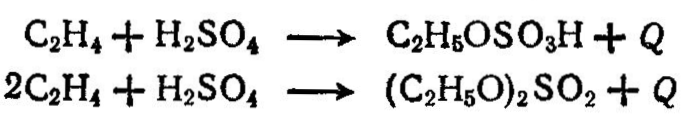 Газы, не поглощенные в абсорбере, проходят водяной и щелочной скрубберы и далее могут быть использованы как топливо. Этилсульфаты и серная кислота из абсорбера поступают в гидролизер, в который подается вода. В гидролизере при давлении 1 МПа и температуре 70—90 °С происходит гидролиз этил- сульфатов Пары спирта и воды далее проходят холодильник, где они конденсируются; конденсат поступает в ректификационную колонну 5 для разгонки и очистки от примесей. Разбавленная кислота (50%) выводится из гидролизера, направляется на концентрирование и снова возвращается в процесс. При ректификации концентрация этилового спирта достигает 95—96%. По этому способу из 1 т этилена получают 1,2 т этанола и около 100 кг этилового эфира. Синтез этанола прямой гидратацией этилена, как правило, проводят в паровой фазе в присутствии катализатора — ортофосфорной кислоты (35—40% Н3РО4), которой пропитывают алюмосиликаты, силикагель. Реакция взаимодействия этилена с водой обратима и протекает с выделением тепла: следовательно, процесс желательно проводить при невысоких температурах. Однако степень превращения этилена в этанол лимитируется скоростью реакции и активностью катализатора. На практике процесс ведут при температуре 280—290 °С. Повышение давления сдвигает равновесие в сторону образования этанола, поэтому в системе поддерживают давление около 7—8 МПа. Выход этанола зависит также от моль ного соотношения Н20: С2Н4, времени контакта и объемной скорости. Прямую гидратацию этилена проводят по циклической схеме. Этилен, сжатый компрессором до 7—8 МПа, смешивается с циркуляционным газом и паром высокого давления, после чего проходит теплообменник и трубчатую печь, где смесь нагревается до 280 °С и направляется в контактный аппарат. При прохождении смеси через катализатор образуются пары спирта. Выходящая из контактного аппарата парогазовая смесь охлаждается в теплообменнике. Сконденсировавшиеся пары воды и спирта отделяются от газа в сборнике, откуда спирт-сырец (15—16% С2Н5ОН) поступает на очистку. Непрореагировавший этилен проходит водяной холодильники колонну с насадкой, орошаемую водой для полного извлечения спирта, и поступает на смешение с новой порцией этилена. Метод прямой гидратации этилена по затратам и простоте обслуживания более выгоден, чем сернокислотный. Получение синтетического спирта из этилена позволяет существенно сократить расходы пищевого сырья. Так, 1 т этилена, переработанная на этанол позволяет сэкономить 4 т зерна. |
