Моль. Вещество это любая совокупности атомов и молекул, находящаяся в определенном агрегатном состоянии. Атом
 Скачать 190.34 Kb. Скачать 190.34 Kb.
|
Задача 4.1.6В каком соотношении (моль) смешаны гидрофосфат кальция СаНРО4 и дигидрофосфат кальция Са(НРО4)2, если массовая доля кальция в смеси составляет 20%. Дано: Решение: СаНРО4 1 Пусть х - количество моль СаНРО4, Са(НРО4)2 у - количество моль Са(НРО4)2 , ω (Са) = 20 % тогда массы гидрофосфата и __________________ дигидрофосфата кальция рассчитываем Найти: по формуле m = *M СаНРО4 /Са(НРО4)2 m (СаНРО4) = 136х m (Са(НРО4)2 = 234у 2.Суммарное количество (моль) кальция в солях х+у, масса m (Са) = *M , m (Ca) = (х+у)*40 3. Массовая доля кальция в смеси будет равна ω(Сa)= m(Сa)/ m СaHPO4 + m Сa(HPO4)2 ω (Сa) = 40(х+у) / 136х + 234у = 0,2 Преобразуя это выражение, получаем у/х =1,87, то есть СаНРО4 /Са(НРО4)2 = 1:1,87 4.2 ВЫВОД ФОРМУЛ СОЕДИНЕНИЙХимические формулы отражают количественный и качественный состав соединения. В качестве примера рассмотрим сульфит натрия Na2SO3. Качественный состав показывает, какие элементы образуют соединение: в состав сульфита натрия входят: кислород, сера и натрий. Количественный состав: в этом соединении 2 моль натрия, 1 моль серы и 3 моль кислорода. Задача 4.2.1 В состав соединения входят натрий, фосфор и кислород. Массовые доли элементов составляют: натрия – 34,6 % (в долях – 0,346), фосфора – 23,3 % (в долях – 0,233), кислорода – 42,1 % (в долях 0,421). Определите формулу соединения. Дано: Решение: ω (Na) = 34,6 % 1 . Пусть масса вещества равна 100 г. Тогда по ω (P) = 23,3 % формуле (3) масса натрия, фосфора и ω (O) = 42,1 % кислорода составляют: m(Na)=100*W(Na), m(Na) =100*0,346 =34,6 г _____________ m(P) = 100*W (P) , m(P) = 100*0,233 = 23,3 г. Найти: m(O) = 100*W(O), m(O) = 100* 0,421= 42,1 г. формулу 2. Определяем количество вещества атомных натрия, фосфора и кислорода: (Na) =m(Na)/M, (Na) = 34,6/23 = 1,50 моль. (P) = m(P)/M(P), (P) = 23,3/31 = 0,75 моль. (O) = m (O)/M(O), (O) = 42,1/16 = 2,63 моль. CОКРАЩАЕМ ДО СОТЫХ. 3. Количество вещества натрия относится к количеству вещества фосфора и относится к количеству вещества кислорода как: (Na) : (P) : (O) = 1,50 : 0,75 : 2,63 ДЕЛИМ НА МЕНЬШЕЕ ЧИСЛО. В данном примере: разделим на 0,75 (Na) : (O) : (P) = 1,50/0,75 : 0,75/0,75: 2,63/0,75 = 2 : 1: 3,5 Так как в формулах соединений обычно используют целочисленные коэффициенты, то необходимо умножить это отношение на множитель, так, чтобы получилось целое число. В данном случае, умножаем на 2. (Na) : (P) : (O) = 4 : 2 : 7. Следовательно, формула соединения, Na4P2O7. Задача 4.2.2 Молярная масса соединения азота с водородом равна 32 г/моль. Определите формулу этого соединения, если массовая доля азота в нем составляет 87,5 %. Дано: Решение: M (NХHУ) = 32 г/моль 1. Обозначим х – количество моль азота у - количество моль водорода. ω (N) = 87,5 % 2. Т.к. соединение содержит два элемента, ______________ то массовая доля водорода составляет 12,5% Найти: NхHу (все соединение 100 %, а азота в нем 87,5 %, значит массовая доля водорода равна (100 – 87,5 = 12,5%) 3. Пусть масса вещества равна 100 г. Тогда по формуле (3) масса азота и водорода составляют: m (N) = m * ω (N), m (N) = 100 *0,875 = 87,5 г m (H) = m * ω (H), m (Н) = 100 * 0,125 = 12,5 г 4. Определяем количество вещества атомных азота и водорода (используем формулу 2): (N) = m (N) / M (N), (N) = 87,5 / 14 = 7,29 моль. (H) = m (H) / M (H), (H) = 12,5 / 1 = 12,5 моль. 5. Находим отношение количеств веществ: (N) : (H) = 7,29 : 12,5 ДЕЛИМ НА МЕНЬШЕЕ ЧИСЛО. В данном случае разделим на 7,29. Получаем: (N) : (H) = 7,29 / 7,29 : 12,5 / 7,29 , (N) : (H) = 1 / 2. Следовательно, простейшая формула соединения NH2. Проверим, соответствует ли молярная масса NH2 молярной массе, предложенной в условии задачи. Молярная масса (NH2) = (14+2)=16. Для того, чтобы получить истинную формулу соединения, необходимо все умножить на два. Значит, формула единения – N2H4. Задача 4. 2.3 В состав соли входят: железо, азот, кислород и химически связанная вода. Определите формулу соли, если массовая доля железа составляет 13,86 %, массовая доля азота –10,4%, кислорода – 35,64%, воды – 40,1%. Дано: Решение: ω (Fe) = 13,86 % 1. Пусть масса соли равна 100 г ω (N) = 10,4 % Подставляя это значение в формулу 4 ω (O) = 35,64% ω (Fe) = m(Fe) /100 *100% = 13,86% ω (H2O) = 40,1% получаем массу железа - m(Fe) = 13,68г, _______________ Аналогично определяем массу азота Найти: формулу кислорода и воды: m (N) = 10,4 г m (O) = 35,64 г m (H2O) = 40,1г 3.Определим количества вещества железа, азота, кислорода и воды соответственно, используя формулу (2): (Fe) : (N) : (O) : (H2O) 13,86 /56 : 10,4 /14 : 35,64/16 : 40,1/18 4. Получим соотношение: (Fe): (N): (O): (H2O) 0,25 : 0,74: 2,23 : 2,23. Разделим на наименьшее значение, получаем (Fe) : (N) : (O) : (H2O) 1 : 2,96 : 8,92 : 8,92 округляем: 1 : 3 : 9 : 9 Формула соли – Fe N3О9(H2O)9 . Преобразуя, получаем: Fe(NО3)3 *9H2O Задача 4.2.4 Выведите формулу кристаллогидрата сульфата натрия, если известно, что массовая доля кристаллизационной воды в нем равна 55,9 %. Дано: Решение ω (*х H2O)=55,9 % 1. Массовая доля воды в кристаллогидрате равна: ω(ХН2O)=m ((х Н2O)/m (Na2SO4*хH2O)=0,559 _______________ 2. Возьмем 1 моль кристаллогидрата, тогда Найти: m = 1*М (Na2SO4 *хН2О) = (142+ 18х) г Na2 SO4 *х H2 O ? m =М (х H2O)=(18*х) г Подставляем в формулу (7) значения и получаем уравнение: 0,559=18х/142+18х, решая его, получаем х=10 Na2SO4*10H2O- это глауберова соль. Задача 4.2.5 Массовая доля кислорода в кристаллогидрате нитрата железа (III) равна 0,713.Установите формулу кристаллогидрата. Дано: Решение: Fe (NO3)3*x H2O 1. Пусть количество моль Fe(NO3)3*xH2О = 1, ω(O)в кристал.=0,713 тогда масса кристаллогидрата по формуле: __________________ m = *M Найти формулу m (Fe(NO3)3*x H2O) = 242+ 18х кристаллогидрата - ? 2. Количество моль кислорода в кристаллогидрате: 9+х, тогда массу кислорода рассчитываем по формуле: m (О) = *M m (О) = (9+х)*16 г 3. Массовая доля кислорода в кристаллогидрате: w (О) = m (О) / m Fe(NO3)3 *H2O w (О) = (9+х)*16/242+ 18х Решая это уравнение, находим х = 9. Значит, формула кристаллогидрата - Fe(NO3)3*9 H2O I. 4. Kimyoviy formula bo’yicha hisoblash a) Moddalardagi elementlarning massa nisbatini aniqlash K2SO4 dagi elementlarning massa nisbatini toping. Yechish: 1) kaliy sulfat tarkibidagi har bir atomning мольekulyar massasini topamiz. K = 2*39 = 78 S = 32 O = 4*16 = 64 2) endi har bir element atomining massasini eng kichik massaga ega bo’lgan element atomi massasiga bo’lib chiqsak massa nisbat kelib chiqadi. 3) eng kichik massaga ega bo’lgan element oltingugurt K = 78:32 = 2,4375 S = 32:32 = 1 O = 64:32 = 2 4) demak massa nisbati 2,4375:1:2 nisbatda ekan. N2O – azot(I)-oksid, NO- azot(II)-oksid, NO2- azot(IV)-oksid, N2O3 – azot(III)-oksid, N2O5 – azot(V)-oksid, FeO- temir (II)-oksid, Fe2O3 - temir (III)-oksid, Fe3O4 - temir qo’shoksid, H2Cr2O7 – biaxromat kislota, H2CrO4- xromat kislota, H3PO4 – ortofosfat k-ta, H3PO3- fosfit kislota, HPO3- metafosfat k, H4P2O7-pirofosfat k, Cr(OH)2- xrom (II)-gidroksid, Cr(OH)3- xrom(III)- gidroksid, Fe(OH)2- temir (II) gidroksid, Fe(OH)3- temir(III)- gidroksid, NaHCO3- natriy gidrokarbonat (ichimlik soda), CuSO4- mis(II)-sulfat, KMnO4- kaliy permanganat, K2Cr2O7- kaliy bixromat, (NH4)2Cr2O7- ammoniy bixromat b) Moddalarning foiz tarkibini hisoblash K2SO4 ni foiz tarkibini hisoblang. Yechish: 1) kaliy sulfatning мольekulyar massasini topamiz. Mr = (2*39)+32+(4*16) = 174 ga teng ekan. 2) endi foiz tarkibini topish formulasiga qo’yamiz. Buning uchun har bir element massasini shu birikma мольekulyar massasiga bo’lib 100 ga ko’paytirsak foiz tarkibi kelib chiqadi. C % = 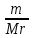 : shu formulaga qo’yamiz. : shu formulaga qo’yamiz.C%Kaliy = 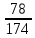 ∙ 100 = 44,83 % kaliy ∙ 100 = 44,83 % kaliyC%oltingugurt = 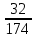 ∙ 100 = 18,39 % S ∙ 100 = 18,39 % SC%kislorod = = 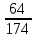 ∙ 100 = 36,78 % O2 ∙ 100 = 36,78 % O23) demak foiz tarkibi 44,83 % K: 18,39 % S: 36,78 % O2 N2O – azot(I)-oksid, NO- azot(II)-oksid, NO2- azot(IV)-oksid, N2O3 – azot(III)-oksid, N2O5 – azot(V)-oksid, FeO- temir (II)-oksid, Fe2O3 - temir (III)-oksid, Fe3O4 - temir qo’shoksid, H2Cr2O7 – bixromat k H2CrO4- xromat kislota, H3PO4 – ortofosfat k-ta, H3PO3- fosfit kislota, HPO3- metafosfat k, H4P2O7-pirofosfat k, Cr(OH)2- xrom (II)-gidroksid, Cr(OH)3- xrom(III)- gidroksid, Fe(OH)2- temir (II) gidroksid, Fe(OH)3- temir(III)- gidroksid, NaHCO3- natriy gidrokarbonat (ichimlik soda), CuSO4- mis(II)-sulfat, KMnO4- kaliy permanganate, K2Cr2O7- kaliy bixromat, (NH4)2Cr2O7- ammoniy bixromat I. 5. Moddalar tarkibidagi elementlar valentligini aniqlash N2O – azot(I)-oksid, NO- azot(II)-oksid, NO2- azot(IV)-oksid, N2O3 – azot(III)-oksid, N2O5 – azot(V)-oksid, FeO- temir (II)-oksid, Fe2O3 - temir (III)-oksid, Fe3O4 - temir qo’shoksid, H2Cr2O7 – bixromat k, H2CrO4- xromat kislota, H3PO4 – ortofosfat k-ta, H3PO3- fosfit kislota, HPO3- metafosfat k, H4P2O7-pirofosfat k, Cr(OH)2- xrom (II)-gidroksid, Cr(OH)3- xrom(III)- gidroksid, Fe(OH)2- temir (II) gidroksid, Fe(OH)3- temir(III)- gidroksid, NaHCO3- natriy gidrokarbonat (ichimlik soda), CuSO4- mis(II)-sulfat, KMnO4- kaliy permanganate, K2Cr2O7- kaliy bixromat, (NH4)2Cr2O7- ammoniy bixromat I.7. Kimyoviy tenglamalar va ularga koeffissiyentlar tanlash. Na+O2→ Na2O K+O2→K2O C+O2→CO Cu+O2→ CuO Al+O2→Al2O3 P+O2→P2O3 P+O2→P2O5 NH3 + O2 → NO +H2O CH4 +O2 → CO2+ H2O PH3 +O2 → P2O5 + H2O SiH4 + O2 → SiO2 + H2O CrO+O2→ Cr2O3 SO2+O2→ SO3 Fe(OH)3→ Fe2O3 + H2O Cr(OH)3→ Cr2O3+ H2O H3AlO3  Al2O3 + H2O Al2O3 + H2OH3CrO3→ Cr2O3+ H2O P2O5 + H2O → H3PO4 Cl2O + H2O → HClO Cl2O3 + H2O → HClO2 Cl2O5 + H2O → HClO3 Cl2O7 + H2O → HClO4 Cl2O7 + NaOH → NaClO4+ H2O SO3+ NaOH → Na2SO4 + H2O N2O5+ NaOH → NaNO3+ H2O P2O5 + Ca(OH)2 → Ca3(PO4)2+ H2O Na2O+H2O→ NaOH K2O+ H2O→ KOH Na2O+HCl→ NaCl + H2O CaO+ HCl → CaCl2 + H2O Na2O+H2SO4→ Na2SO4 + H2O Na2O+HNO3→ NaNO3 + H2O CaO+ HNO3 → Ca(NO3)2 + H2O Na2O+P2O5→ Na3PO4 CaO+ P2O5→ Ca3(PO4)2 Al2O3 +HCl → AlCl3 + H2O Al2O3 + H2SO4→ Al2(SO4)3+ H2O Na + H2O → NaOH +H2 HCl + Na2S → NaCl + H2S K + H2O → KOH +H2 Mg + H2O → Mg(OH)2 +H2 Ca + H2O → Ca(OH)2 +H2 Na2O + H2O → NaOH MgH2+ H2O → Mg(OH)2 +H2 CaH2+ H2O → Ca(OH)2 +H2 CuSO4+ KOH → Cu(OH)2+ K2SO4 MnCl2+ KOH → Mn(OH)2 +KCl Fe(NO3)2+ KOH → Fe(OH)2 + KNO3 CrBr2+ KOH → Cr(OH)2+ KBr Al(NO3) + KOH → Al(OH)3+ KNO3 Ba(OH)2 +HCl → BaCl2+ H2O N2O5+ H2O → HNO3 SO2 + KOH → K2SO3 + H2O CO2 + KOH →K2CO3 + H2O P2O5 + KOH → K3PO4 + H2O Cl2O + KOH → KClO + H2O Cl2O3 + KOH → KClO2 + H2O Cl2O5 + NaOH → NaClO3+ H2O H2 + Cl2→ HCl NaCl + H2SO4→ Na2SO4 +HCl FeCl2 + H2SO4→ FeSO4 + HCl Al2S3 + H2SO4→ Al2(SO4)3 +H2S FeS + HCl → FeCl2+ H2S Na2S + HCl → NaCl + H2S Al2S3 + HCl → AlCl3 + H2S Na2SiO3 + HCl → NaCl + H2SiO3 Al + HCl → ACl3+ H2 Cu(OH)2 + HCl → CuCl2 + H2O Cr(OH)2 + HCl → CrCl2 +H2O Fe(OH)3 + HCl → FeCl3+H2O Cr(OH)3 + HCl → CrCl3+H2O Cu(OH)2 + H2SO4→ CuSO4+H2O Fe(OH)3 + H2SO4→ Fe2(SO4)3+H2O Cu(OH)2 + HNO3→ Cu(NO3)2+H2O Fe(OH)3 + HNO3→ Fe(NO3)3+H2O H2SO4 + Ba(NO3)2→ BaSO4 + HNO3 H3PO4 + CaCl2→ Ca3(PO4)2+ HCl HCl + Na2CO3→ NaCl +H2O + CO2 |
