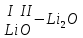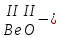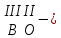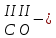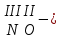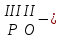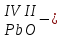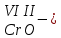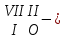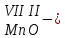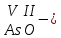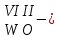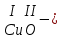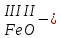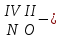Моль. Вещество это любая совокупности атомов и молекул, находящаяся в определенном агрегатном состоянии. Атом
 Скачать 190.34 Kb. Скачать 190.34 Kb.
|
|
с растворимыми кислотами, с растворимыми основаниями в результате реакции образуются соль и вода CuO + Н2SO4 CuSO4 + H2O CO2+Ca(OН)2CaCO3 + Н2О 4. Менее летучие оксиды вытесняют более летучие из их солей: K2CO3 + SiO2 K2SiO3 + CO2 К числу амфотерных оксидов относят: оксиды металлов с валентностью, равной трем, например: оксид алюминия -Al2O3, оксид хрома (III) - Cr2O3, оксид железа (III) - Fe2O3, а также несколько исключений, в которых металл двухвалентен, например: оксид бериллия BeO, оксид цинка ZnO, оксид свинца (II) – PbO.. Амфотерные оксиды обладают двойственной природой: они одновременно способны к реакциям, в которые вступают как основные и как кислотные оксиды Докажем амфотерный характер оксида алюминия. Приведем уравнения реакций взаимодействия с соляной кислотой и щелочью (в водном растворе и при нагревании). При взаимодействии оксида алюминия и соляной кислоты, образуется соль - хлорид алюминия. В этом случае оксид алюминия выступает в роли основного оксида. Al2O3 + 6HCl 2AlCl3 + 3H2O как основный В водном растворе происходит образование комплексной соли - тетрагидроксоалюмината натрия: Al2O3 + 2NaOH + 3H2O 2Na[Al(OH)4] тетрагидроксоалюминат натрия как кислотный При сплавлении со щелочами образуется метаалюминаты. Представим молекулу гидроксида алюминия Al(OH)3 в форме кислоты, т.е. на первом месте запишем все атомы водорода, на втором кислотный остаток: Al(OH)3 H3AlO3 - алюминиевая кислота Для трехвалентных металлов из формулы кислоты вычтем 1 Н2О, получив метаалюминиевую кислоту: H3AlO3 - Н2 О HAlO2 - метаалюминиевая кислота сплавление Al2O3 +2 NaOH 2NaAlO2 + Н2О метаалюминат натрия как кислотный МЕТОДЫ ПОЛУЧЕНИЯ ОКСИДОВ: 1. Взаимодействие простых веществ с кислородом: 4Al + 3O2 2Al2O3 S + O2 SO2 2. Горение или обжиг сложных веществ: CH4 + 2O2 CO2 + 2H2O 2ZnS + 3O2 2SO2+ 2ZnO Разложение при нагревании нерастворимых гидроксидов: Cu(OH)2 CuO + H2O H2SiO3 SiO2 + H2O 4. Разложение при нагревании средних и кислых солей: CaCO3 CaO + CO2 2КHCO3K2CO3 + CO2 +H2O 4AgNO3 4Ag + 4NO2+ O2 Найдите формулу оксидов по валентьносты элементов (1-20)
ГИДРОКСИДЫ Гидроксиды подразделяют на три группы: основания, кислоты и амфотерные гидроксиды (проявляющие свойства, как оснований, так и кислот). ОСНОВАНИЕ – это сложное вещество, состоящее из атомов металла и одной или нескольких гидроксогрупп (– ОН). Например: гидроксид натрия - NaOH, гидроксид бария Ва(ОН)2. Количество гидроксогрупп в молекуле основания равно валентности металла. КИСЛОТА – это сложное вещество, которое состоит из атомов водорода, способных замещаться на атомы металла, и кислотного остатка. Например: серная кислота – H2SO4, фосфорная кислота - Н3РО4. Валентность кислотного остатка определяется количеством атомов водорода. В химических соединениях сохраняется валентность кислотного остатка (см. таблицу 1). ТАБЛИЦА 1 ФОРМУЛЫ НЕКОТОРЫХ КИСЛОТ И КИСЛОТНЫХ ОСТАТКОВ
По растворимости в воде гидроксиды делятся на две группы: растворимые (например, КОН, H2SO4) и нерастворимые (H2SiO3, Сu(OH)2). Растворимые в воде основания называются щелочами. ХИМИЧЕСКИЕ СВОЙСТВА РАСТВОРИМЫХ ГИДРОКСИДОВ ________________________________________________________ ЩЕЛОЧИ КИСЛОТЫ ________________________________________________________ 1. Действие на индикаторы малиновый фенолфталеин бесцветный синий лакмус красный желтый метиловый оранжевый красный 2. Взаимодействуют друг с другом, с образованием соли и воды 2KOH + H2SO4 K2SO4 + 2H2O 3. Взаимодействуют с оксидами - кислотными и амфотерными основными и амфотерными с образованием соли и воды 2NaOH+SO2Na2SO3+H2O 2HNO3 + CuOCu(NO3)2+H2O кислотный оксид основной оксид сплавление 2NaOH+ ZnO Na2ZnO2 +H2O 2HNO3 +ZnO Zn(NO3)2 +H2O амфотерный оксид амфотерный оксид раствор ZnO+2NaOH+H2ONa2[Zn(OH)4] тетрагидроксоцинкат натрия Взаимодействуют с растворимыми солями (признак реакции - образование осадка или газа): 2KOH+CuCl2Cu(OH)2↓+2KCl Н2SO4р-р+BaCl2р-рBaSO4↓+ 2HCl 2НCl+K2CO32KCl+ H2CO3 ↓ ↓ CO2 H2O H2SO4(концентр.)+KCl(тверд.)K2SO4+HCl 5. Взаимодействуют с металлами Некоторые металлы (Al, Zn, Be) А) Разбавленные кислоты реагируют с растворами реагируют с металлами, щелочей, образуя комплексные стоящими до водорода всоли: раствор 2Al+2NaOH+6H2O 2Na[Al(OH)4] + 3H2 в электрохимическом ряду напряжения металлов: KNaMgAlZnFeNiSnPb Н тетрагидроксоалюминат натрия При этом образуется средняя раствор соль и выделяется водород: 2Zn+2NaOH+2H2O Mg + 2HCl MgCl2 + H2 Na2[Zn(OH)4]+H2 Б) с металлами, стоящими после водорода разбавленные кислоты в расплаве не реагируют 2Al+2NaOH+2H2O В) о взаимодействии с 2NaAlO2 + 3H2 концетрированными кислотами алюминат натрия кислотами см. далее в расплаве 2Zn+2NaOHNa2ZnO2 + H2 6. Некоторые щелочи способны реагировать с неметаллами: 6 KOH+ 3Cl2 KClO3+5KCl+3H2O 2 NaOH+Si +H2ONa2SiO3+2H2 6 KОH+3S2K2S+K2SO3+3H2O ВЗАИМОДЕЙСТВИЕ МЕТАЛЛОВ С СЕРНОЙ И АЗОТНОЙ КИСЛОТАМИ Рассмотрим, как реагируют металлы с разбавленными концентрированными азотной HNO3 и серной Н2SO4 кислотами. ОСОБЕННОСТИ СЕРНОЙ КИСЛОТЫ Разбавленная серная кислота растворяет металлы, стоящие в электрохимическом ряду напряжения металлов до водорода. H2SO4 + Fe FeSO4 + H2 Металлы, стоящие в электрохимическом ряду напряжений после водорода, с разбавленной серной кислотой не реагируют. Концентрированная кислота при обычной температуре со многими металлами не реагирует. Поэтому безводную серную кислоту можно хранить в железной таре. Однако при нагревании концентрированная кислота реагирует почти со всеми металлами (кроме Pt, Au). При этом кроме соли и воды, возможно образование сероводорода, серы, или оксида серы (IV). Образование последних продуктов зависит от положения металл в электрохимическом ряду напряжений и от концентрации кислоты. Если металл активный (Li ,K, Na, Ca, Ba, Mg), то наиболее вероятно образование сероводорода: 5H2SO4 + 4Mg 4MgSO4 + H2S + 4H2O При взаимодействии металла средней активности – наиболее вероятно образование серы: 4H2SO4 + 2Сr Сr2(SO4)3+S + 4H2O При взаимодействии неактивного металла (Cu, Hg, Ag) – образуется оксид серы (IV): 2H2SO4+CuCuSO4 +SO2+2H2O ОСОБЕННОСТИ АЗОТНОЙ КИСЛОТЫ При обычной температуре азотная концентрированная кислота не взаимодействует с алюминием, хромом и железом. Она переводит их в пассивное состояние. Азотная кислота не реагирует с платиной, таллием, золотом, вольфрамом. Платина и золото растворяются в “царской водке” – смеси 3 объемов концентрированной соляной кислоты и 1 объема концентрированной азотной кислоты: Au +3HCl +3HNO3AuCl3 + 3NO2+ 3H2O Pt +4HCl +4HNO3PtCl4 + 4NO2+ 4H2O HNO3 ___________________/_____________________ разбавленная концентрированная ______/________ _____________/__________________ с щелочно- с другими не действует со щелочноземельными с другими земельными тяжелыми на металлы: металлами тяжелыми металлами металлами Au, Pt, Al металлами +Zn, Fe Fe, Cr, NH4NO3 NO ≠ N2O NO2 При взаимодействии азотной кислоты с металлами кроме соли и воды возможно образование различных оксидов азота N2O, NO, NO2, а также азота N2 и аммиака NH3. Образование последних, зависит от того какова концентрация кислоты, и какой металл подвергается воздействию. При действии разбавленной кислоты на активный металл, стоящий в ряду напряжений металлов до алюминия, а также цинк и железо, первоначально образуется аммиак, который, реагируя с азотной кислотой, образует нитрат аммония NH4NO3: NH3 + HNO3р-р NH4NO3 Итоговое уравнение имеет вид: 4Zn + 10HNO3р-р 4Zn(NO3)2 + NH4NO3 +3H2O При взаимодействии неактивного металла, стоящего в ряду напряжений после водорода, – образуется оксид азота (II) 3Cu + 8HNO3 р-р3Cu(NO3)2 + 2NO +4H2O При действии концентрированной кислоты на неактивные металлы, как правило, образуется оксид азота (IV) Cu + 4HNO3 конц.Cu(NO3)2 + 2NO2 +2H2O При действии концентрированной кислоты на активные металлы, как правило, образуется оксид азота (I) 8Na + 10HNO3 конц.8NaNO3 + N2O +5H2O НЕРАСТВОРИМЫЕ ГИДРОКСИДЫ Нерастворимые основания образованы металлами, стоящими в ряду активности, начиная с магния: Mg(OH)2↓, Fe(OH)3↓ Cu(OH)2↓ СuOH↓, Fe(OH)2↓ Сo(OH)2↓ осадок осадок осадок осадок осадок осадок белого коричневого синего оранжевого зеленого розового цвета цвета цвета цвета цвета цвета Рассмотрим химические свойства и способы получения нерастворимых гидроксидов. |