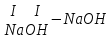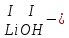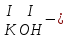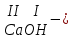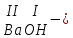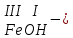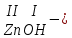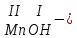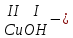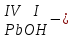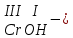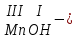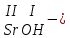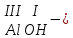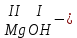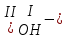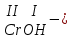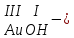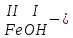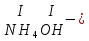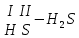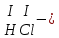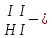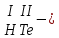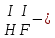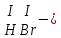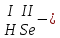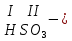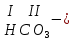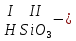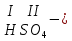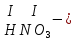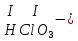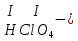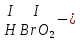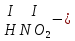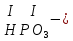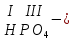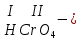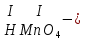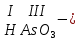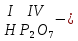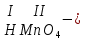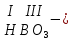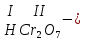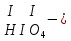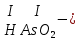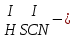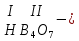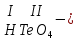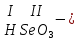Моль. Вещество это любая совокупности атомов и молекул, находящаяся в определенном агрегатном состоянии. Атом
 Скачать 190.34 Kb. Скачать 190.34 Kb.
|
|
ХИМИЧЕСКИЕ СВОЙСТВА НЕРАСТВОРИМЫХ ГИДРОКСИДОВ ______________________________________________________ ОСНОВАНИЙ КИСЛОТ _____________________________________________________ 1. Не изменяют окраски индикаторов 2. Вступают в реакции нейтрализации 2Al(OH)3+3H2SO4Al2(SO4)3+6H2O H2SiO3 +2KOHK2SiO3+ 2H2O 3. Разлагаются при нагревании Сu(OH)2 СuO+H2O H2SiO3 SiO2 +H2O АМФОТЕРНЫЕ ГИДРОКСИДЫ Амфотерный характер проявляют некоторые соединения, в которых металл имеет валентность, равную трем: Al(OH)3, Cr(OH)3, Fe(OH)3, а также в качестве исключения, гидроксиды, содержащие двухвалентные металлы: Be(OH)2 , Zn(OH)2 , Pb(OH)2. Амфотерность – это способность проявлять кислотные или основные свойства в зависимости от условий реакции, т.е. вступать в химические реакции и с кислотами и со щелочами. Например, гидроксид цинка при взаимодействии с соляной кислотой ведет себя как основание, при взаимодействии со щелочью как кислота: Zn(OH)2 + 2HCl ZnCl2 + 2HCl как основание раствор Zn(OH)2 + 2NaOH Na2[Zn(OH)4] тетрагидроксоцинкат натрия как кислота расплав Zn(OH)2+2NaOH Na2ZnO2+ 2Н2О как кислота Рассмотрим, как можно получить основания, кислоты и амфотерные гидроксиды. ОСНОВНЫЕ СПОСОБЫ ПОЛУЧЕНИЯ ОСНОВАНИЙ КИСЛОТ 1.Взаимодействие активного 1. Взаимодействие неметалла металла с водой: с водородом (для получения 2Na + 2H2O 2NaOH + H2 бескислородной кислоты) H2 + Cl2 2НCl Малоактивные и неактивные металлы с водой не реагируют: Cu +H2О ≠ 2. Взаимодействие оксидов с водой: основных кислотных в реакцию вступают только P2O5 +3H2O 2H3PO4 те оксиды, в состав которых SiO2 + H2O≠ входят активные металлы- Li, Na, K, Rb, Cs, Fr, Ba, Ca) – K2O + H2O 2KOH CuО +H2О ≠ 3. Взаимодействие гидроксидов с растворимыми солями (признак реакции – образование осадка или газа) 2KOH + CuCl2Cu(OH)2↓ + 2KCl H2SO4 + Ba(NO3)2 BaSO4↓ + 2HNO3 2НCl + K2CO32KCl + H2CO3 ↓ ↓ CO2 H2O 4. Электролиз водных растворов солей электролиз электролиз 2NaCl +2H2O2NaOH +H2 +Cl2 2Cu(NO3)2 + 2H2O2Cu+4HNO3 +O2 5. Карбиды, нитриды, фосфиды разлагаются водой: Al4C3+ 12H2O4Al(OH) 3 + 3CH4 Ca3P2 + 6H2O3Ca(OH)2 + 2PH3 Mg3N2 + 6H2O3Mg(OH)2 + 2NH3 Найдите формулу гидроксидов (1-20)
Записать по названию основание эмпирических формуль (1-38)
Составьте формуль кислоты (1-31)
Записать эмпирических формуль по названию кислоть (1-32)
СОЛИ СОЛЬ – это сложное вещество, состоящее из атомов металла и кислотного остатка. Соли можно разделить на следующие типы: средние, кислые, основные, комплексные, двойные, смешанные. Двойные соли содержат два разных металла и кислотный остаток. Например: KAl(SO4)2 – двойной сульфат калия-алюминия (алюмокалиевые квасцы). В состав комплексных солей входит центральный атом и связанные с ним молекулы, и ионы - лиганды. Центральный атом и лиганды образуют комплекс, который при записи заключают в квадратные скобки. Например: Na[Al(OH)4] – тетрагидроксоалюминат натрия. Смешанные соли содержат один металл и кислотные остатки различных кислот. Например: Ca(OCl)Cl – соль содержит металл и кислотные остатки двух кислот HCl и HClO. СОЛИ __________________________________________________ средние кислые основные Na2СO3 KHS CuOHCl карбонат натрия гидроcульфид калия гидроксохлорид меди (II) Рассмотрим подробнее свойства и получение средних, кислых и основных солей. ТИПЫ СОЛЕЙ __________________________________________ кислые средние основные образуются при образуются при, образуются при взаимодействии полном взаимодействии щелочи и избытка, замещении кислоты и избытка, кислоты, содержащей атома водорода щелочи, содержащей не менее 2 атомов на металл не менее двух (-ОН) водорода гидроксильных групп в своем составе Ва(ОН)2 +2H2SO4 Ba(OH)2 +H2SO4 2Ba(OH)2 +H2SO4 Ba(НSO4)2 +2H2О BaSO4 +2Н2О (BaOH)2SO4 +2Н2О гидросульфат бария сульфат бария гидроксосульфат бария Приведем примеры перевода средней соли в кислую, и наоборот. Чтобы перевести среднюю соль в кислую нужно добавить ту кислоту, чей кислотный остаток входит в данную соль. Например: К2SO4 + H2SO4 2KHSO4 Чтобы перевести кислую соль в среднюю нужно добавить щелочь (образованную металлом, входящим в состав соли). Например: KHCO3 + KOH K2CO3 + H2O При переводе средних солей в основные производят противоположные действия: теперь для перевода средней соли в основную нужно добавлять основание (то основание, в cостав которого, входит металл, входящий в данную соль). Например: CaCl2 + Ca(OH)2 2CaOHCl Чтобы перевести основную соль в среднюю нужно добавить кислоту (ту, чей кислотный остаток находится в составе основной соли). Например: CaOHCl + HCl CaCl2 + H2O ХИМИЧЕСКИЕ СВОЙСТВА СРЕДНИХ СОЛЕЙ
с солью в том случае, если он более активен, чем металл, входящий в состав соли) Fe+ CuSO4 Сu + FeSO4 Cu + FeSO4 ≠
образование осадка, газа или воды): BaCl2 + K2SO4 BaSO4↓+ 2KCl
реакции - образование осадка, газа или воды): со щелочью: CuCl2 + 2KOH 2KCl + Cu(OH)2↓ с кислотой: Na2SO3 + 2HCl 2NaCl + H2SO3 H2O SO2 ↑
хлораты) разлагаются при нагревании: 2KHCO3K2CO3 + CO2 +H2O CaCO3 CaO + CO2 2KClO32KCl+3O2 2KNO32KNO2+O2 2Cu(NO3)22CuO + O2 +4NO2 2AgNO32Ag + 2NO2 + O2
соли, состав которых, входит химически связанная вода: CuSO4 + 5H2O CuSO4 * 5H2O (кристаллогидрат) белый порошок голубой УПРАЖНЕНИЯ 1. Приведите формулы следующих соединений: фосфат кальция, оксид рубидия, уксусная кислота, оксид молибдена (VI), фтороводородная кислота, нитрит алюминия, сернистая кислота, гидросиликат калия, оксид меди (I), карбонат серебра, хлорид железа (II), оксид углерода (II), гидроксид цинка, нитрат хрома (II), соляная кислота, фосфорная кислота, сульфит магния, оксид селена (VI), сульфид железа (III), гидрокарбонат франция, кремневая кислота, ацетат натрия, азотистая кислота, оксид марганца (VII). 2. Приведите названия следующих соединений: Mn2O7, MgOHJ, ВaO, НNO2, LiOН, Ba(HS)2, Al(ОН)3, N2O5, NiS, AlOHSO4, SiO2, Be(ОН)2, CuOH , K2HPO4, BaCO3, Cl2O3 3. Определите класс неорганических веществ (кислотный оксид, основный оксид, амфотерный оксид, несолеобразующий оксид, кислородсодержащая кислота, бескислородная кислота, щелочь, нерастворимое основание, амфотерный гидроксид, кислая соль, основная соль, средняя соль, комплексная соль): K2Cr2O7, H2Se, MnO, Be(OH)2, H2CrO4, (CuOH)2SO4, Fe(OH)2, KMnO4, Al2O3, NаH2PO4, KAlO2, Na2[Zn(OH)4], KHTeO4, CsOH, CO, Ва(OH)2, H2SO3, NO, Zn(OH)2, HF, CuO, Ca(OH)2, K2S, NaHSO3, Ba3(PO4)2, BaOHBr, Mn2O7, Ba(HS)2, Сr(ОН)3. 4. Для перечисленных ниже оксидов написать формулу соответствующего гидроксида и указать его характер: MnO, Al2O3, CO2, ZnO, SO3, N2O5, CaO, Fe2O3. 5. Для перечисленных ниже гидроксидов написать формулу соответствующего оксида и указать характер оксида: H2SO3, Be(OH)2, CsOH, H3PO4, Fe(OH)2, HClO4, HNO2
реагировать серная кислота: MnO, Al2O3, CO2, ZnO, SO3, N2O5, CaO, Fe2O3, H2SO3, Bа(OH)2, CsOH, H3PO4, Fe(OH)2, HClO4, K2S, Na2SO3, NaNO3, BaCl2, Cu, Fe, CuSO4. Приведите уравнения реакций. 7. Из предложенных в задании № 6 веществ выбрать те, которые взаимодействуют с гидроксидом натрия. Приведите уравнения реакций. 8. Выбрать из предложенных веществ те, с которыми может реагировать сульфат меди (II): BaCl2, HCl, Fe, Al(OH)3, N2O5, K2S, Ag, CsOH, ZnO, H3PO4. Приведите уравнения реакций. 9. Из каких веществ в одну стадию можно получить а) оксид (кроме воды): сера, хлорид натрия, карбонат кальция, серная кислота, литий, медь, гидроксид калия, сульфид цинка, кремневая кислота, серная кислота б) гидроксид: -медь, оксид железа (II), оксид бария, оксид азота (I), оксид кремния (IV), карбонат магния, натрий, сульфат цинка, оксид азота (V), хлорид калия. 10. Приведите 10 способов получения средних солей. 11. Осуществите превращения: а) KKOH K2SO4 KHSO4 K2SO4 KOH K2CO3 б) Al AlCl3 Al(OH)3 K[Al(OH)4] AlCl3 в) Zn K2[Zn(OH)4] Zn(OH)2 ZnO Zn г) CaO CaCO3 Ca(HCO3)2 CaCO3 CO2 д) Р P2O5 Ca3(PO4)2 H3PO4K2 HPO4 K3PO4 +O2 +HNO3 +NaOH t е) Cu Х1 Х2 Х3 Х4 + Х5 +O2 +H2O +NaOHизбыток +FeCl3 ж) P Х1 Х2 Х3 Х4 ↓ + Х5 Сa3(PO4)2 12. Напишите уравнения четырех возможных реакций между этими веществами в водном растворе, не повторяя пары веществ: а) карбонат кальция, цинк, гидроксид калия, серная кислота. б) раствор хлорида железа (III), оксида меди (II), гидроксида цезия, оксида фосфора (V), вода. в) алюминий, оксид фосфора (V), гидроксид рубидия, азотная разбавленная кислота г) карбонат калия, оксид алюминия, разбавленная серная кислота, магний 13. Предложить 5 способов получения сульфата цинка, 4 способа получения хлорида железа (III), 4 способа получения хлорида железа (II). РАЗБОР ЗАДАНИЙ ТЕСТОВ ИЗ ЕГЭ 1. Оксид кальция взаимодействует с каждым из двух веществ: 1) кислород, вода 3) соляная кислота, оксид бария 2) оксид магния, оксид серы (IV) 4) вода, оксид фосфора (V) Решение. Оксид кальция – основный оксид. Основные оксиды реагируют с кислотными оксидами и кислотами. Кроме того, оксиды самых активных металлов - щелочных (металлов IA группы) и щелочноземельных (металлов IIA группы: Ca, Sr, Ba) - реагируют также с водой. Кальций относится к щелочноземельным металлам. Поэтому CaO реагирует с кислотами, кислотными оксидами и водой. Этому условию удовлетворяет вариант 4 – оксид кальция реагирует с водой и оксидом фосфора. //Ответ: 4 2. Карбонат кальция реагирует с: 1) HCl 2) MgO 3) Pb 4) H2O Решение. Карбонат кальция (CaCO3) – соль. Общие свойства солей – взаимодействие с кислотами, солями, щелочами в водном растворе, при условии, если образуется осадок, газ или вода. Растворимые соли также реагируют с металлами: при этом более активный металл вытесняет менее активный металл из соли. Карбонат кальция – нерастворимая соль (см. таблицу растворимости), поэтому взаимодействие с металлами можно не рассматривать. Из всех предложенных веществ подходит соляная кислота, так как при взаимодействии с карбонатом кальция по уравнению: CaCO3 + 2HCl = CaCl2 + H2O + CO2 образуется углекислый газ и вода. //Ответ: 1 3. Амфотерным гидроксидом и кислотой соответственно являются 1) H2SO4 и Zn(OH)Cl 3) Ca(OH)2 и Be(OH)2 2) KHSO4 и NaOH 4) Al(OH)3 и HNO3 Решение. Кислоты состоят из атомов водорода и групп атомов, которые называются кислотным остатком. В данном случае это H2SO4 и HNO3. Амфотерные гидроксиды образуют некоторые металлы в степенях окисления от +2 до +4. В школьную программу входит знание следующих амфотерных гидроксидов: Zn(OH)2, Be(OH)2, Cr(OH)3, Al(OH)3, Fe(OH)3. Таким образом, условию задания отвечает четвертый вариант: Al(OH)3 - амфотерный гидроксид и HNO3 - кислота. //Ответ: 4 4. Гидроксид хрома взаимодействует с каждым из двух веществ: 1) СО2 и HCl 2) Н2 и NaOH 3) NО и NaNO3 4) H2SO4 и NaOH Решение. Гидроксид хрома – амфотерный гидроксид. Амфотерные гидроксиды реагируют с кислотами и щелочами, с кислотыми и основными оксидами. Поэтому нам подходит вариант 4 – серная кислота и гидроксид натрия (щелочь): 2Cr(OH)3 + 3H2SO4 = Cr2(SO4)3 + 6H2O Cr(OH)3 + NaOH = Na[Cr(OH)4] //Ответ: 4 5. Уксусная кислота не взаимодействует с: 1) CuO 2) Na2SO4 3) Cu(OH)2 4) Na2CO3 Решение. Уксусная кислота, как и все кислоты, взаимодействует с основаниями, основными оксидами, солями. Взаимодействие с солями возможно, если в результат реакции образуются осадок, газ или вода. CuO – основный оксид, Сu(OH)2 – основание, с ними уксусная кислота взаимодействует. Ответы 1 и 3 не подходят. Вещества, формулы которых под номерами 2 и 4, - соли. С Na2CO3 уксусная кислота будет взаимодействовать, так как в результате реакции образуются углекислый газ и вода: Na2CO3 + 2СН3СООН → 2СН3СООNa + H2O + CO2↑ С Na2SO4 уксусная кислота не будет взаимодействовать, так как не выполняются условия, если в результат реакции не образуются осадок, газ или вода. //Ответ: 2
Fe(OH)3 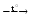 X1 X1 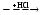 X2 X2веществом «X2» является 1) Fe2O3 2) FeO 3) FeCl3 4) FeCl2 Решение. Все гидроксиды, кроме гидроксидов щелочных металлов, разлагаются при нагревании. Гидроксид железа (III) разлагается при нагревании на оксид железа (III) и воду: 2Fe(OH)3 = Fe2O3 + 3H2O. Из двух образовавшихся веществ с хлороводородом (или его водным раствором – соляной кислотой) реагирует Fe2O3 - амфотерный оксид: Fe2O3 + 6HCl = 2FeCl3 + 3H2O. Таким образом, вещество X2 - FeCl3. //Ответ: 3
формула вещества рЕАГЕНТЫ А) Al(OH)3 1) KOH, CuO, H2O Б) CO2 2) NaNO3, Ca(OH)2, ZnCl2 В) H2SO4 3) Ba(OH)2, Cu, BaCl2 Г) NaOH 4) NaOH, H2SO4, HClO4 5) LiOH, MgO, K2CO3 6) CO2, HBr, FeCl3
Решение. Гидроксид алюминия – амфотерный гидроксид. Амфотерные гидроксиды реагируют с кислотами и щелочами, с кислотными и основными оксидами. Поэтому нам подходит вариант 4: раствор Al(OH)3 + NaOH = Na[Al(OH)4] 2Al(OH)3 +3H2SO4 2Al2(SO4)3+ 6H2O Al(OH)3 +3HClO4 Al(ClO4)3+ 3H2O Оксид углерода (IV) – кислотный оксид. Он реагирует с основными оксидами и щелочами. Кроме того, некоторые кислотные оксиды реагируют с водой. Этому условию удовлетворяет вариант 1: СО2 + 2КОНK2CO3+ H2O CO2 + CuOCuCO3 CO2 + H2O↔H2CO3 Серная кислота, как и все кислоты, взаимодействует с основаниями, основными оксидами, солями. Взаимодействие с солями возможно, если в результат реакции образуются осадок, газ или вода. Походит вариант 5 H2SO4 +2LiOH Li2SO4+ 2H2O H2SO4 +MgOMgSO4+ H2O H2SO4 +K2CO3 K2SO4 + H2O + CO2↑ Гидроксид натрия – щелочь, может реагировать с кислотными оксидами и кислотами. Взаимодействие с солями возможно, если в результат реакции образуются осадок, газ или вода. В 6 варианте приведен именно такой набор: 2NaOH+ СО2 Na2CO3+ H2O NaOH +HBrNaBr + H2O 3NaOH+ FeCl3Fe(OH)3+ 3NaCl //Ответ: 4156 ТРЕНИРОВОЧНЫЕ ЗАДАНИЯ ИЗ ТЕСТОВ ЕГЭ Задания уровня А
А1. Несолеобразующим оксидом является I) N2O5 2) N2O 3) N2O3 4) NO2 А2. Амфотерным является оксид, формула которого I) Cl2O 2) CaO 3) Al2O3 4) СO А3. Только кислотные оксиды указаны в ряду 1) ZnO, CO2, NO 2) CrO3, N2O5, SiO2 3) СО, SiO2, SnO2 4) N2O5, P2O3, Cs2O А4. Оксид хрома (III) относится к оксидам 1) кислотным 2) амфотерным 3) основным 4) несолеобразующим А5. Только кислоты расположены в ряду 1) HNO3, Ca(NO3)2, NO2 2) KHCO3, Ва(НSО4)2, ZnOHCl 3) HNO2, HNO3, CH3COOH 4) H2S, Na2SO3, SO2 А6. Какие из приведенных утверждений верны? А. Основным оксидам соответствуют основания. Б. Основные оксиды образуют только металлы. 1) верно только А 2) верны оба утверждения 3) верно только Б 4) оба утверждения неверны A7. Число гидроксидов среди перечисленных веществ: H2SO4, Ba(OH)2, Al2(SO4)3, Zn(OH)2, SO2, KOH, NaCl, H3PO4 1) 5 2) 4 3) 3 4) 2 А8. Оксиды марганца: А) Mn2O7 Б) MnO В) MnO2 Г) MnO3 расположены в порядке усиления кислотных свойств в ряду 1) АБВГ 2) БВГА 3) ВГАБ 4) АГВБ А9. К средним солям относится каждое из двух веществ 1) Fe(OH)2Cl и Fе(НSО4)2 2) MgCl2 и Mg(OH)NO3 3) KHCO3 и NaHSiO3 4) K3PO4 и BaSiO3 А10. Среди перечисленных веществ кислой солью является 1) гидрид магния 2) гидроксид кальция 3) гидрокарбонат натрия 4) гидроксокарбонат меди А11. Формулы только основных солей указаны в ряду 1) KHCO3, Na2Cr2O7, (CuOH)2SO4 2) Ca(HCO3)2, ZnS, (FeOH)Cl 3) CuCl2, NaHSO4, (AlOH)Cl2 4) (FeOH)NO3, (CuOH)2CO3, MgOHCl А12. Оксид углерода (IV) реагирует с каждым из веществ пары 1) водой и оксидом кальция 2) сульфатом калия и гидроксидом натрия 3) ортофосфорной кислотой и водородом 4) кислородом и оксидом серы (IV) А13. Раствор гидроксида натрия взаимодействует с каждым веществом, указанным в ряду: 1) оксид кремния, сульфат натрия, хлорид калия, гидроксид алюминия 2) оксид железа (II), медь, серная кислота, гидроксид алюминия 3) оксид фосфора (V), алюминий, соляная кислота, гидроксид цинка 4) оксид железа (VI), медь, карбонат кальция, гидроксид хрома (II) А14. С раствором соляной кислоты взаимодействует каждое из двух веществ 1) хлорид бария и оксид углерода (IV) 2) магний и нитрат серебра 3) хлорид натрия и фосфорная кислота 4) медь и гидроксид калия А15. Гидроксид цинка реагирует с каждым веществом пары 1) сульфат кальция и оксид серы (VI) 2) гидроксид натрия (р-р) и соляная кислота 3) вода и хлорид натрия 4) сульфат бария и гидроксид железа (III) А16. При взаимодействии лития с водой образуется водород и 1) оксид 2) пероксид 3) гидрид 4) гидроксид 17. Химическая реакция возможна между 1) Cu и HCl 2) Ag и Mg(NO3)2 3) Fe и Na3PO4 4) Zn и FeCl2 A18. Реагирует с раствором HCl, но не реагирует с раствором NaOH . 1) ZnO 2) N2O 3) SO3 4) FeO A19. Вещество, которое может реагировать с водородом,серной кислотой и алюминием, имеет формулу 1) P2O5 2) CuO 3) Ва(NO3)2 4) K2O А20. С каждым из перечисленных веществ: H2S, KOH, Zn взаимодействует 1) Pb(NO3)2 2) ZnSO4 3) Na2CO3 4) HCl А21. Как гидроксид алюминия, так и соляная кислота могут взаимодействовать с 1) CuO 2) H2SO4 3) CO2 4) NaOH А22.В схеме превращений Ca 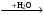 X1 X1 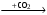 X2 X2веществами «X1», «X2» являются соответственно 1) Ca(OH)2, CaCO3 2) CaO, CaCO3 3) Ca(OH)2, CaO 4) Ca(OH)2, CaC2 А23. В схеме превращений: + H2O + H2SO4 + BaCl2 Na X1 X2 X3 веществами X1, X2, X3 являются соответственно: 1) Na2O, Na2SO4, NaOH 2) Na2O, Na2SO4, BaSO4 3) Na2O2, NaOH, BaSO4 4) NaOH, Na2SO4, BaSO4, А24. В схеме превращений + HCl + Na2CO3 CaCO3 → X1 → X2 + NaCl веществом X2 является I) CaCO3 2) CaCl2 3) CaO 4) Ca(OH)2 А25. В схеме превращений FeCl3 → X1 → X2 → Fe(OH)3 веществами X1 и X2 могут быть соответственно 1) Fe2(SO4), и Fe2O3 2) Fe(NO3)3 и Fe2O3 3) FePO4 и Fe3O4 4) Fe(OH)3 и Fe2(SO4)3 |