Моль. Вещество это любая совокупности атомов и молекул, находящаяся в определенном агрегатном состоянии. Атом
 Скачать 190.34 Kb. Скачать 190.34 Kb.
|
|
I. ВАЖНЕЙШИЕ ПОНЯТИЯ ХИМИИ Химия изучает строение, свойства и взаимопревращения веществ. Вещество и поле - две формы существования материи. ВЕЩЕСТВО– это любая совокупности атомов и молекул, находящаяся в определенном агрегатном состоянии. АТОМ- мельчайшая частица элемента, сохраняющая его свойства. АТОМ - это электронейтральная частица элемента, состоящая из положительно заряженного ядра и отрицательно заряженных электронов. Ядро состоит из протонов и нейтронов. По структуре атом - сложная частица, но при химических превращениях он не делится на части, не укрупняется, не исчезает, а атом одного вида не превращается в атом другого вида. Имеющиеся методы исследования позволяют установить, на какие именно атомы распадается вещество. Так, с помощью прибора масс-спектрофотометра смесь атомов разделяют по массам. Явление рассеяния (дифракции) рентгеновских лучей на атомах используется для определения расположения атомов в твердом веществе. В природе существует 80 различных видов атомов и еще около 20 видов получено в физических лабораториях. ХИМИЧЕСКИЙ ЭЛЕМЕНТ – это вид атомов с одинаковым зарядом ядра. Каждый химический элемент имеет название и сокращенное обозначение – символ. Символ представляет собой первую букву или две начальные буквы его латинского названия. Поэтому в ряде случаев символ не имеет никакой связи с русским названием элемента. Значения масс атомов, выраженных в стандартных единицах массы (mА) очень малы. Например, масса атома углерода равна 1,991*10-26 кг, поэтому для удобства пользуются относительными атомными массами. ОТНОСИТЕЛЬНАЯ АТОМНАЯ МАССА (Аr) химического элемента - величина, равная отношению средней массы атома к 1/12 массы атома изотопа углерода 12 С. mатома_____ Аr = 1/12 m 12С 1/12 массы атома углерода 12С принята за единицу атомной массы (а.е.м.) а.е.м. =1/12 m 12С=1,66057 *10-27кг Относительные атомные массы элементов приводятся в Периодической Системе (ПС) Д.И. Менделеева. При решении задач их округляют до целых. Средняя абсолютная масса атома равна относительной атомной массе, умноженной на а.е.м.: m (Cl) = 35,5* 1,66057 *10-27 = 5,89 10-23 г МОЛЕКУЛА – это наименьшая частица вещества, обладающая его химическими свойствами. Молекулы изображают формулами, которые состоят из символов химических элементов и индексов, обозначающих число атомов каждого элемента. ОТНОСИТЕЛЬНАЯ МОЛЕКУЛЯРНАЯ МАССА Мr вещества - это величина, равная отношению средней массы молекулы к 1/12 массы атома изотопа углерода – 12 (С12) mмолекулы Мr = 1/12 m 12С Относительную молекулярную массу можно рассчитать, сложив относительные массы всех атомов, входящих в состав молекулы. Задача 1.1 Рассчитайте относительную молекулярную массу сульфата алюминия. Решение. Используя периодическую систему Менделеева, находим значение относительной атомной массы алюминия, серы кислорода: Аr (Al) = 27, Ar (S) = 32, Ar (O) = 16. Относительная молекулярная масса сульфата алюминия будет равна: Mr (Al2 (SO4)3 ) = 2Ar (Al) + 3 Ar(S) + 12Ar (O). Mr (Al2(SO4)3 ) = 2*27 + 3*32 + 12*16 = 342 Число атомов и молекул в образцах веществ очень велико, поэтому при характеристике количества вещества используют специальную единицу измерения - моль. МОЛЬ – это такое количество вещества, которое содержит столько структурных единиц (атомов, молекул, ионов, электронов), сколько атомов содержится в 12 г изотопа углерода 12С. Рассчитаем число атомов углерода в 12 г углерода, учитывая, что 1,991*10-26 кг – масса атома углерода. NА =12/ 1,991*10-26 = 6,02*1023 1/моль показывает число структурных единиц в одном моль любого вещества и называется постоянной Авогадро. Если известно число структурных единиц вещества n, то количество этого вещества v (читается “ню”) определяется по формуле: = N\NA МОЛЯРНАЯ МАССА (М) – это масса одного моль. Ее можно рассчитать, зная массы вещества m и его количество : M = m\ Единица измерения молярной массы вещества – г/моль. Например, молярная масса воды равна 18 г/моль. Задача 1.2Рассчитайте абсолютную молекулярную массу (массу одной молекулы) для серной кислоты. Дано: Решение: H2SO4 Учитывая, что молярная масса серной кислоты ________ равна 98 г/моль, определяем массу Найти: по формуле m = M / NA mмолекулы (H2SO4) - ? m (H2SO4) = 98 / 6,02*1023 = 16*10-23 г Задача 1.3 Гормон инсулина имеет относительную молекулярную массу 5734. Вычислите массу (г) одной молекулы. Дано: Решение: Mr = 5734 1. Относительная атомная масса _____________ по определению Mr=m/1/12 m 12C, где 1/12 m 12С = 1,661*10 –27 кг Найти mмолекулы ? 2. Масса молекулы равна: m = 1,661*10 –27* 5734* 103 = 9,5210-21г Задача 1.4 Рассчитайте число молекул Br2 в броме массой 6,4 г. Дано: Решение: m (Br2) = 6,4 г 1. Учитывая, что молярная масса брома равна 160 г/моль (2Ar(Br)) вычисляем количество ___________ вещества по формуле (2): Найти: (Br2) = m (Br2) / M (Br2) n (Br2) - ? (Br2) = 6,4 / 160 = 0, 04 моль 2. Используя формулу (1) подставляем значение n = * NA , n = 0,04 * 6,02 * 1023 = 2,4*1022 I.1. Modda miqdori.(моль) I. 1. Найдите количество (моль) 80 г едкого натрия (NaOH). Решение: 1-метод. 1) Найдем молярную массу NaOH. MrNaOH=23+16+1=40 г 2) По формулу рассчитаем количество гидроксида. n= 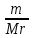 = = 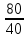 =2 моль =2 моль 2-метод. 1) MrNaOH = 40 г 40 г ────── 1 моль 2) x= 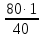 = 2 моль = 2 моль80 г ────── x= 3) ОТВЕТ:2 моль 2. Найдите количество (моль)10 г водорода (H2). ОТВЕТ:5 моль 3. Найдите количество (моль) 740 г гидроксида калция (Ca(OH)2). ОТВЕТ:10 моль 4. Найдите количество (моль) 8,5 г нитрата натрия (NaNO3). ОТВЕТ:0.1 моль 5. Найдите количество (моль) 15 г карбоната калциия (CaCO3). ОТВЕТ:0,15 моль 6. Найдите количество (моль) 16 г оксид серы (VI). ОТВЕТ:0,2 моль 7.Найдите количество (моль) 9,8г гидроксид меды (II) (Cu(OH)2). ОТВЕТ:0,1 моль 8.Найдите количество (моль) бензола (C6H6) 3,9 г. ОТВЕТ:0,05 моль 9.Найдите количество(моль)490г ортофосфорную кислоту (H3PO4). ОТВЕТ:5 моль 10. Найдите количество (моль) 49 г серную кислоту (H2SO4). ОТВЕТ:0,5 моль 11. На какую массу равно г 0,5 моль гидроксида натрия (NaOH). Решение: 1) NaOH=40 г 2) m = Mr∙n =40∙0,5=20 г ОТВЕТ:20 12.Найдите массу г 3 моль сульфата натрия (Na2SO4). ОТВЕТ:426 13. Найдите массу г 0,1 моль ( (NH4)3PO4). ОТВЕТ:14,9 14. Найдите массу г 0,25 моль (KOH). ОТВЕТ:14,5 15. Найдите массу г 3,5 моль купорос меди (CuSO4∙5H2O) . ОТВЕТ:875 16. Найдите массу г 5 моль серную кислоту (H2SO4). ОТВЕТ:490 17. Найдите массу г 4 моль уксусную кислоту (CH3COOH). ОТВЕТ:240 18. Найдите массу г 6 моль анилина (C6H5NH2) . ОТВЕТ:558 19. Найдите массу г 15 моль пероксид натрия (Na2O2) . ОТВЕТ:1170 20. Найдите массу г 3,5 моль фосфата натрия (Na3PO4) . ОТВЕТ:574 21. Найдите массу г 1,75 моль кислорода (O2). ОТВЕТ:56 22. Найдите массу г 3,3 моль негашеннего известка (CaO). ОТВЕТ:184,8 23. Если 5,2 г nomalum modda kelsa,nomalum modda мольekulyar massasini toping. Решение: 1) quyidagi fo’rmula bo’yicha мольekulyar massani topamiz. Mr = 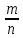 = =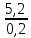 = 26 г ОТВЕТ:26 = 26 г ОТВЕТ:2624. 4,9 г nomalum modda 0,05 моль kelsa,shu moddani Mr ni toping. ОТВЕТ:98 25. 39 г nomalum modda 0,5 моль kelsa,shu moddani massasini toping. ОТВЕТ:78 26. nomalum moddaning 0,25 мольi 14 г kelsa,shu moddaning Mr ni toping. ОТВЕТ:56 27. 27,3 г nomalum modda 0,35 моль bo’lsa,moddaning Mr ni toping. ОТВЕТ:78 28. 0,3 моль moddaning massasi 36 г bo’lsa,shu moddaning мольekulyar massasini toping. ОТВЕТ:120 29. Berk idishga 14 г yarim моль gaz berkitilgan. Shu idish ichidagi noma’lum gaznining мольekulyar massasini aniqlang. ОТВЕТ:28 30. 36 г nomalum moddaning 0.45 мольining мольekulyar massasini toping. ОТВЕТ:80 31. Berk idishga 22 г yarim моль gaz berkitilgan. Shu idish ichidagi noma’lum gazni aniqlang.ОТВЕТ:44 32. 18,9 г nomalum moddaning miqdori 0,3 моль bo’lsa,shu moddaning мольekulyar massasini toping. ОТВЕТ:63 I.2. Мольyar hajm. I.1. 2 моль karbonat angidrid (CO2) (n.sh) da qanday hajmni egallaydi. Решение: 1) harqandaygazbirмольi 22,4 l(n.sh) hajmniegallaydi.bunda 2) 1 моль ────── 22,4 l x= 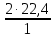 = 44,8 l(n.sh) dahajmni egallaydi. = 44,8 l(n.sh) dahajmni egallaydi. 2 моль ────── x= ОТВЕТ:44,8 l 2.0,5 моль sulfat angidrid (SO3) (n.sh) da qanday hajmni egallaydi?ОТВЕТ:11,2 l 3. 0,25 моль is gazi (CO) (n.sh) da qanday hajmni egallaydi?ОТВЕТ:5,6 l 4. 0,1 моль (NH3) (n.sh) da qanday hajmni egallaydi?ОТВЕТ:2,24 l 5. 10 моль sulfit angidrid (SO2) (n.sh) da qanday hajmni egallaydi?ОТВЕТ:224 l 6. 3 моль metan (CH4) (n.sh) da qanday hajmni egallaydi?ОТВЕТ:67,2 l 7. 1,6 моль vodorod bromid (HBr) (n.sh) da qanday hajmni egallaydi? ОТВЕТ:35,84 l 8. 3 моль etilen (C2H4) (n.sh) da qanday hajmni egallaydi?ОТВЕТ:67,2 l 9. 7 моль azot (N2) (n.sh) da qanday hajmni egallayd?ОТВЕТ:201,6 l 10. 0,3 моль ozon (O3) (n.sh) da qanday hajmni egallaydi?ОТВЕТ:6,72 II.11. 56 l (n.sh) vodorod sulfid (H2S) ni massasini г toping. Решение: 1) H2S (Mr) = 34 г 2) 22,4 l (n.sh) da ────── 34 г 56 l (n.sh) da ────── x= x= 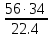 =85 г ОТВЕТ:85 г =85 г ОТВЕТ:85 г12. Normal sharoitda 40 l azot(I)-oksid (N2O) necha г keladi?ОТВЕТ:78,57 г 13. Normal sharoitda 11,2 l is gazi (CO) necha г keladi?ОТВЕТ:14 г 14. Normal sharoitda 224 l ozon (O3) necha г keladi?ОТВЕТ:480 г 15. Normal sharoitda 560 l geliy (He) necha г keladi?ОТВЕТ:100 г 16. Normal sharoitda 448 l argon (Ar) necha г keladi?ОТВЕТ:800 г 17. Normal sharoitda 300 ml atsetilen (C2H2) necha г keladi?ОТВЕТ:0,35 г 18.Normal sharoitda 2800 ml etilen (C2H4) necha г keladi?ОТВЕТ:3,5 г 19. 15,68 l (n.sh) metanol (CH3OH) massasini г toping. 22,4 г 20. 67,2 l (n.sh) etanning (C2H6) massasini toping. ОТВЕТ: 90 г III. 21. 2.24 m3 (n.sh) H2 ning massasini (kg) toping. Решение:1) 1 m3 gaz ────── 1000 l degani 2,24 m3 ────── x=2240 l degani. 2) 22,4 l (n.sh) da ────── 2 г H2 2240 l (n/sh) da ────── x= x= 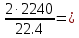 200 г H2 200 г H23) 1000 г ────── 1kg degani 200 г ────── x= x= 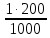 = 0,2 kg. ОТВЕТ:0,2 kg. = 0,2 kg. ОТВЕТ:0,2 kg.22. 6,72 m3 (n.sh) metan (CH4) ning massasini г toping. ОТВЕТ:4800 г 23. 56 kg karbonat angidrid (CO2) ni hajmini m3(n.sh) da hisiblang. ОТВЕТ:28,5 m3 24. n.sh da nomalum gazning 1 l massasi 1,25 г/l kelsa, shu gazning мольekulyar massasini toping. ОТВЕТ:28 25.0,25 l gazning (n.sh) massasi 0,232 г ga teng bo’lsa, мольekulyar massasini toping.ОТВЕТ:20 26. 300 ml gazning (n.sh) dagi massasi 0,857 г ga teng bo’lsa,uning мольekulyar massasini toping. ОТВЕТ:64 27. n.sh da olingan 20 ml gazning massasi 0,0268 г bo’lsa,shu gazning мольekulyar massasini toping.ОТВЕТ:30 IV.28. N.sh da o’lchangan 3,36 lgeliy (He) ning modda miqdorini (моль) hisoblang. Решение: 1) har qanday moddaning 1 мольi 22,4 l n.sh da hajmni egallaydi. 2) 22,4 l da ────── 1моль 3,36 l da ────── x= x= 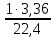 = 0,15 моль ОТВЕТ:0,15 моль = 0,15 моль ОТВЕТ:0,15 моль29.16,8 l(n.sh) vodorod (H2) ning modda miqdorini (моль) hisoblang.ОТВЕТ:0,75 моль 3.0 26,88 l (n.sh) azot(II)-oksid (NO) ning modda miqdorini (моль) toping .ОТВЕТ:1,2 моль 31.224 l (n.sh) azot(I)-oksid (N2O) ning modda miqdorini (моль) hisoblang.ОТВЕТ:10 моль 32. 112 l (n.sh) azot(IV)-oksud (NO2) ning modda miqdorini (моль) hisoblang.ОТВЕТ:5 моль 33. 44,8 l (n.sh) da neon (Ne) ning modda miqdorini toping. ОТВЕТ:2 моль 34. 134,4 l (n.sh) silan(CH4) ning мольini toping. ОТВЕТ:6 моль V.35. N.sh.da o’lchangan 6 г etan (C2H6) ning hajmini (l) hisoblang. Решение: 1) 30 г etan ────── 22,4 l (n.sh) da hajmni egallaydi 6 г da ────── x= x= 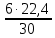 = 4,48 l. ОТВЕТ:4,48 = 4,48 l. ОТВЕТ:4,4836.3 г azot(II)-oksid (NO) ning normal sharoitdagi hajmini (l) hisoblang.ОТВЕТ:2,24 l 37. 1110 г azot(I)-oksid (N2O) ning normal sharoitdagi hajmini (l) hisoblang.ОТВЕТ:565 l 38. 9,2 г azot(IV)-oksid (NO2) ning (n.sh) dagi hajmini (l) hisoblang. ОТВЕТ:4,48 l 39. 220 г karbonat angidrid (CO2) ning normal sharoitdagi hajmini (l) hisoblang.ОТВЕТ:112 40. 56 г is gazi (CO) ning normal sharoitdagi hajmini (l) hisoblang.ОТВЕТ:44,8 l I. 3. Avagadro soni. I.1. Рассчитайте число молекул (CO) в угарного газа 0,1моль. Решение: 1) 1 моль ────── 6,02∙1023 ta мольeкула 0,1 моль ────── x = 2) x= 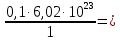 6,02∙1022 ta ОТВЕТ: 6,02∙1022 ta мольekula bor. 6,02∙1022 ta ОТВЕТ: 6,02∙1022 ta мольekula bor.2. Рассчитайте число молекул этана (C2H6) 10 моль. ОТВЕТ: 6,02∙1024 ta 3. Рассчитайте число молекул углекислого газа (CO2) 0,4 моль. ОТВЕТ:2,408∙1023 ta 4. Рассчитайте число молекул бензола (C6H6) 0,15 моль. ОТВЕТ:9,03∙1022 ta 5. Рассчитайте число молекул сернистого ангидрида (SO2) 4 моль. ОТВЕТ: 2,408∙1024 ta 6. Рассчитайте число молекул плавиковую кислоту (HF) 0,25 моль.ОТВЕТ:1,505∙1023 ta 7. Рассчитайте число молекул азотнистую килоту (HNO2) 0,5 моль. ОТВЕТ:3,01∙1023 ta 8. Рассчитайте число молекул гашеннего извеска (Ca(OH)2) 1,5 моль.ОТВЕТ:9,03∙1023 ta 9. Рассчитайте число молекул ангидрида ортофосфорного (P2O5) 2 моль.ОТВЕТ:1,204∙1024 ta 10. Рассчитайте число молекул пропана (C3H8) 6 моль. ОТВЕТ:36,12∙1023 ta 11. 3,01∙1023 metan (CH4) мольekulasining мольini toping. Решение: 1) 6,02∙1023 ta мольekula ────── 1 моль metanda 3,01∙1023 ta мольekula ────── x= 2) x= 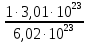 = 0,5 моль bo’ladi. ОТВЕТ:0,5 = 0,5 моль bo’ladi. ОТВЕТ:0,512. 3,01·10 23 ta suv (H2O) мольekulasi necha моль keladi?ОТВЕТ:0,5 13. 9,03· 1023 ta sulfat kislota (H2SO4) мольekulasi necha моль keladi?ОТВЕТ:1,5 14. 15,05·1023 ta sulfat angidrid (SO3) мольekulasi necha моль keladi?ОТВЕТ:2,5 153,01·1024 ta karbonat angidrid (CO2) мольekulasi necha моль keladi?ОТВЕТ:5 16. 9,03·1025 ta oltingugurt(IV)-oksid (SO2) мольekulasi necha моль keladi?ОТВЕТ:15 17.15,05·1022 ta atsetilen (C2H2) мольekulasi necha моль keladi?ОТВЕТ:0.25 18. 24,08·1023 ta xlor tuzi мольekulasi necha моль keladi?ОТВЕТ:4 19. 6,02·1022 ta oktan (C8H18) мольekulasi necha моль keladi?ОТВЕТ:0.1 20. 3,01·10 23 ta tulki dumi (NO2) мольekulasi necha моль keladi?ОТВЕТ:0,5 III.21. 2,24 l(n.sh) da is gazi (CO) dagi мольekulalar sonini toping. Решение: 1) har qanday modda n.sh da 22,4 l hajmni egallaydi. 2) 22,4 l(n.sh) da ────── 6,02∙1023 мольekula bor 2,24 l(n.sh) da ────── x= x= 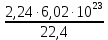 = 6,02·1022ОТВЕТ:6,02·1022 ta = 6,02·1022ОТВЕТ:6,02·1022 ta22. 2,24 l(n.sh)etandagi (C2H6) мольekulalar sonini hisoblang.ОТВЕТ: 6,02∙1022 ta 23. 3,36 l azot(II)-oksid (NO) dagi мольekulalar sonini hisoblang.ОТВЕТ:9,03∙1022 ta 24.4,48 l azot(IV)-oksid (NO2) dagi мольekulalar sonini hisoblang.ОТВЕТ:1.204∙1023 ta 25. 5,6 l azot(I)-oksid (N2O) dagi мольekulalar sonini hisoblang. ОТВЕТ:1,505∙1023 ta 26.6,72 l ammiak (NH3) dagi мольekulalar sonini hisoblang.ОТВЕТ:1,806∙1023 ta 27. 13,44 l oltingugurt(IV)-oksid (SO2) dagi мольekulalar sonini toping. ОТВЕТ:3,612∙1023 ta 28. 156,8 l atsetilen (C2H2) dagi мольekulalar sonini toping. ОТВЕТ:42,14∙1023 ta 29. 17,92 l vodorod ftorid (HF) dagi мольekulalar sonini hisoblang. ОТВЕТ:4,816∙1023 ta 30. 11,2 l fosfin (PH3) dagi мольekulalar sonini hisoblng. ОТВЕТ:3,01∙1023 ta 31 Рассчитайте число молекул в метане (CH4) 4,8 г . Yechish. 1) Кhar qanday moddaning 1 моль massasida 6,02∙1023 ta мольekula bo’ladi. 16 г metanda ────── 6,02∙1023 ta мольekula bor 4,8 г metanda ────── x= 3) x= 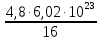 = 1,806∙1023 ta мольekula bor. ОТВЕТ:1,806∙1023 = 1,806∙1023 ta мольekula bor. ОТВЕТ:1,806∙102332.4,4 г azot(I)-oksiddagi мольekulalar sonini hosblang.ОТВЕТ: 6,02∙1022 33. 4,8г vodorod sulfiddagi мольekulalar sonini hosblang.ОТВЕТ:8,5∙1022 34.35,2 г propandagi мольekulalar sonini hosblang.ОТВЕТ:4,816∙1023 ta 35.54 г etandagi мольekulalar sonini hosblang.ОТВЕТ:10,836∙1023 36. 12 гozondagi мольekulalar sonini hosblang.ОТВЕТ:1,505∙1023 ta 37. 7,8 г asetilendagi мольekulalar sonini toping. ОТВЕТ:1,806∙1023 ta 38. 12 г mochevina (CO(NH2)2) dagi мольekulalar sonini toping. ОТВЕТ:1.204∙1023 ta 39. 85,2 г dekan (C10H22) dagi мольekulalar sonini hisoblang. ОТВЕТ:3,612∙1023 ta 40. 20 г geptan (C7H16) dagi мольekulalar sonini toping. ОТВЕТ:1.204∙1023 ta VI. 41. 2,22 г malahid (Cu(OH)2∙CuCO3) dagi kislorod atomlar sonini toping. Решение: 1) Cu(OH)2∙CuCO3 = 5 ta kislorod atomi bor yoki (5∙6,02∙1023) 30,1∙1023 ta atom bor.malahit мольekulyar massasi 222 г.ga teng. 2) 222 г da ────── 30,1∙1023 ta kislorod atomi bor 2,22 г da ────── x= x= 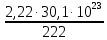 = 3,01∙1022 ta kislorod atomi bor. ОТВЕТ: 3,01∙1022 = 3,01∙1022 ta kislorod atomi bor. ОТВЕТ: 3,01∙102242. 75,6 г ammoniy bixromat ((NH4)2Cr2O7) dagi azot atomlari sonini hisoblang.ОТВЕТ:3,612∙1023 ta 43. 127,2 гkaliyfosfat(K3PO4) dagikislorodatomlarisoninihisoblang.ОТВЕТ:14,448∙1023 44. 22 гkaliypermanganat (KMnO4) dagikislorodatomlarsoninitoping. ОТВЕТ:3,35∙1023 45. 17 г zar suvi (HNO3∙3HCl) dagi xlor atomlar sonini toping. ОТВЕТ:1,78∙1023 46. 28,4 г glauber tuzi (Na2SO4∙10H2O) dagi natriy atomlar sonini toping.ОТВЕТ:1,06∙1023 47. 10 г silvinit (KCl∙NaCl) dagi xlor atomlar sonini toping. ОТВЕТ:9,05∙1022 48. 25 г mis kuporosi (CuSO4∙5H2O) dagi kislorod atomlar sonini toping. ОТВЕТ:5,418∙1023 49. 55,2 г xalkopirit (CuFeS2) dagi temir atomlar sonini toping. ОТВЕТ:1,806∙1023 50. 30 г gips (CaSO4∙2H2O) dagi водород atomlar sonini toping. ОТВЕТ:4,2∙1023 Moddaning miqdoriga asoslanib uning hajmini (l) hisoblash (1-10)
Moddaning hajmiga asoslanib uning miqdorini (mol) hisoblash (1-16)
Moddaning hajmiga asoslanib uning massasini (g) hisoblash (1-10)
Moddaning massasiga asoslanib uning hajmini (l) hisoblash (1-10)
Moddaning miqdoriga asoslanib uning tarkibidagi molekulalar sonini hisoblash (1-10)
Moddaning molekulalar soniga asoslanib uning miqdorini (mol) hisoblash (1-10)
Moddaning massasiga asoslanib uning molekulalar sonini hisoblash (1-12)
Moddaning molekulalar soniga asoslanib uning massasini (g) hisoblash (1-16)
Molekuladagi atomlar nisbatini aniqlash (1-10)
РАСЧЕТЫ ПО ХИМИЧЕСКОЙ ФОРМУЛЕ Формула химического вещества показывает его стехиометрический состав. Например, формула воды Н2О показывает, что один моль этого вещества образован из 2 моль атомного водорода и 1 моль атомного кислорода. Это позволяет проводить различные расчеты, используя формулы химических соединений. Задача 4.1.1 Определите металл, если молярная масса иодида трехвалентного металла в 3,972 раза больше молярной массы фторида этого же металла. Дано: Решение M (MeJ3)M (MeF3) 1. Пусть М - молярную массу неизвестного в 3,972 раза металла. Тогда, молярная масса иодида ______________ М+(127*3) = М+381 г/моль Найти: М (Ме)- ? Молярная масса фторида М+(18*3) = = М +54 г/моль 2. М+381/М+54 = 3,972 Решая уравнение, получаем М = 52, это хром. |
