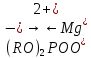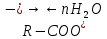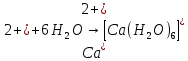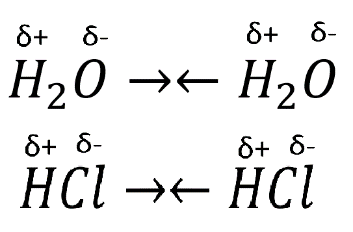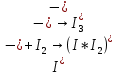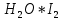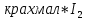ТОХППЭ. Вопросы к экзамену по дисциплине теоретические основы химической переработки природных энергоносителей
 Скачать 0.59 Mb. Скачать 0.59 Mb.
|
|
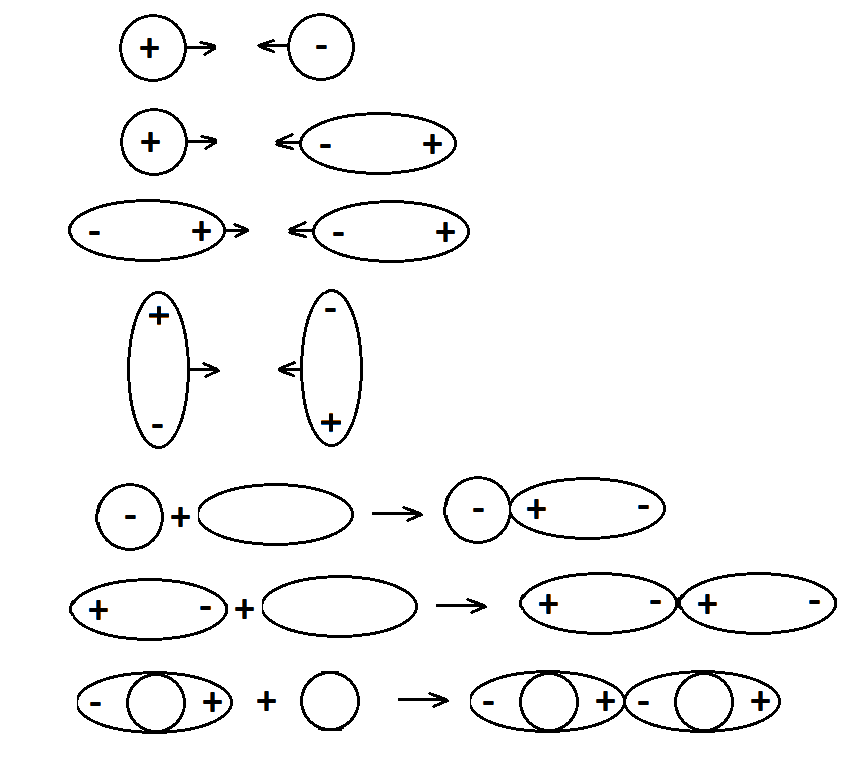
31. Типы межмолекулярных взаимодействий компонентов нефти. Примеры проявления эффекта межмолекулярного взаимодействия углеводородов или других соединений, содержащихся в нефти и нефтяных фракциях Межмолекулярное взаимодействие — взаимодействие между молекулами и/или атомами, не приводящее к образованию ковалентных (химических) связей. Все межмолекулярные взаимодействия имеют в основе электрическую природу, согласно которой разноименные заряды притягиваются, а одноименные отталкиваются. За счет межмолекулярных связей из отдельных частиц образуются ассоциаты, которые частично или полностью разрушаются при переходе вещества из твердого агрегатного состояния в жидкое или газообразное. В зависимости от природы взаимодействующих частиц различают следующие типы межмолекулярных взаимодействий: ион-ионные, ион-дипольные, ориентационные (диполь-дипольные), индукционные (ион или диполь -индуцированный диполь), дисперсионные (мгновенный диполь -индуцированный мгновенный диполь). Ион-ионное взаимодействие характерно при наличии в системе противоположно заряженных ионов Ион-дипольное взаимодействие. Этот вид взаимодействия наблюдается между ионом и полярной молекулой или полярной группой, обладающими постоянным дипольным моментом. Ориентационное взаимодействие. Этот вид взаимодействия наблюдается между полярными молекулами, обладающими постоянным дипольным моментом. Индукционное взаимодействие наблюдается между неполярной молекулой и ионом или молекулой с постоянным диполем. Дисперсионные взаимодействия. Это взаимодействие мгновенный диполь - индуцированный мгновенный диполь. Оно является самым слабым изо всех видов межмолекулярных взаимодействий. Исходная дисперсность НДС обусловлена склонностью к повышенным межмолекулярным взаимодействиям нефтяных компонентов, в первую очередь, полициклических аренов и гетероорганических соединений, особенно САВ. Благодаря межмолекулярному взаимодействию вязкость нефтяных масел быстро возрастает со снижением температуры, особенно ниже 20°С. 1 – Зависимость энергии взаимодействия от расстояния 2 – Энергия взаимодействия, кДж/моль
32.Сущность термических процессов переработки нефти, примеры и перспективы развития. Основными процессами термической переработки нефтяного сырья являются термический крекинг, коксование и пиролиз. Основным типом превращений при термическом крекинге и пиролизе является распад углеводородов. При термических процессах происходит гомолитический разрыв. Приводит к образованию свободных радикалов. Связь разрывается так, что у каждого осколка молекулы остается по одному электрону. 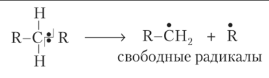 Для осуществления гомолитического разрыва необходимо меньше энергии, чем для гетеролитического разрыва, так как в последнем случае необходимо затратить энергию на преодоление электростатического взаимодействия ионов. Еще меньшая энергия требуется для отрыва одного электрона (одноэлектронный перенос). Разрыв происходит в месте, где наименьшая энергия связи. У различных групп УВ различная энергия связи. Этим и объясняется различная термическая стабильность различных групп УВ.
Основные типы углеводородов нефти по возрастанию термической стабильности представлены в ряду: алканы, нафтены, ароматические, нафтено-ароматические, полициклические ароматические углеводороды. Термический крекинг Термический крекинг мазута под давлением (470—520 С,давление 2—5 МПа) с получением бензина является устаревшим процессом. В настоящее время установки крекинга мазута под давлением не строятся Коксование Процессы коксования нефтяных остатков служат для получения электродного кокса (выход 10—40 % в зависимости от сырья и типа процесса). Пиролиз Процесс пиролиза служит для получения газообразных олефинов, главным образом этилена1. Сырье для пиролиза — бензин прямой перегонки, керосино-газойлевые фракции, а также природные и попутные газы. 33.Сущность гомолитического и гетеролитического распада связи. Привести примеры Классификация органических реакций по способу разрыва и образования связи: Гомолитический распад. Приводит к образованию свободных радикалов. Связьразрывается так, что у каждого осколка молекулы остается по одному электрону. Происходит чаше всего при термических превращениях углеводородов. Требует меньше энергии для разрыва С–С связи, а именно =360кДж/моль, чем при гетеролитическом разрыве. Гетеролитический разрыв. Приводит к образованию ионов.Связь разрывается так, что пара электронов связи целиком переходит к одному из атомов, образующих связь. Углеводородные радикалы, ионы (карбкатионы, карбанионы), атом водорода (Н*), гидрид-ион (Н:) и протон (Н+) являются промежуточными частицами в процессах термокаталитических превращений углеводородов. Они обладают высокой реакционной способностью. Требует больше энергии для разрыва С–С связи, а именно =1200кДж/моль. Происходит только при каталитических превращениях углеводородов. Так как необходимо затратить энергию на преодоление электростатического взаимодействия ионов. 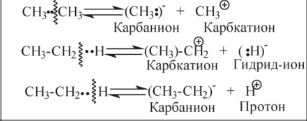 Примеры  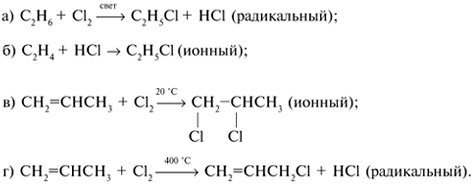 34. Реакции, характерные для радикалов углеводородов в термических процессах B соответствии с радикально-цепным механизмом крекинг проходит через следующие стадии. 1. Зарождение цепи (образование свободных радикалов). При термическом распаде алканов, начиная с этана, в результате разрыва связи С–С происходит зарождение цепи с образованием свободных радикалов: 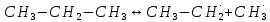 В случае алканов с большим числом атомов углерода при не очень высоких температурах крекинга (350…450°С) разрыв углеводородной цепи происходит посередине, т. е. по наименее прочным связям С-С. При более высоких температурах могут разорваться и другие углерод-углеродные связи. При зарождении цепи значительно менее вероятен разрыв С-Н-связей углеводородов. Он возможен только в случае низших алканов (этан, пропан) при соударении их молекул со стенкой реактора при высоких температурах. Так как атомы водорода являются внешними атомами в молекулах, то при соударении со стенкой реактора может произойти, отрыв атома водорода: 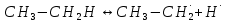 2. Продолжение цепи (реакции свободных радикалов). Радикалы представляют собой химически ненасыщенные частицы и обладают высокой реакционной способностью, так как содержат неспаренный электрон. Поэтому они стремятся стабилизироваться и подвергаются различным превращениям. а) Распад радикалов. Радикалы распадаются по β-связям (С–С или менее вероятно С–Н), находящимся в β-положении по отношению к атому углерода, несущему неспаренный электрон. В результате распада образуются ненасыщенные молекулы и новые свободные радикалы с меньшей молекулярной массой. Если распад неразветвленного вторичного алкильного радикала может произойти по нескольким направлениям, то энергетически более выгоден процесс, при котором образуется радикал с наибольшей молекулярной массой. 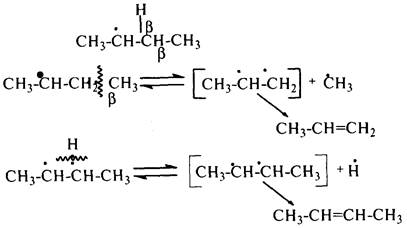 Относительно устойчивыми к распаду являются низшие алифатические радикалы: ·СН3, СН3С·Н2. Такие радикалы, как СН3-С·Н2, СН3-С·Н-СН3, ·С(СН3)3, могут распадаться только с разрывом β–С–Н-связей. Другие радикалы распадаются с разрывом как β–С–С-, так и β–С–Н-связей, причем разрыв β–С–С-связей протекает легче. Энергия диссоциации для различных β-связей С–С. б) Изомеризация радикалов. Первичные радикалы могут изомеризоваться в более стабильные вторичные. Изомеризация протекает в результате внутримолекулярной миграции атома водорода из положения 4 или 5 в положение 1 через циклическое переходное состояние (1,4- и 1,5-изомеризация). Например, 1,5-изомеризация: 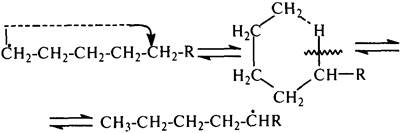 в) Реакции радикалов с молекулами углеводородов (реакции передачи цепи). Это основные реакции, приводящие к развитию цепи. Низшие свободные радикалы (·Н, ·СН3, ·С2Н5) при столкновении с молекулами алканов отрывают от них атомы водорода: в) Реакции радикалов с молекулами углеводородов (реакции передачи цепи). Это основные реакции, приводящие к развитию цепи. Низшие свободные радикалы (·Н, ·СН3, ·С2Н5) при столкновении с молекулами алканов отрывают от них атомы водорода:R–H + H· 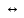 R· + Н2 R· + Н2R–H + ·CH3 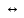 R· + CH4 R· + CH4Другие радикалы (состава С3, С4 и выше) также могут вступать в эти реакции при повышенных давлениях (2 – 5 МПа) и температурах до 600 °С. Однако в условиях пиролиза они значительно легче распадаются, чем вступают в эти реакции. 3. Обрыв цепи. Осуществляется следующими реакциями. а) Рекомбинация радикалов происходит при их столкновении, когда концентрация радикалов в системе становится значительной: ·СН3 + ·СН3 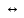 СН3–СН3 СН3–СН3СН3–СН2–С·Н2 + ·СН3 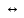 СН4 + СН3–СН=СН2 СН4 + СН3–СН=СН2б) Диспропорционирование радикалов (процесс, обратный бимолекулярной реакции образования радикалов): 2С2Н5· 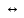 С2Н6 + С2Н4 С2Н6 + С2Н435. Образование нефтяного кокса в жидкофазных термических процессах: исходные вещества, механизм реакций. Сырье - отбензиненные нефти, мазуты, полугудроны, гудроны, крекинг-остатки, тяжелые газойли каталитического крекинга, смолы пиролиза, природные асфальты и остатки масляного производства. Нефтяной кокс образуется в жидкофазных термических процессах из аренов по схеме: арены 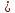 смолы смолы асфальтены асфальтены кокс кокс  графит. графит.Алканы, циклоалканы и алкены также способны к коксооброзованию в результате глубоких превращений и ароматизациии. Переход аренов в кокс термодинамически возможен в результате снижения уровня свободной энергии. Процесс коксообразования протекает по цепному свободно радикальному механизму. Асфальтены, образовавшиеся при уплотнении аренов, вступают в дальнейшие реакции поликонденсации: A A1 + R R + A A1 + RH A1 + A A1A A1A M + A1A2 A1A2 + A A1A2A + и т.д. где - А - молекула асфальтена; R, A1, A1A, A1A2, A1A2A - радикалы цепи; М - молекула с небольшой молекулярной массой, выделяющаяся в газовую фазу. 36. Общие сведения о катализе и катализаторах. Энергетика и химическая природа катализа Катализом называется явление изменения скорости реакции, происходящее под действием некоторых веществ (катализаторов), которые, участвуя в процессе, к концу реакции остаются неизменными. Катализ называется положительным, когда катализатор увеличивает скорость реакции; и отрицательным, когда он уменьшает скорость реакции. Реакции, которые каталитически ускоряются продуктами, получающимися при этой реакции, называются автокаталитическими. Катализаторы не влияют на равновесие, одинаково ускоряя и прямую, и обратную реакции. Виды катализа: Гомогенный катализ ‒ если катализатор находится в одной фазе с реагентами. Гетерогенный катализ ‒ если катализатор и реагенты находятся в разных фазах Окислительно-восстановительный катализ – обмен электронами между катализатором и реагентами. Кислотно-основный катализ – обмен протонами или ионами между катализатором и реагентами. Роль катализатора заключается в замене трудно осуществимого прямого пути течения реакции более легким обходным путем, включающим промежуточное воздействие с катализатором. 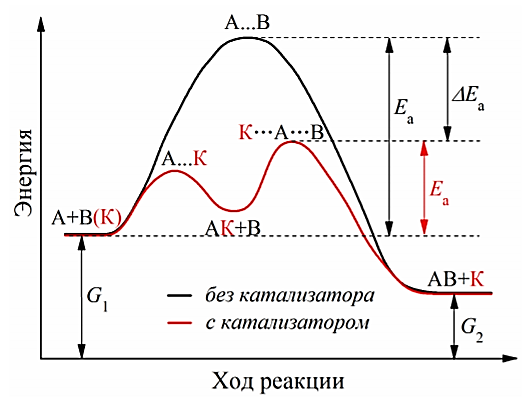 А) А+B = АВ – одностадийная химическая реакция с энергией активации Еа, идущая без катализатора. Б) А+В(К) = - та же реакция, но с участием катализатора: 1. А+К = АК – образование промежуточного активированного комплекса 2. АК+В = (АВ)К – активированный комплекс АК реагирует со вторым реагентом 3. (АВ)К = АВ+К – разложение комплекса с образованием продукта реакции и освобождение катализатора для нового каталитического цикла. Энергия активации каждой стадии каталитической реакции существенно ниже энергии активации химической реакции без участия катализатора. Под энергией активации понимают минимальную суммарную энергию сталкивающихся молекул, которая обеспечивает вступление их в реакцию между собой. |