ТОХППЭ. Вопросы к экзамену по дисциплине теоретические основы химической переработки природных энергоносителей
 Скачать 0.59 Mb. Скачать 0.59 Mb.
|
|
37. Требования к промышленным катализаторам. Примеры каталитических процессов в нефтепереработке Структура промышленных катализаторов. Промышленные твердые катализаторы представляют собой сложную смесь, которая называется контактной массой. В этой массе одни вещества являются собственно катализаторами, а другие служат активаторами и носителями. Активаторы (промоторы) — вещества, повышающие активность основного катализатора, путем образования (раскрытия) активных центров Активатор защищает от действия контактных ядов (блокировка активных центров). Носители (трегеры) — термостойкие, прочные, пористые вещества, на которые наносят катализатор. Требования, предъявляемые к катализаторам. Катализаторы, используемые в промышленности, должны обладать постоянной высокой каталитической активностью, селективностью, механической прочностью, термостойкостью, большой длительностью работы, легкой регенерируемостью, незначительной стоимостью. Активность катализатора – мера ускоряющего воздействия по отношению к данной реакции. Если каталитическая реакция и некаталитическая имеют один и тот же порядок, то есть их константы имеют одну и ту же размерность, то активность катализатора (А) можно определить: 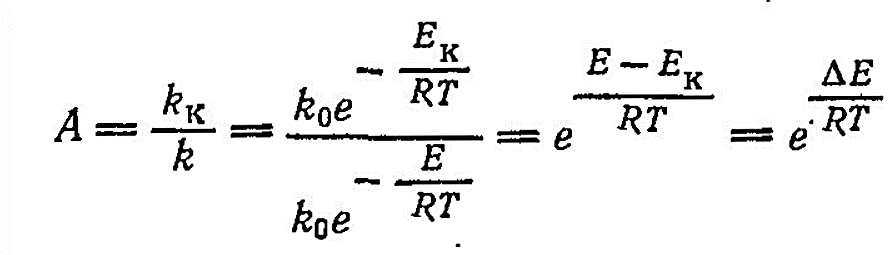 Температура зажигания – это температура, при которой технологический процесс начинает идти с достаточной для практической цели скоростью. С технологической точки зрения лучше использовать катализаторы с низкой температурой зажигания. Для экзотермической реакции температура зажигания – это минимальная температура, при которой процесс может идти без подвода теплоты извне, то есть в автоматическом режиме. Селективностью или избирательностью катализатора называют его способность избирательно ускорять целевую реакцию при наличии нескольких побочных. Селективность зависит от пористой и кристаллической структуры катализатора. Пористость значительно увеличивает скорость химических реакций. Различные кристаллические модификации одного и того же вещества могут обладать сильно отличающиеся каталитической активностью. Механическая прочность и срок службы. Остановка непрерывного технологического процесса обходится дорого, поэтому срок службы катализатора должен быть велик либо катализатор должен регенерироваться на месте простыми способами. Примеры каталитических процессов в нефтепереработке: каталитический крекинг, каталитический риформинг, алкилирование, полимеризация, гидроочистка, гидрокрекинг, изомеризация. 38. Механизм действия катализаторов окислительно-восстановительного типа. В каких промышленных процессах они применяются? Специфика каталитических реакций состоит в том, что обмен электронами между реагирующими связями осуществляется с участием электронов катализатора. Типичными катализаторами окислительно-восстановительных реакций являются переходные металлы и полупроводники. Активность переходных металлов (Fe, Co, Ni, Ru, Rh, Re, Ir, Pt и др.) в окислительно-восстановительных реакциях объясняется незавершенностью их d-оболочек. Неспаренный электрон незавершенной d-орбитали действует как «свободная валентность», в значительной мере подобно свободному радикалу. Если адсорбированная молекула имеет незанятые орбитали, то возникает ковалентная связь за счет перехода электрона из металла на вакантные уровни молекулы. Если поверхность металла обладает большим сродством к электрону по сравнению с адсорбированной частицей, то происходит переход электрона от молекулы в металл. Между этими крайними механизмами возможны различные переходные формы. Образование промежуточного соединения катализатора с молекулой, обладающей неподелённой парой электронов, может происходить путем переноса заряда от молекулы к незаполненной орбитали металла с получением так называемого комплекса с переносом заряда. Соединения этого типа можно рассматривать как молекулярные донорно-акцепторные соединения. Связь, возникающая в комплексах с переносом заряда, носит обычно полярный характер. В случае полупроводников (оксиды, сульфиды никеля, молибдена, вольфрама и некоторых других переходных металлов) свободные валентности (свободные электроны и электронные дырки) появляются вследствие неполной координированности атомов поверхности кристаллической решетки и в результате различных дефектов кристалла полупроводника. Появление электронов (или дырок) в зоне проводимости может быть вызвано также присутствием в кристалле различных примесей, обладающих электронодонорными (или электроноакцепторными) свойствами, а так- же нарушениями стехиометрического состава. На поверхности кристалла электроны (или дырки) проводимости будут играть роль свободной валентности или активных центров. При взаимодействии молекулы углеводорода со свободными электронами (дырками) поверхности молекула подвергается диссоциации: 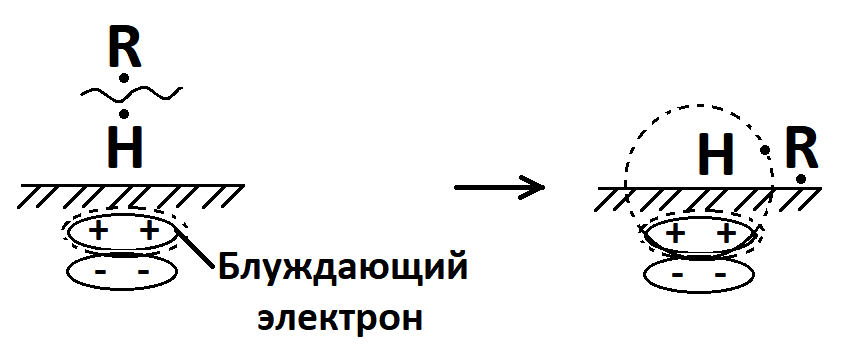 В результате взаимодействия одна часть молекулы связывается с катализатором прочной двухэлектронной связью, другая - слабой одноэлектронной. Вследствие непрерывно протекающих процессов электронного обмена эти связи могут взаимно переходить друг в друга. Малая стабильность и высокая реакционная способность образующихся поверхностных соединений обуславливают высокую скорость их дальнейших превращений. Каждая молекула может реагировать с данным активным центром различными путями. В одном элементарном каталитическом акте могут принимать участие группы из двух, трех и более центров (дублеты, мультиплеты). Таким образом, каталитическая активность прямо связана с числом свободных валентностей на поверхности катализатора. Окислительно-восстановительные катализаторы используют в процессах риформинга, гидроочистки и гидрокрекинга для увеличения скорости реакций гидрирования - дегидрирования. 39 . Сущность кислотного катализа. Примеры промышленных процессов, в которых применяется кислотный катализ Кислотный катализ. Катализ жидкими и твердыми кислотами широко применяют в нефтеперерабатывающей промышленности. Каталитическое действие кислот обусловлено образованием при их взаимодействии с углеводородами катионов, называемых карбоний-ионами или карбкатионами. Обычно карбкатионы образуются при передаче протона от катализатора (кислота HX) к молекуле ненасыщенного углеводорода: 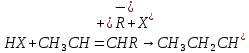 При достаточно высокой кислотности катализатора карбкатионы образуются также из алканов или циклоалканов путем гетеролитического разрыва связей в молекуле под воздействием катализатора (кислота Льюиса L): 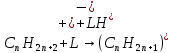 Карбкатионы - чрезвычайно реакционноспособные соединения. Константы скорости ионных реакций на несколько порядков выше аналогичных радикальных реакций. Об относительной устойчивости карбкатионов можно судить по их теплоте образования. Стабильность карбкатионов возрастает в последовательности: первичный <вторичный <третичный. Основными реакциями карбкатионов, как и радикалов, являются мономолекулярный распад по β-правилу и бимолекулярные реакции замещения и присоединения. Существенное отличие карбкатионов от радикалов - их способность к изомеризации, что объясняется значительным снижением запаса свободной энергии при переходе от первичного к вторичному и третичному карбкатионам. Из кислотных катализаторов наибольшее распространение в нефтеперерабатывающей и нефтехимической промышленности получили алюмосиликаты, галогениды алюминия, бора, сурьмы, оксид алюминия, сульфиды некоторых переходных металлов, также ряд протонных кислот. Кислотные катализаторы используют в процессах каталитического крекинга, риформинга, изомеризации и других для ускорения реакций, протекающих по карбкатионному механизму. 40. Способы образования карбкатионов в каталитических процессах (роль кислот Льюиса и Бренстеда) Карбкатионы получаются различными путями; характерным примером служит взаимодействие кислоты с ненасыщенным углеводородом, играющим роль слабого основания: 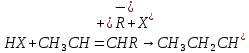 Ароматические углеводороды также могут быть акцепторами протонов: 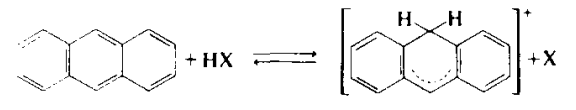 Образование карбкатиона из олефинов на поверхности алюмосиликатного катализатора происходит при взаимодействии протона каталитического центра с  -электронами двойной связи: -электронами двойной связи: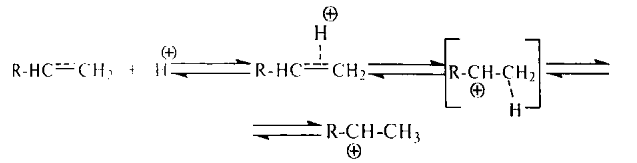 Образование карбкатиона из парафинового углеводорода требует отрыва гидрид-иона под действием протонного центра (кислота Бренстеда): 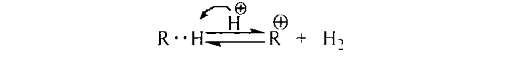 или апротонного центра катализатора (кислота Льюиса): 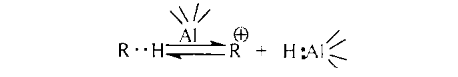 На поверхности алюмосиликатных катализаторов имеется 2 типа каталитических центров: протонные и апротонные. С участием протонных центров алюмосиликатных катализаторов катализ осуществляется подвижными протонами. Это либо протоны воды, хемисорбированной координанионно ненасыщенным атомом алюминия, либо гидроксильных групп, сорбированных атомом алюминия, или свободных. Во всех этих структурах протон приобретает подвижность вследствие сильной поляризации связи О-Н за счет электроноакцепторных свойств координационно ненасыщенного атома алюминия. На поверхности цеолитов поливалентных металлов также находятся как апротонные активные центры (координационно ненасыщенные атомы алюминия), так и протонные активные центры. В апротонных центрах носителями каталитической активности являются координационно ненасыщенные атомы алюминия с координацинонным числом 5, 4 или 3. 42. Стадии каталитических реакций Одной из обязательных стадий гетерогенных каталитических реакций является перенос реактивов к активной поверхности пористого катализатора. В общем случае каталитическая реакция на твердых пористых катализаторах складывается из следующих стадий: 1. Эффективная внешняя диффузия реактантов из ядра потока к поверхности зёрен катализатора (внешняя диффузия); 2. Диффузия реактантов в поры катализатора (внутренняя диффузия); 3. Хемосорбированная адсорбция одного или нескольких компонентов реакционной смеси на поверхности катализатора; 4. Химическая реакция на поверхности катализатора 5. Десорбция продуктов катализа (и регенерация активного центра катализатора). 6. Диффузия продуктов катализа в порах катализатора. 7. Диффузия продуктов катализа от внешней поверхности катализатора в газовый (жидкостной) поток. Лимитирующие стадии 1 и 2 (6 и 7) Для ускорения их используют катализаторы мелких размеров и увеличение пор. В зависимости от того, какая из указанных стадия является лимитирующей, различают следующие области протекания процесса: внешнедиффузионную, внутридиффузионную и кинетическую. Переход из одной области в другую сопровождается изменением наблюдаемых на опыте кинетических закономерностей(порядка реакции, энергии активации), которые определяются природой и характером лимитирующей стадии. |
