Вопросы к экзамену по патологической физиологии Общая патология Патологическая физиология как наука и ее место среди других дисциплин. Задачи и методы исследования патологической физиологии и ее значение в подготовке будущего врача
 Скачать 1.32 Mb. Скачать 1.32 Mb.
|
|
Клиренс (С) вычисляют по формуле: 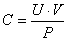 где С — клиренс исследуемого вещества, мл/мин; U — концентрация исследуемого вещества в моче, мг/мл; V — диурез, мл/мин; Р — концентрация исследуемого вещества в плазме, мг/мл. Для определения величины клубочковой фильтрации используют экзогенные (полисахарид инулин), а также эндогенные (креатинин) вещества, которые фильтруются в клубочках и не реабсорбируются и не секретируются в канальцах. В норме клиренс креатинина варьирует в пределах 130 — 90 мл/мин. Это означает, что здоровые почки за 1 мин очищают от креатинина 130 — 90 мл плазмы и столько же образуется первичной мочи. Величина смешанного фильтрационно-реабсорбционного клиренса варьирует в зависимости от интенсивности реабсорбции тех или иных веществ в канальцах почек (в норме для глюкозы — 0, для мочевой кислоты — 10 — 15, для мочевины 75 мл/мин). Величина смешанного фильтрационно-секреторного клиренса больше фильтрационного и составляет для фенолрота 400 мл/мин, для парааминогиппуровой кислоты — 600 — 700 мл/мин. В последнем случае величина клиренса приближается к величине почечного кровотока (1300 мл/мин), если сделать перерасчет на показатель гематокрита. Нарушение функций клубочков нефронов Нарушение фильтрации. Нарушения диуреза прежде всего могут быть обусловлены изменениями величины клубочковой фильтрации (в норме от 100 до 140, в среднем 120 мл/мин). Различают почечные и внепочечные механизмы нарушения фильтрации. Уменьшение фильтрации возможно в следующих случаях: При снижении гидростатического давления на стенку капиллярных сосудов. Это в свою очередь может быть связано с падением артериально го давления ниже 80 мм рт. ст. вследствие шока и коллапса различного генеза, недостаточности кровообращения, уменьшения объема циркулирующей крови (рис. 23.1); уменьшением интенсивности кортикального почечного кровотока вследствие спазма приносящих артериол или органических изменений аорты, почечных артерий, внутрипочечных сосудов. При подъеме онкотического давления крови выше 25 — 30 мм рт. ст. вследствие гемоконцентрации из-за обезвоживания организма, при переливании больших объемов белковых кровезаменителей, а также при некоторых заболеваниях, протекающих с гиперпротеинемией. 3. При увеличении давления в капсуле клубочков выше 20 мм рт. ст., что наблюдается при замедленной реабсорбции жидкости в проксимальной части канальцев нефронов, при закупорке просвета канальцев цилиндрами, некротическими массами, при наличии препятствия для выделения мочи в мочевых путях (некроз, сгустки, камни, опухоли). При изменении состояния клубочкового фильтра — уменьшении количества функционирующих клубочков (в норме около 2 млн), общей фильтрационной поверхности (в норме около 1,5 м2), числа, площади и диаметра пор (в норме до 5 нм), увеличении толщины клубочковой мембраны (в норме 80 — 120 нм), ее физико-химических свойств. Подобные нарушения наблюдаются прежде всего при воспалительном процессе, непосредственно поражающем клубочковую мембрану (гломерулонефрит и др.). Повреждение почечного фильтра и, как следствие, уменьшение клубочковой фильтрации и диуреза могут наблюдаться при нарушении трофики клубочковой мембраны из-за нарушения кровоснабжения почек, гипоксии различного генеза, токсических влияний. На увеличение фильтрации влияют следующие факторы. Повышение гидростатического давления на стенку капиллярных сосудов клубочков, которое наблюдается при увеличении объема внутрисосудистой жидкости, при увеличении объемной скорости кортикального кровотока в связи с уменьшением тонуса приводящих артериол (в стадии подъема температуры при лихорадке, в условиях натрийизбыточной диеты); при повышении тонуса отводящих артериол в связи с нервно-рефлекторными и гуморальными влияниями, наблюдающимися в ранней стадии гипертонической болезни. Понижение онкотического давления крови (гипоальбуминемия), перераспределение белковых фракций крови в сторону преобладания грубодисперсных глобулинов, имеющих низкое онкотическое давление (при гепатите, циррозе печени). Повышение проницаемости клубочковой мембраны. Кардинальным признаком повышения проницаемости клубочковой мембраны является протеинурия — выделение с мочой плазменных белков сверх того количества, которое содержится в физиологических условиях (30 — 100 мг/сут), а также появление в моче белковых фракций с большой относительной молекулярной массой (свыше 70 000). Механизм протеинурии, обусловленной повышением проницаемости клубочкового фильтра, связывают, с одной стороны, с увеличением фильтрации вследствие увеличения диаметра пор, а с другой — с физико-химическими изменениями в базальной мембране, облегчающими диффузию или устраняющими электрический барьер для фильтрации. Такими изменениями со стороны клубочковой мембраны могут сопровождаться функциональные нарушения почечной гемодинамики, вызванные введением адреналина, норадреналина, возникающие в положении стоя у детей (ортостатическая протеинурия), при тяжелой работе (маршевая протеинурия), при потере жидкости у грудных детей (дегидратационная протеинурия), при охлаждении. Белок в моче может появиться после приема пищи с большим содержанием белков, особенно у детей (алиментарная протеинурия). Выраженность большинства из указанных функциональных протеинурий незначительна (обычно до 1 г/л); они исчезают после устранения соответствующих причин. В противоположность этому органические протеинурии (при остром и хроническом гломерулонефрите, нефротическом синдроме и других органических поражениях почек) отличаются стойким характером, нередко выраженной интенсивностью (при нефротическом синдроме — от 10 — 15 до 120 г/л), наличием в моче фракций плазменных белков с высокой относительной молекулярной массой 70 000 — 820 000 (неселективная протеинурия). Промежуточное положение занимает протеинурия при недостаточности кровообращения, при инфекционных заболеваниях и некоторых токсических состояниях, при тиреотоксикозе, механической и паренхиматозной желтухе, при энтероколите, кишечной непроходимости, ожогах. В тех случаях когда протеинурия не связана с поражением почек, а обусловлена воспалительным процессом в мочевых путях, ее называют внепочечной, или ложной, протеинурией (белка обычно не более 1 г/л). Повреждение клубочковой мембраны, в частности стенки капиллярных сосудов, может сопровождаться выходом эритроцитов в просвет канальцев и появлением их в моче (почечная клубочковая гематурия), часто в виде "теней" (выщелоченные эритроциты). Такая гематурия является одним из ведущих симптомов очагового нефрита, острого и хронического гломерулонефрита. Почечную гематурию следует отличать от внепочечной, обусловленной травмой или воспалением мочевых путей. Отличительными признаками внепочечной гематурии являются наличие в мочевом осадке большого количества свежих невыщелоченных эритроцитов и "белково-эритроцитарная диссоциация" (отсутствие органической протеинурии). Нарушение экскреции веществ. Важнейшими патофизиологическими проявлениями нарушения функции клубочков, возникающими в связи с уменьшением фильтрации, являются задержка выведения из организма продуктов азотистого обмена и повышение их концентрации (остаточного азота) в крови — азотемия. Последняя обусловлена главным образом накоплением в крови мочевины, мочевой кислоты, креатина, креатинина, эрготианина, аммиака, в меньшей степени аминокислот, а также токсических продуктов, образующихся при гниении в кишках, — индикана, фенолов, индола, скатола. Уровень азотемии может быть различным — от едва превышающего верхнюю границу нормальных величин остаточного азота (35,7 ммоль/л) до 142,8 — 357 ммоль/л. Определяющим фактором является степень снижения величины клубочковой фильтрации. В результате нарушения экскреторной функции клубочков задерживается выведение фосфатов, сульфатов и органических кислот и повышается концентрация их в крови — гиперфосфатемия, гиперсульфатемия, гиперацидемия. Анионы указанных веществ во внекле точной жидкости вытесняют гидрокарбонаты, уменьшают щелочной резерв крови (до 18 — 13,5 ммоль/л, в норме — 25 — 31 ммоль/л), что приводит к развитию ацидоза (ренальный азотемический ацидоз). Задержка выведения из организма электролитов (ионов калия, натрия, магния и хлора) и перераспределение их между внеклеточным и внутриклеточным пространством — накопление ионов магния и калия во внеклеточном, в том числе в крови (гиперкалиемия, гипермагниемия), а натрия — во внутриклеточном секторе с понижением концентрации в плазме крови натрия (гипонатриемия) и хлора (гипохлоремия) — являются результатом нарушения функционирования натрий-калиевого насоса, которое возникает вследствие развития азотемического ацидоза. Ему сопутствует развивающаяся гипергидратация, которая может быть как вне-, так и внутриклеточной. Характеристика нарушений диуреза. Механизмы полиурии, олигурии, анурии. Нарушение основных функций почек Количество мочи, образуемой почками в единицу времени, равно разности между количеством жидкости, профильтровавшейся в клубочках и реабсорбировавшейся в канальцах. Увеличение суточного количества мочи — диуреза (в норме 1,5 л), называется полиурией, уменьшение (меньше 500 мл/сут) — олигурией, отсутствие отделения мочи или уменьшение суточного диуреза ниже 100 мл — анурией. К этому могут вести как нарушения функций клубочков или канальцев, так и сопряженности (дисфункция) их деятельности. В клинике и эксперименте используют различные методы для определения характера и степени нарушений основных почечных функций. Весьма информативным является определение показателя очищения — клиренса (от англ. Clear — ясный, светлый, прозрачный). Он отражает количество плазмы или сыворотки крови (в миллилитрах), которое полностью очищается от данного экзогенного или эндогенного вещества при прохождении через почки за 1 мин. Патологические составные части мочи. Диагностическое значение. Практически при всех заболеваниях почек и мочевыводящих путей в моче появляются те или иные отсутствующие в ней в норме компоненты: белок, эритроциты, лейкоциты, цилиндры. Протеинурия в сочетании с гематурией, лейкоцитурией и цилиндрурией объединяется в понятие «мочевой синдром». Протеинурия (выделение белка с мочой) может быть физиологической и патологической. Небольшая потеря белка (до 100 мг в сутки) возможна у практически здорового человека. Появление преходящей протеинурии может наблюдаться у ряда лиц после употребления обильной белковой пищи (алиментарная протеинурия), под влиянием сильного нервного напряжения, например, у студентов во время экзаменов (эмоциональная протеинурия), после большой физической нагрузки (рабочая или маршевая протеинурия), при длительном нахождении тела в вертикальном положении (ортостатическая протеинурия). Физиологическая протеинурия в подавляющем большинстве случаев незначительна и не превышает 1.0 г белка в сутки. Тем не менее, повторное обнаружение даже незначительной протеинурии должно настораживать врача и служить основанием для тщательного обследования и поиска возможного поражения почек. Патологическая протеинурия рассматривается в качестве одного из наиболее важных признаков заболевания почек. Главными факторами ее генеза являются повышение проницаемости клубочкового фильтра (базальной мембраны) для белков плазмы и снижение канальцевой реабсорбции профильтровавшегося в первичную мочу белка. Секреция белка клетками патологически измененного эпителия канальцев и выделение белка вследствие тубулорексиса (распада клеток канальцевого эпителия) играют второстепенную роль. Кроме почечной протеинурии, связанной с поражением клубочков и канальцев, выделяют протеинурию непочечного происхождения, которая может быть преренальной и постренальной. Преренальная протеинурия обусловлена действием на организм ряда патогенных факторов (охлаждение, длительная инсоляция), а также заболеваниями или патологическими состояниями (синдром размозжения, выраженный гемолиз, анафилаксия и др.), которые приводят к изменению концентрации белка в плазме, качества и количества белковых фракций, появлению патологических белков (например, белка Бенс-Джонса при миеломной болезни и других парапротеинов). Постренальная протеинурия обусловлена выделением с мочой слизи и белкового экссудата при воспалении мочевыводящих путей. Преренальная и постренальная протеинурия встречаются сравнительно редко и бывают незначительными (не более 1.0 г белка в сутки). При массивной протеинурии, свойственной нефротическому синдрому, потеря белка с мочой превышает 3.0-3.5 г в сутки. При так называемой немассивной протеинурии суточная потеря белка - ниже 3.0 г. Гематурия (эритроцитурия) - патологическое явление, характеризующееся выделением с мочой эритроцитов. О гематурии можно говорить в тех случаях, когда количество эритроцитов, выделяемых с мочой, в течение суток превышает 2•106. В зависимости от интенсивности экскреции эритроцитов различают микрогематурию, при которой цвет мочи макроскопически не меняется, а при световой микроскопии отмечается наличие в моче более 13 эритроцитов в поле зрения. При макрогематурии моча приобретает цвет «мясных помоев», а количество выделяемых эритроцитов не поддается подсчету. Для того, чтобы дифференцировать причину гематурии (в зависимости от отдела мочевыводящих путей, откуда поступают эритроциты), в клинике при макрогематурии применяют так называемую «трехстаканную пробу». Ее суть заключается в следующем. Во время одного мочеиспускания больной последовательно мочится в три сосуда. Если кровь появляется в первой порции, скорее всего ее источником являются мочеточники, если в третьей, то можно предполагать наличие процесса в мочевом пузыре, поскольку перед прекращением мочеиспускания наступает спазм мочевого пузыря и поступление эритроцитов в мочу может усиливаться (они «выжимаются» в мочу). Наличие крови во всех трех порциях говорит о том, что, либо поражены почечные лоханки, либо сами почки. Кроме того, важное значение имеет микроскопия мочевого осадка наличие бледных («выщелоченных») эритроцитов говорит об их длительном пребывании в мочевом пузыре, что чаще всего бывает при поражении верхних мочевыводящих путей. Лейкоцитурия представляет собой экскрецию с мочой лейкоцитов, количество которых превышает норму: при микроскопии - более 56 в поле зрения или при исследовании суточной мочи - более 4•106 в сутки. Как и гематурия, лейкоцитурия может указывать на повреждение и почек, и мочевыводящих путей. Цилиндрурия - экскреция с мочой цилиндров, которые представляют собой образующийся в просвете канальцев слепок из белка и (или) клеток. В зависимости от того, какие частицы и в каком количестве покрывают белковый слепок, различают гиалиновые, (не реабсорбировавшийся в проксимальных отделах канальцев и свернувшийся сывороточный белок), зернистые (дистрофически измененные и некротизированные клетки эпителия проксимальных отделов канальцев), восковидные (погибшие клетки эпителия дистальных отделов канальцев), эритроцитарные и лейкоцитарные цилиндры. При жировой дегенерации почек в моче могут обнаруживаться жировые цилиндры. Все цилиндры имеют исключительно почечный генез, так как они образуются только в почечных канальцах и всегда свидетельствуют о поражении почек. Этиология и патогенез нефритов. Основные клинические проявления. Патогенез гипертензии и отеков при нефритах. Гломерулонефрит Гломерулонефрит является наиболее часто встречающимся двусторонним диффузным заболеванием почек воспалительной природы. Разнообразные изменения в клубочках нефронов представляют собой сочетание развивающихся интракапиллярно экссудативного и пролиферативного процессов. При тяжелом течении заболевания вследствие некротических изменений наблюдается полная деструкция клубочков. В патологический процесс вовлекается практически вся масса клубочков обеих почек. Различают острый и хронический (диффузный) гломерулонефрит. Острый (диффузный) гломерулонефрит. Экспериментальные модели. В 1901 г. В. К. Линдеман в лаборатории И. И. Мечникова наблюдал основные проявления нефрита у кролика при внутривенном введении ему нефротоксической сыворотки морской свинки, предварительно иммунизированной взвесью кроличьей почки. Используя аналогичную схему постановки опытов, японский ученый Masugi в 1933 г. воспроизвел клиническую картину нефрита у кроликов при введении им сыворотки крови уток, иммунизированных тканью почек кроликов. Другой вариант модели нефрита Masugi осуществлен по схеме крыса — кролик — крыса. В настоящее время в патогенезе экспериментального гломерулонефрита различают две фазы: гетерологичную, обусловленную фиксацией нефротоксических антител (IgG, IgM) на базальной мембране клубочков нефрона, и аутологичную, связанную с выработкой комплементфиксирующих антител на нефротоксический глобулин. Некоторые авторы допускают возможность и третьей, или аутоиммунной, фазы, обусловленной антителами к измененным сосудистым клубочкам. В 1909 г. русский хирург П. А. Герцен, пытаясь выяснить механизм возникновения "окопного" нефрита (нефрит военного времени), получил его экспериментальную модель у кролика путем охлаждения (замораживания хлорэтилом) почки. При этом в крови подопытных животных были обнаружены специфические противопочечные антитела. Особенностью данной модели было поражение не только поврежденной, но и интактной почки. Данная модель впервые навела на мысль о возможности аутоиммунной природы данного заболевания. Итальянскими учеными супругами Ковелти (1945) был получен гломерулонефрит у кроликов путем введения им в брюшную полость клеточной взвеси почечной ткани и культуры стрептококков. С достаточной надежностью острый гломерулонефрит воспроизводится путем введения животным чужеродного белка, сыворотки. R. W. Stablay (1962) воспроизвел гломерулонефрит у овец при иммунизации их базальными мембранами клубочков нефрона почки человека в полном адъюванте Фрейнда. W. Heymann и соавт. (1965) воспроизвели экспериментальный нефрит у крыс путем их активной иммунизации взвесью гомологичной или аутологичной почки с полным адъювантом Фрейнда. У новозеландских мышей линии NZB/BL спонтанно возникают серологические и морфологические признаки аутоиммунного гломерулонефрита и других аутоиммунных заболеваний: системной красной волчанки, аутоиммунной гемолитической анемии. На базальной мембране пораженных клубочков . обнаружен аутологичный у-глобулин, представляющий собой аутоантитела к почечным аутоантигенам. Появление заболевания регистрируется с 3 — 5-месячного возраста. |
