Дыхание и обмен веществ. Вопросы коллоквиума по разделам Физиология крови
 Скачать 2.87 Mb. Скачать 2.87 Mb.
|
|
10. Гемоглобин, его функции. Виды, соединения гемоглобина, их функциональное значение. Гемоглобин – особый белок хромопротеида, благодаря которому эритроциты выполняют дых. функцию и поддерживают рН крови. У мужчин = 130-160 г/л, у женщин – 120-150 г/л, у беременных – 110 г/л. Гемоглобин сост. из желкосодержающих групп гема (4%) и белкового остатка глобина (96%). Гем состоит из молекулы порфирина, в центре которой расположен ион Fe2+, способный присоединять 02. Большая часть гемоглобина взрослого человека (95—98%) состоит из фракции А; от 2 до 3% всего гемоглобина приходится на фракцию А2; наконец, в эритроцитах взрослого человека находится так называемый гемоглобин F (1—2 %.) Гемоглобин F содержится преимущественно у плода. К моменту рождения ребенка на его долю - 70—90 %. Гемоглобин F имеет большее сродство к О2, чем гемоглобин А, что позволяет тканям плода не испытывать гипоксии, несмотря на низкое напряжение кислорода в его крови. Соединения: Гемоглобин, присоединивший к себе О2, превращается в оксигемоглобин. Это соединение непрочное. В виде оксигемоглобина переносится большая часть кислорода. Гемоглобин, отдавший кислород, называется восстановленным, или дезоксигемоглобином. Гемоглобин, соединенный с СО2, носит название карбгемоглобина. Это соединение также легко распадается. В виде карбгемоглобина переносится 20% углекислого газа. Соединение гемоглобина с СО наз. карбоксигемоглобином, которое явл. прочным соединением. Гемоглобин блокирован в нем угарным газом и неспособен осущ. перенос О2. Сродство гемоглобина к угарному газу выше его сродства к кислороду, поэтому даже небольшое количество угарного газа в воздухе является опасным для жизни. При некоторых пат. состояниях, например, при отравлении сильными окислителями (бертолетовой солью, перманганатом калия и др.) образуется прочное соединение гемоглобина с О2 — метгемоглобин, в котором происходит окисление Fe 2+ = Fe 3+. В результате этого гемоглобин теряет способность отдавать О2 тканям, что может привести к гибели человека. В скелетных и сердечной мышцах находится мышечный гемоглобин, называемый миоглобином. Он играет важную роль в снабжении кислородом работающих мышц. Ряд заболеваний связан с появлением в крови патологических форм гемоглобина. Наиболее известной наследственной патологией гемоглобина является серповидноклеточная анемия. Форма эритроцитов напоминает серп. Отсутствие или замена нескольких аминокислот в молекуле глобина при этом заболевании приводит к существенному нарушению функции гемоглобина. В клин. условиях принято вычислять степень насыщения, эртроцитов гемоглобином – цветной показатель. В норме =1 (нормохромные). <1,1 – гиперхромные, >0,85 – гипохромные. 11. Понятие о эритропоэзе, его нервной и гуморальной регуляции. Эритроцитарная система включает циркулирующие эритроциты, органы их образования, депонирования и разрушения, а также аппарат нервно-гуморальной регуляции этих органов. Термином эритрон обозначают сумму клеток красного ряда в сосудистом русле и органах кроветворения. Эритроциты образуются в красном костном мозге грудины, тазовых и других костей. В сутки в циркуляцию поступает примерно 20 —25*1010 эритроцитов, так что за всю жизнь в среднем их образуется около 500 кг. При стимуляции эритропоэза (недостаток кислорода, кровопотеря, повышенный гемолиз) его уровень может быть увеличен в 6—8 раз, по некоторым данным — даже в 10—12 раз. Высокая интенсивность эритропоэза делает его зависимым от поступления с пищей ряда веществ, недостаток которых ведет к снижению продукции эритроцитов и анемии (это нередко наблюдается у беременных женщин). К таким веществам в первую очередь относятся белки, железо, микроэлементы, в особенности медь и кобальт, витамины — В12, фолиевая кислота, витамин С. 1) Потребность в железе более чем на 90 % удовлетворяется утилизацией его из гемоглобина распавшихся эритроцитов, остальное же кол-во должно поступать с пищей. Медь и витамин С способствуют всасыванию железа в пищевар. тракте и его участию в синтезе гема. Кобальт стимулирует синтез эритропоэтина и входит в состав витамина В12. Последний вместе с фолиевой кислотой необходим для клеточного деления. В пищевар. тракте этот витамин всасывается в комплексе с так называемым внутренним антианемическим фактором. 2) Эритропоэз стимулируют СТГ, АКТГ, глюкокортикоиды, тироксин, андрогены, продукты разрушения эритроцитов, эстрогены тормозят его. 3) В красном костном мозге эритроциты, лейкоциты и тромбоциты образуются из полипотентных стволовых кроветвор. клеток. В каком из трех направлений пойдет развитие клетки, т. е. переход в стадию унипотентной кроветвор. клетки, определяется ее микроокружением: клетками стромы и факторами основного вещества соединительной ткани — локальная регуляция кроветворения. В свою очередь способность унипотентных клеток к развитию в заданном направлении реализуется под влиянием специф. гуморальных факторов, циркулирующих в крови, — гемопоэтинов (дистантная регуляция кроветворения). Решающую роль в эритропоэзе играет эритропоэтин — пептидный гормон группы кислых гликопротеинов. Он постоянно циркулирует в крови, стимулируя деление, созревание клеток красного ряда, а также выход в циркуляцию в виде ретикулоцитов. Эритропоэтин синтезируется в почках — в перитубулярных интерстициальных клетках коркового слоя. Экстраренально (в печени) продуцируется не более 10 % эритропоэтического гормона. В печени же разрушается некоторая его часть, но в основном он выводится из организма с мочой. Синтез эритропоэтина повышается при гипоксии любого происхождения, возникающей, например, при подъеме в горы, многократной экспозиции в барокамере с пониженным атмосферным давлением, при мышечной тренировке. Гипоксическая стимуляция имеет место и при многих пат. состояниях: кровопотере, легочной или сердечной недостаточности и др. В результате происходит стойкое увеличение кол-ва эритроцитов как в единице ОЦК, так и в организме в целом — эритроцитов истинный, или абсолютный. При ишемии почки в остром или хроническом эксперименте (сужение почечной артерии) содержание эритропоэтина в плазме крои возрастает. Выход эритропоэтина из почки и начальная активация его синтеза контролируются рефлекторным механизмом: хеморецепторы каротидных синусов — гипоталамус — спинной мозг — симпат. нервы почки. У животных в эксперименте при выключении любого отдела этой рефлекторной дуги гипоксическая стимуляция эритропоэза сохраняется, но развитие ее замедляется. Т. о., механизм этой стимуляции нервно-гуморальный, центральное место в нем занимает почечный эритропоэтин, скорость включения которого обеспечивается СНС. При гипоксии активируются функции гипоталамо-гипофизарной системы с участием коры надпочечников и щит. железы. Это способствует стимуляции эритропоэза путем активации синтеза эритропоэтина, а также прямого действия на красный костный мозг. В том же направлении влияют продукты гемолиза, интенсивность которого повышается (в начальной стадии гипоксии увеличивается разрушение старых эритроцитов). При чрезмерной конц. эритроцитов и гемоглобина в крови и тканях возникает состояние относительного избытка кислорода, следствием чего является торможение эритропоэза. Это имеет место при перемещении на равнину людей и животных, адаптированных к горной местности, а также при прекращении тренировок в барокамере с пониженным атмосферным давлением и при гиподинамии. В таких случаях плазма крови приобретает ингибирующие свойства — способность тормозить эритропоэз. В результате концентрация эритроцитов, циркулирующих в крови, снижается до уровня, достаточного для удовлетворения потребности организма в кислороде. Таким образом, при недостатке кислорода повышается выработка эритропоэтина и эритропоэз стимулируется, при избытке кислорода вырабатывается ингибитор и эритропоэз тормозится. 4) Разрушение старых эритроцитов происходит в мононуклеарной фагоцитирующей системе, представленной клетками селезенки и печени. От 5 до 20% эритроидных клеток разрушается непосредственно в красном костном мозге, не завершив полного цикла развития. После денервации каротидных синусов или селезенки разрушение эритроцитов возрастает. Это свидетельствует о влиянии нервной системы на процессы гемолиза. 12. Процесс свертывания крови, его значение. Основные факторы, участвующие в процессе свертывания, их функциональная характеристика. Основные компоненты системы гемостаза: сосудистая стенка, в особенности ее эндотелиальная выстилка и субэндотелий, клетки крови и плазменные ферменты системы – свертывающая, фибринолтическая, каллекреин-кининовая, комплемента, а также механизмы регуляции; Процесс свёртывания крови – гемокоагуляция – закл. в переходе растворимого белка плазмы крови фибриногена в нерастворимое состояние – фибрин. В результате кровь их жидкого состояния переходит в студнеобразное, образуется сгусток, который закрывает просвет повреждённого сосуда. Факторы, участвующие в свёртывании крови, содержатся в плазме, ФЭК и тканях. Все факторы, кроме Са2+ = белки, бол-во – ферменты, активирующиеся в процессе свёртывания крови. основная часть плазменных факторов образуются в печени, и для образования бол-ва из них необходим витамин К. Основные плазменные факторы свёртывания крови: фибриноген, протромбин, тканевой тромбопластин, Са2+. Факторы V–XIII – акцелераторы, доп. факторы, ускоряющие процесс свёртывания.
13. Понятие о сосудисто-тромбоцитарном, коагуляционном гемостазе. Фазы сосудисто-тромбоцитарного гемостаза, их характеристика. Гемостаз - комплекс реакций, направленный на остановку кровотечения при травме сосудов. Основными задачами системы гемостаза являются сохранение жидкого состояния циркулирующей и депонированной крови, регуляция транскапиллярного обмена, резистентности сосудистой стенки. Различают сосудисто-тромбоцитарный гемостаз и коагуляционный. В первом случае речь идет об остановке кровотечения из мелких кров. сосудов с низким кровяным давлением, d не более 100 мкм за счёт: 1) спазма сосудов; 2) образования тромбоцитарной пробки; 3) сочетания того и другого. Во втором случае — о борьбе с кровопотерей при повреждении артерий и вен. С 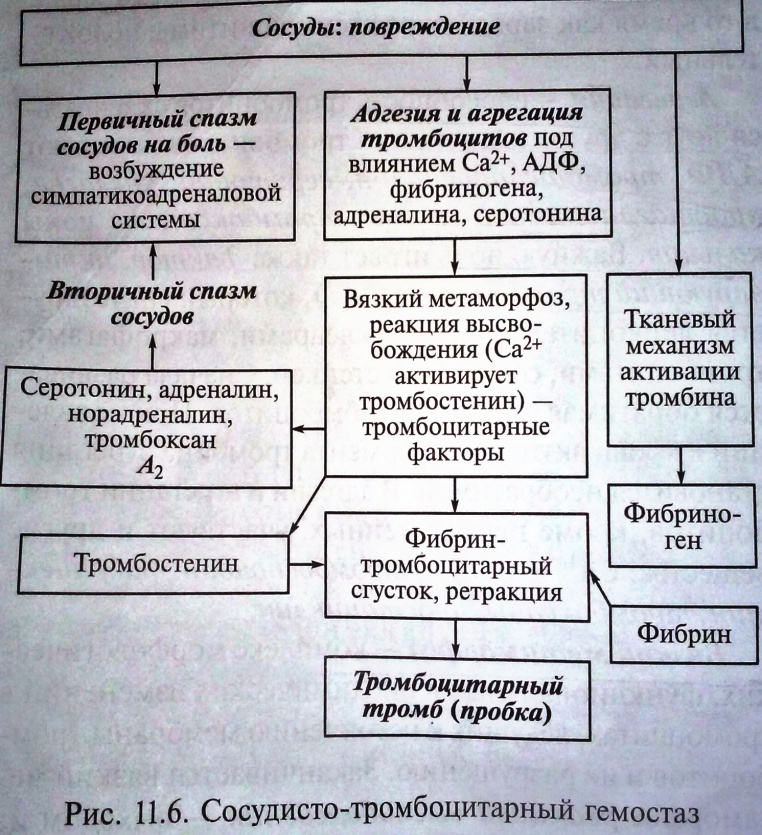 осудисто-тромбоцитарный гемостаз сводится к образованию тромбоцитарной пробки, или тромбоцитарного тромба. Он разделяется на 3 стадии: 1) временный (первичный и вторичный) спазм сосудов; 2) образование тромбоцитарной пробки за счет адгезии (прикрепления к поврежденной поверхности) и агрегации (склеивания между собой) кровяных пластинок; 3) ретракция (сокращение и уплотнение) тромбоцитарной пробки. осудисто-тромбоцитарный гемостаз сводится к образованию тромбоцитарной пробки, или тромбоцитарного тромба. Он разделяется на 3 стадии: 1) временный (первичный и вторичный) спазм сосудов; 2) образование тромбоцитарной пробки за счет адгезии (прикрепления к поврежденной поверхности) и агрегации (склеивания между собой) кровяных пластинок; 3) ретракция (сокращение и уплотнение) тромбоцитарной пробки.Сразу после травмы наблюдается первичный спазм кров. сосудов, благодаря чему кровотечение в первый момент может не возникнуть или носит ограниченный характер. Первичный спазм сосудов обусловлен выбросом в кровь в ответ на болевое раздражение адреналина и норадреналина и длится 10—15 с. В дальнейшем наступает вторичный спазм, обусловленный активацией тромбоцитов и отдачей в кровь сосудосуживающих агентов — серотонина, тромбоксана А2 (ТхА2), адреналина и др. Повреждение сосудов сопровождается немедленной активацией тромбоцитов, что связано с появлением высоких конц. АДФ (из разрушающихся эритроцитов и травмированных сосудов), а также обнажением субэндотелия, коллагеновых и фибриллярных структур. После травмы сосуда наступает адгезия тромбоцитов к коллагену и др. белкам субэндотелия. При низком напряжении сдвига, возникающего при повреждении крупных артерий и вен, тромбоциты адгезируют непосредственно к волокнам коллагена через коллагеновые рецепторы. При высоком напряжении сдвига, наблюдаемого при травме мелких артерий и артериол, прилипание тромбоцитов обусловлено наличием в плазме, кровяных пластинках, а также эндотелии особого белка — фактора фон Виллебранда (vWF), имеющего 3 активных центра. Два из них связываются с рецепторами тромбоцитов, а один — с субэндотелием или коллагеновыми волокнами. Т.о., тромбоцит с помощью vWF оказывается «подвешенным» к травмированной поверхности сосуда. Из адгезирующих тромбоцитов, как и из поврежденного эндотелия, высвобождается АДФ, являющаяся индуктором агрегации. Под влиянием АДФ тромбоциты прилипают к присоединившимся к эндотелию кровяным пластинкам, а также склеиваются между собой, образуя агрегаты, являющиеся основой тромбоцитарной пробки. Усилению агрегации способствуют фактор активации тромбоцитов (ФАТ), а также тромбин. Под воздействием слабых агонистов, в том числе АДФ, наступает экспрессия рецепторов к фибриногену на мембране тромбоцитов, благодаря чему в присутствии ионов Са2+ фибриноген связывает между собой 2 близлежащие кровяные пластинки. Однако на этом этапе агрегация носит обратимый характер, так как вслед за агрегацией может наступить частичный или полный распад агрегатов — дезагрегация. Такая агрегация называется первичной, или обратимой. Механизм вторичной агрегации более сложен. Для завершения гемостаза требуется присоединение ряда дополнительных механизмов активации с включением обратных связей (обратная афферентация в пределах тромбоцита). Слабые агонисты (АДФ) приводят к поступлению сигнала внутрь кровяных пластинок, в результате чего в них увеличивается содержание цитоплазм-ого Са2+ и наступает активация фосфолипазы А2. Последняя приводит к освобождению из мембраны тромбоцита арахидоновой кислоты, которая превращается в активные соединения — простагландины PgG2, PgH2 и ТхА2. ТхА2 вызывает выделение ионов Са2+ из плотной тубулярной системы в цитоплазму. В итоге происходит сокращение актомиозина тромбоцитов. При этом кровяные пластинки подтягиваются друг к другу, тромбоцитарная пробка уплотняется, т.е. наступает ее ретракция. Из тромбоцитов, подвергшихся адгезии и агрегации, секретируются гранулы и содержащиеся в них БАВ — АДФ, ФАТ, адреналин, норадреналин, ТхА2, фибриноген и др. Всё это значительно укрепляет тромбоцитарный тромб. Кроме того, из кровяных пластинок выделяется митогенный фактор, необходимый для репарации поврежденных стенок сосудов. Одновременно с высвобождением тромбоцитарных факторов образуется тромбин, усиливающий агрегацию и приводящий к появлению сети фибрина (рис. 5.1). В норме остановка кровотечения из мелких сосудов занимает от 2 до 4 мин. Эндотелиальными клетками под влиянием фермента простациклинсинтетазы образуется РgI2. В физиолог. условиях действие РgI2, ингибирующего агрегацию, преобладает над ТхА2 — агрегирующим агентом тромбоцитов. Поэтому в циркуляции у здорового человека агрегация тромбоцитов носит ограниченный характер. При повреждении эндотелия в месте травмы образование РgI2 нарушается, в результате чего начинает преобладать действие ТхА2 и создаются благоприятные условия для агрегации тромбоцитов и образования тромбоцитарной пробки. |
