Всем удачи!! Золь иодида серебра AgI получен в избытке раствора йодида калия. Определите заряд частиц полученного золя, напишите формулу его мицеллы и укажите,
 Скачать 0.93 Mb. Скачать 0.93 Mb.
|
|
Ответ: Скорость реакции увеличится в 128 раз. 42. Что произойдет с эритроцитами при 310 К в 2-% растворе глюкозы (ρ=1,006 г/мл)? Эталон решения Эритроциты в гипотонических растворах за счет эндосмоса разрушаются, происходит гемолиз, а в гипертонических растворах сморщиваются (плазмолиз). Осмотическое давление определяется по закону Вант-Гоффа pосм= с(Х)×R×T, где с(Х) = 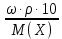 pосм= 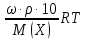 = =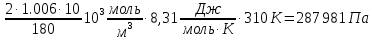 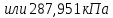 Ответ: pосм. крови= 740-780 кПа, поэтому данный раствор гипотоничен по отношению к крови, произойдет гемолиз. 43. Рассчитать изотонический коэффициент Вант-Гоффа для АlСl3, если «кажущаяся» степень диссоциации 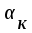 = 80%. = 80%.Эталон решения В растворе сильного электролита изотонический коэффициент рассчитывается по формуле: i = 1 + 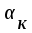 ∙(n – 1). ∙(n – 1).Степень диссоциации 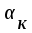 выражается в долях единицы и равна 0,8. Для расчета n, т.е. числа ионов, на которые диссоциирует электролит, необходимо написать уравнение диссоциации: выражается в долях единицы и равна 0,8. Для расчета n, т.е. числа ионов, на которые диссоциирует электролит, необходимо написать уравнение диссоциации:AlCl3 Таким образом: n = 4, i = 1 + 0,8(4 – 1) = 3,4. 45. Рассчитать буферную емкость крови, если добавление к 50 мл крови 20 мл раствора HCl c C(HCl) = 0,05 моль/л вызвало снижение pH крови от 7,4 до 7,0. Эталон решения. Буферную емкость крови по кислоте рассчитаем по формуле 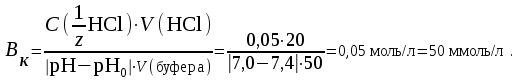 Ответ: 50 ммоль/л Ответ: 50 ммоль/л46. Чтобы изменить рН на единицу, к 10 мл ацетатного буферного раствора потребовалось добавить 0,52 мл 1М раствора NaOH. Найти буферную емкость по щелочи (моль/лед.рН) данного буферного раствора. Эталон решения Буферную емкость по щелочи можно определить по формуле: Восн. = 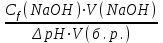 = = = =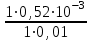 = 0,052 моль/л.ед. рН = 0,052 моль/л.ед. рНОтвет: 0,052 моль/лед. рН 48. Для комплексного соединения [Сr(NН3)5Br]Br2 определить заряд комплексообразователя, указать координационное число (к.ч.), дать название по международной номенклатуре, написать уравнения первичной и вторичной диссоциации и составить выражение для константы нестойкости комплексного иона. Эталон решения 1) заряд комплексного иона равен +2, следовательно, алгебраическая сумма зарядов внутренней сферы: x + 0 1 = 2, x = +3; 2) все лиганды монодентатные, следовательно, к.ч. = 6; 3) название: бромид бромопентамминхрома (III); 4) уравнения диссоциации: [Сr(NН3)5Br]Br2 [Сr(NН3)5Br]2+ ⇄ Сr3+ + 5NН3 + Br (вторичная). 5) выражение для константы нестойкости: 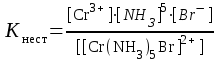 . . 50. Укажите направление реакции при стандартных условиях: 2Сr³+ + 3Br2 + 7H2O = Cr2O72- + 6Br-+ 14H+ Ecли: φº Br2/2Br- = +1,076 B φº Cr2O7 2-/2Cr³+ = +1,36 B Ответ поясните. Эталон ответа Для определения направления ОВР реакции можно пользоваться величиной её Э.Д.С. Э.Д.С. О.В.Р. численно равна разности потенциалов ОВ пар, участвующих в реакции; О.В.Р. протекает самопроизвольно, если её Э.Д.С. >0; Э.Д.С.= 1,076 - 1,36 = -0,284 (В). Приведённая реакция будет идти в обратном направлении при стандартных условиях, от сильного окислителя к слабому сопряженному восстановителю, т.е. в обратном направлении. 51. В процессе тканевого дыхания происходит перенос протонов водорода и электронов от окисляемого субстрата на кислород с участием переносчиков, функцию которых выполняют ферменты. Исходя из значений окислительно-восстановительных потенциалов, составьте электронно-транспортную цепь последовательного переноса протонов и электронов от субстрата на акцептор.
СДО (взяла из файла других ребят) Задача 2. Определить изменение энтальпии химической реакции: 2С2Н5ОН(ж) → С2Н5-О-С2Н5(ж) + Н2О(ж) , используя следующие данные: ΔН0сгор С2Н5ОН(ж) = –1370,00 кДж·моль-1 ΔН0сгор С2Н5ОС2Н(ж) = –2720,04 кДж·моль-1 ΔН0сгор Н2О(ж) = 0 кДж·моль-1 Решение: Поскольку даны энтальпии сгорания реагентов и продуктов, то используя 2-ое следствие из закона Гесса запишем: ΔН0р-я = ∑ΔН0сгор. реагентов – ∑ΔН0сгор. продуктов Применительно к этой реакции: ΔН0р-я = 2ΔН0сгорС2Н5ОН(ж) –ΔН0сгорС2Н5ОС2Н5(ж) = 2 · (–1370,00) – (–2720,04) = -2740,00 + 2720,04 = –19,96 кДж·моль-1. Ответ: ΔН0р-я = –19,96 кДж·моль-1. Задача 3. Вычислить стандартную энтальпию реакции: 2C2H5OH(жидк.)C2H5OC2H5(жидк.)H2O(жидк.) по значениям стандартных энтальпий сгорания веществ: C2H5OC2H52727 кДж/моль. Решение. Запишем выражение второго следствия из закона Гесса с учетом того, что стандартная энтальпия сгорания воды (высший оксид) равна нулю: 2C2H5OHC2H5OC2H5. Подставим значения стандартных энтальпий сгорания веществ, участвующих в реакции: 2(1368) (2727). Получим: 9 кДж. Задача 4. Вычислить стандартную энергию Гиббса реакции гидратации сывороточного альбумина при 250С, для которой H0 6,08 кДж/моль, S0 5,85 Дж/(мольК). Оценить вклад энтальпийного и энтропийного фактора. Решение. Стандартную энергию Гиббса реакции рассчитаем по формуле: G0H0TS0. Подставив значения, получим: G06,08 кДж/моль 298 К(5,85103) кДж/(мольК) 4,34 кДж/моль. В данном случае энтропийный фактор препятствует протеканию реакции, а энтальпийный благоприятствует. Самопроизвольное протекание реакции возможно при условии, если , т.е., при низких температурах. Ответ: G0р-я= –4, 34кДж·моль-1 Задача 5. Для стандартных условий вычислите изобарно-изотермический потенциал реакции: Аl2О3(т) + 3Н2О(ж) = 2Аl(ОН)3(т) Справочные данные: ΔН0обр, кДж/моль ΔS0, Дж/(моль К) Аl2О3(т) = –1676, 8 50,95 Аl(ОН)3(т) = –1277,0 82,9 Н2О(ж) = –286,02 70,0 Решение: по 1-му следствию закона Гесса рассчитываем ΔН0х.р.: ΔН0х.р. = 2ΔН0обр(Аl(ОН)3(т)) - ΔН0обр(Аl2О3(т)) - 3ΔН0обр(Н2О(ж)) = –19,14 кДж/моль. ΔS0х.р. = 2ΔS0(Аl(ОН)3(т)) - ΔS0(Аl2О3(т)) - 3ΔS0(Н2О(ж)) = –95,15 Дж/(моль К) = - 0,09515 кДж/моль. ΔG0 = ΔН0 – TΔS0 = –19,14 – 298 (–0,09515) = 9,215 кДж/моль. Ответ: ΔG0 = –1706,93 кДж/моль, т.е. процесс идет самопроизвольно. ПЗ 4 Условие_задачи_№1'>Эталоны решения задач Задача 1. В сосуде смешали газ А количеством вещества 4,5 моль и газ В количеством вещества 3 моль. Газы А и В реагируют в соответствии с уравнением А В С. Через некоторое время в системе образовался газ С количеством вещества 2 моль. Какие количества непрореагировавших газов А и В остались в системе? Решение. Из уравнения реакции следует, что: n(A) n(B) n(C) 2 моль, где n ‑ изменение количества вещества в ходе реакции. Следовательно, в сосуде осталось: n2(A) n1(А) n(A); n2(A) (4,5 2) моль 2,5 моль; n2(B) n1(B) n(B); n2(B) (3 2) моль 1 моль. Ответ: n2(A) 2,5 моль; n2(B) 1 моль Задача 2. Во сколько раз увеличится скорость химической реакции при повышении температуры от Решение. Дано: 𝑇1=100C 𝑇2=800С 𝛾=2 Найти: 𝑣2/ 𝑣1-? Решение: По правилу Вант-Гоффа: 𝑣2=𝑣1 ∗𝛾[(𝑇2−𝑇1)\10] 𝑣2/ 𝑣1= 𝛾[(𝑇2−𝑇1)\10] Подставив значения, получим: 𝑣2/ 𝑣1= 𝛾[(80−10)\10] =27=128 Ответ: Скорость реакции увеличится в 128 раз. Задача 3. При изучении кинетики выведения лекарственного препарата из организма больного было установлено, что за 3 часа в организме пациента осталось 50% от исходного количества лекарственного средства. Определить период полувыведения и константу скорости реакции выведения препарата из организма человека, если известно, что это реакция первого порядка. Решение. Так как за данный промежуток времени из организма было выведено 50% препарата, то 1/2 3 часа. Константу скорости реакции рассчитаем из уравнения: Ответ: 0,231ч Эталоны решения задач Условие задачи №1 Над раствором какого вещества [мочевина, CuSO4, Al2(SO4)3] давление пара растворителя больше, если температура и мольные доли равны? Эталон решения: Коллигативные свойства растворов зависят от числа кинетических единиц в растворе. В растворе мочевины (неэлектролит) наименьшее число частиц (ν=1), следовательно, над этим раствором давление пара растворителя будет наибольшим, а самое низкое – над раствором алюминия сульфата (электролит). CuSO4 ↔ Cu2+ + SO42- (ν = 2); Al2(SO4)3 ↔ 2Al3+ + 3SO42- (ν = 5). Условиезадачи №2 Раствор, содержащий 11,04г глицерина в 800г воды, кристаллизуется при t = -0,279°С. Вычислить молярную массу глицерина. Эталон решения: Температура кристаллизации воды 0°С, следовательно: ∆Тзам. = [0 – (0,279)]°С = 0,279°С. По формуле ∆Тзам. = K(Н2О) ∙b, где b = m(C3H8O3) / M(C3H8O3) ∙ m(H2O), определяем молярную массу глицерина. M(C3H8O3) = К(Н2О) ∙ m(C3H8O3) / ∆Тзам ∙ m(H2O) = (1,86 ∙11,04 ∙1000 / 0,279 ∙ 800) г/моль = 92 г/моль. Ответ: M(C3H8O3) = 92 г/моль. Условие задачи№4 Вычислить осмотическое давление раствора, содержащего 16г сахарозы (C12H22O11)в 350г воды, при T=293 K. Плотность раствора считать ровной 1 [M(C12H22O11)=342г/моль.] Будет ли такой раствор изотоничен раствору с осмотическим давлением 500 кПа? Эталон решения: Осмотическое давление растворов неэлектролитов вычисляется по формуле:π=СRT или π=RT∙m/M∙V, π=(8,31∙293∙16/342∙0,366)кПа=311 кПа будет гипотиничен по отношению к раствору с осмотическим давлением 500 кПа. Ответ: 500 кПа Условие задачи№5 В качестве плазмозаменяющего раствора применяется раствор Рингера-Локка, имеющего пропись: натрия хлорид 0,9; калия хлорид 0,02; кальция хлорид 0,02; натрия гидрокарбонат 0,02; глюкоза 01; воды для инъекций до 100мл. Вычислите ионную силу раствора и активность иона натрия. Эталон решения: Молярные концентрации электролитов рассчитываем по формуле: C=m/M ∙ Vраствора С(NaCl)=(0,9/58,5∙0,1)моль/л=0,154моль/л; С(KCl)=(0,02/74,5∙0,1)моль/л=0,00268моль/л С(СаСl2)=(0,02/111∙0,1)моль/л=0,00180моль/л; С(NaHCO3)=(0,02/85∙0,1)моль=0,238моль/л Вычислим суммарную концентрацию хлорид ионаС(Сl-): С(Сl-)=С(NaCl)+C(KCl)+2C(CaCl2)=(0,154+0,00268+2∙0,00180)моль/л=0,238 моль/л и суммарную концентрацию ионов натрия C(Na+): С(Na+)=C(NaCl)+C(NaHCO3)=(0,154+0,00235)моль/л=0,156моль/л Концентрации отдельных ионов равны концентрациям электролитов, в состав которых эти ионы входят: C(K+)=C(KCI); С(HCO3-)=С(NaHCO3); С(Са2+)=С(СaCl2). Ионную силу раствора рассчитываем по I=1/2[C(Na+)+C(K+)+C(Ca2+)∙22+C(Cl-)C(HCO3-)]= =1/2(0,156+0,00268+0,00180∙4+0,160+0,00235)моль/л =0,164моль/л Полученное значение ионной силы соответствует значению 1 для плазмы крови. f(Na+)=0,72,тогда а (Na+)=f∙(Na+)∙C(Na+)=(0,156∙0,72)моль/л=0,112моль/л. Ответ: 0,112моль/л. Условие задачи №6 Раствор, приготовленный растворением 55,35г бария нитрата в дистилированной воде массой 500г, кипит при t=100,4660C.Вычислите изотонический коэффициент и кажущуюся степень диссоциации бария нитрата в этом растворе [E(H2O)=0,52K∙кг/моль] Эталон решения: Количество растворенного вещества равно: n(Ba(NO3)2)/M(Ba(NO3)2)=55,35/261 моль=0,212 моль Моляльная концентрация исследуемого раствора равна: b=n(Ba(NO3)2) / m (H2O)=0,212/0,5 моль/кг =0,424моль/кг Так как ΔT кип.опыт.=iE(H20)∙b,то преобразовав[4],получим: I=ΔT кип.опыт./E(H2O)∙b=(100,466-100)/0,424∙0,52=2,12 Рассчитаем степень диссоциации αкаж. αкаж=(i-1)/(v-1) Ba(NO3)2↔Ba2++2NO3 -,v=3 αкаж.=(2,12-1)/(3-1)=0,56 или 56% Ответ: изотонический коэффициент равен 2,12; кажущаяся степень диссоциации-56% |
