Всем удачи!! Золь иодида серебра AgI получен в избытке раствора йодида калия. Определите заряд частиц полученного золя, напишите формулу его мицеллы и укажите,
 Скачать 0.93 Mb. Скачать 0.93 Mb.
|
|
Задача 4.Гальванический элемент составлен из насыщенного хлорсеребряного электрода и водородного электрода, в котором в качестве электролита использован исследуемый желудочный сок. Определить рН желудочного сока, если ЭДС элемента при температуре 25°С составила 256,6 мВ. Решение. Схема гальванического элемента: ⊖Pt, H2| H+ || KCl |AgCl, Ag⊕ ЭДС этого элемента представляет собой разность потенциалов положительного и отрицательного электродов: Е = φкатода-φанода = φнас.кал.эл- (-2·10-4T· pH)= φнас.кал.эл.+ 2·10-4TрН Отсюда Е -φнас.кал.эл. 0,2566 - 0,197 рН = ¾¾¾¾¾ = ¾¾¾¾¾¾ = 1 2 · 10-4T 2 · 10-4· 298 5.Укажите направление реакции при стандартных условиях: 2Сr³++ 3Br2 + 7H2O = Cr2O7²ֿ + 6Br ֿ + 14H+ Ecли: φº Br2/2Br ֿ= +1,076 B φº Cr2O7²ֿ Ответ поясните. /2Cr³+ = +1,36 B Решение. . Для определения направления ОВР реакции можно пользоваться величиной еѐ Э.Д.С. Э.Д.С. О.В.Р. численно равна разности потенциалов ОВ пар, участвующих в реакции; О.В.Р. протекает самопроизвольно, если еѐ Э.Д.С. >0; Э.Д.С.= 1,076 - 1,36 = -0,284 (В). Приведѐнная реакция будет идти в обратном направлении при стандартных условиях, от сильного окислителя к слабому сопряженному восстановителю, т.е. в обратном направлении. Задача 1 Поверхностное натяжение воды при температуре 20°С составляет 72,75 мН/м. Некоторый объем воды вытекает из сталагмометра в виде 31 капли, а водный раствор пропионовой кислоты с концентрацией 0,25 моль/л - в виде 35 капель. Каково поверхностное натяжение этого раствора? Какова поверхностная активность пропионовой кислоты при концентрации 0,125 моль/л? Эталон решения: Поверхностное натяжение раствора пропионовой кислоты определяем по формуле: sпроп= s(Н2О)· 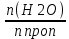 = 72,75 мН/м · = 72,75 мН/м · 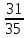 = 64,43 мН/м = 64,43 мН/мПоверхностная активность пропионовой кислоты в интервале концентраций С1 = 0 (чистый растворитель) ÷ С2 = 0,25 моль/л составит: g = 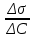 = = 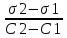 = = 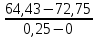 =33,28 мН·л/м·моль =33,28 мН·л/м·мольОтвет: 33,28 мН·л/м·моль Задача 2. Поверхностное натяжение водного раствора муравьиной кислоты с концентрацией 0,002 моль/л составляет 72,6 мН/м. Оценить поверхностное натяжение раствора масляной кислоты той же концентрации. Эталон решения: Согласно правилу Дюкло-Траубе, в разбавленных растворах гомологов одинаковой молярной концентрации поверхностная активность ПАВ увеличивается в среднем в 3,2 раза при удлинении гидрофобной части молекулы на одну метиленовую группу -СН2-. Масляная кислота отличается от муравьиной кислоты на 3 метиленовые группы, поэтому 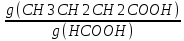 = 3,23 = 32,8 = 3,23 = 32,8Поверхностную активность гомологов в интервале концентраций С1 = 0 (чистый растворитель) ÷ С2 = 0,002 моль/л можно определить по формулам: g(С3Н7СООН) = 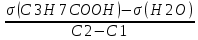 g(НСООН) = 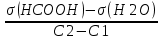 Поскольку интервал концентраций одинаков для обоих гомологов, можно перейти от отношения их поверхностных активностей к отношению изменений поверхностного натяжения: g(С3Н7СООН) σ(С3Н7СООН)-σ(Н2О) ¾¾¾¾¾¾= ¾¾¾¾¾¾¾¾¾¾¾ = 32,8 g(НСООН) σ(НСООН)-σ(Н2О) Поэтому σ(С3Н7СООН) = 32,8 [ σ(НСООН)-σ(Н2О)] + σ(Н2О)= = 32,8 (72,6 - 72,75) + 72,75 = 67,83 мН/м Ответ: 67,83 мН/м Задача 3. При температуре 25°С поверхностное натяжение раствора ПАВ с концентрацией 0,1 моль/л раствора составило 66 мН/м, а раствора с концентрацией 0,5 моль/л - 54 мН/м. Вычислить среднюю величину адсорбции в данном интервале концентраций. Эталон решения: Среднюю адсорбцию в интервале концентраций С1÷С2 можно рассчитать по уравнению Гиббса-Ребиндера: Г = 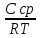 . .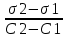 ГдеСср= 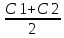 = = 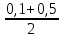 = 0,3 моль/л = 0,3 моль/лПоскольку 1 Дж = 1 Н·м, σ1 = 66·10-3 Дж/м2, σ2 = 54·10-3 Дж/м2, получаем: 0,3 моль/л · (54 - 66)·10-3 Дж/м2 Г = -¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾ = 8,31 Дж/моль·К · 298 К ·(0,5 - 0,1) моль/л = 1,45·10-6 моль/м2= 1,45·10-3 ммоль/м2 Ответ: 1,45·10-3 ммоль/м2 Задача 4. Адсорбция масляной кислоты из водного раствора с концентрацией 0,1 моль/л при температуре 25°С составляет 5·10-6 моль/м2. Вычислить поверхностное натяжение раствора пропионовой кислоты с концентрацией 0,2 моль/л, если поверхностное натяжение воды равно 72,75 мН/м. Эталон решения: Согласно уравнению Гиббса-Ребиндера адсорбцию ПАВ из разбавленных растворов можно рассчитать по формуле: Г = 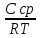 . .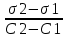 Это уравнение позволяет найти значение поверхностного натяжения σ2: σ2-σ1 = 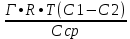 Если рассматривать среднюю адсорбцию в пределах концентраций С1= 0 (чистый растворитель) - С2= 0,2 моль/л, то Сср= 0,1 моль/л, и уравнение приобретает вид: 5·10-6 моль/м2·8,31 Дж/моль·К·298К·(0-0,2)моль/л σ2-σ1 =¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾-¾¾¾= 0,1 моль/л Поэтому = - 24760 Дж/м2 = - 24760 Н/м = - 24,76 мН/м σ2 = σ1- 24,76 = 72,75 - 24,76 = 47,99 мН/м Ответ:47,99 мН/м Задача 5. Равновесная концентрация пропионовой кислоты в растворе после адсорбции на активированном угле равна 0,002 моль/л. Вычислить величину адсорбции в моль/кг, если константы К и n в уравнении Фрейндлиха равны 0,25 моль/кг и 3? Эталон решеия: Изотерма Фрейндлиха имеет вид:x/m = КC1/n Подставляя значения констант К и n, определяем величину адсорбции: x/m = 0,25 · 0,0021/3 = 0,25 · 0,126 = 0,0315 моль/кг Ответ: 0,0315 моль/кг Задача 6. Адсорбция уксусной кислоты на угле описывается уравнением Лэнгмюра. Величина предельной адсорбции составляет 5·10-3 моль/г, константа К равна 0,06 моль/л. Рассчитать адсорбцию бутанола при равновесной концентрации 0,05 моль/л и массу адсорбированного бутанола адсорбентом массой 2,5 г. Эталон решения: Уравнение Лэнгмюра для адсорбции на твердых адсорбентах имеет вид:C Г = Г∞¾¾¾ К + C Определяем величину адсорбции: (5·10-3 моль/г·0,05 моль/л) Г = 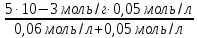 = 2,27·10-3 моль/г = 2,27·10-3 моль/г Количество уксусной кислоты, адсорбированной 2,5 г угля, составит: n = 2,27·10-3 моль/г · 2,5 г = 5,68·10-3 моль Масса адсорбированной уксусной кислоты: m = M ·n = 60 г/моль · 5,68·10-3 моль = 340,8·10-3 г = 340,8 мг Ответ: 340,8 мг Задача 7. В 100 мл раствора уксусной кислоты с рН = 3,15 внесли 2 г активированного угля. Через некоторое время из раствора отобрали 5 мл и оттитровали раствором гидроксида калия с концентрацией 0,01 моль/л. На титрование пошло 6,5 мл раствора титранта. Определить молекулярную адсорбцию уксусной кислоты в моль/кг. рКа(СН3СООН) = 4,73. Эталон решения: Молекулярную адсорбцию уксусной кислоты на твердом адсорбенте можно рассчитать по формуле: а = 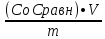  Определим исходную и равновесную концентрации кислоты. Для слабых кислот концентрация ионов водорода связана с концентрацией кислоты формулой:[H+] = √ Kа·С Логарифмируя это выражение, получаем: рН = 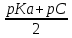 рС = 2рН - рКа = 2 · 3,15 - 4,73 = 1,57 С = 10-рС= 10-1,57 = 0,0269 моль/л По данным титрования находим равновесную концентрацию кислоты: С(СН3СООН) · V(CH3COOH) = C(KOH) · V(KOH) С(СН3СООН)= 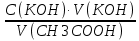 = = 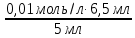 = 0,013 моль/л = 0,013 моль/лВычислим величину адсорбции: а = 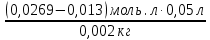 = 0,3475 моль/кг = 0,3475 моль/кгОтвет: 0,3475 моль/кг Ситуационная задача В больницу поступил больной с почечно-печеночной недостаточностью,имеющий высокие показатели метаболитов в крови: креатинин плазмы – 0,9 ммоль/л,мочевина – 32 ммоль/л, остаточный азот– 0,82 ммоль/л. После сеанса гемосорбции в течение 60 минут с использованием 350 г сорбента СКП-2М концентрация метаболитов в крови снизилась: креатинина на 25%,мочевины на 18%, остаточного азота на19%. Общий объем крови составляет 5,5л. а) Какую формулу можно использовать для определения величины адсорбции? б) Определить величину адсорбции креатинина. в) Определить величину адсорбции мочевины. г) Определить величину адсорбции остаточного азота. д) Улучшилось ли состояние больного после сеанса гемосорбции? Эталон ответа: Для определения величины адсорбции веществ из растворов используют уравнение: Xкреатинина = (Cисх - Сравн ) ×Vисх ×1000 ммоль/г m Хмочевины = (Cисх - Сравн ) ×Vисх ×1000 ммоль/г m Хост.азота = (Cисх - Сравн ) ×Vисх × 0,01 ммоль/г m Состояние больного после сеанса гемосорбции улучшилось, так как уменьшилось повышенное содержание метаболитов в крови. Эталоны решения задач Задача I. Золь хромата серебра получен путем смешивания равных объемов 0,005М раствора K2CrO4 и 0,012M раствора BaCl2. Напишите схему строения мицеллы золя и укажите знак заряда ее гранул. Решение Составьте уравнение реакции, лежащей в основе получения золя: K2CrO4 + BaCl2® BaCrO4¯ + 2KCl Так как С(BaCl2) > C(K2CrO4), то при равных объемах растворов количество BaCl2 больше количества K2CrO4 (0,012×V > 0,005×V). Следовательно, в избытке находится BaCl2. Агрегат мицеллы золя образуют микрокристаллы плохо растворимого BaCrO4. По правилу Панета – Фаянса на поверхности агрегата будут адсорбироваться потенциалопределяющие ионы, родственные веществу агрегата и находящиеся в растворе в избытке. В нашем случае – это nBa2+. Противоионами будут также находящиеся в избытке 2nCl–, которые распределяться следующим образом: (2n–x)Cl– будут находиться в адсорбционном слое, а остальные хCl– – в диффузном. Схема строения мицеллы золя будет иметь следующий вид: {[mBaCrO4] × nBa2+ × (2n–x)Cl–}х+× xCl–, Гранула мицеллы, заключенная в фигурные скобки, имеет положительный заряд, т.е. знак заряда потенциалопределяющих ионов Ва2+. Задача 2. Гранулы золя иодида серебра, полученного путем смешивания растворов AgNO3 и KCl, имеют отрицательный заряд. Какой из данных электролитов взят в избытке? Напишите формулу мицеллы. Решение Золь получен по следующему уравнению реакции: AgNO3 + KCl ® AgCl¯ + KNO3, из которого следует, что агрегатом является малорастворимый иодид серебра AgCl. Так как гранула имеет отрицательный заряд, то потенциалопределяющими ионами, по правилу Панета – Фаянса, будут отрицательные ионы, входящие в состав агрегата, т.е. Cl––ионы. Следовательно, в избытке взят раствор KCl, содержащий эти ионы. Формула мицеллы будет иметь следующий вид: {[mAgCl] × nCl– × (n–x)×K+}х–× xK+. Задача 1. Коагуляция 400 мл гидрозоля сульфида мышьяка наступила при добавлении к нему 3,75 мл раствора сульфата алюминия с концентрацией 0,005 моль/л. Вычислить порог коагуляции и коагулирующую способность катионов алюминия по отношению к этому золю.
Ответ: 0,0928 ммоль/л; 10,78 л/моль Задача 2. Заряд частиц золя гидроксида железа (III) положительный.Какой из электролитов – KCl, Fe2(SO4)3, CaCl2, AlCl3 – будет иметь наименьший порог коагуляции по отношению к данному золю ? Эталон решение  4 Так как частицы имеют положительный заряд, то в соответствии с правилом Щульце – Гарди коагуляцию золя будут вызывать ионы, имеющие противоположный знак заряда, т.е. анионы электролитов (Cl– или SO 2- ). И чем выше величина заряда иона-коагулятора, тем сильнее коагулирующее действие электролита, а порог коагуляции меньше. Следовательно, наименьший порог коагуляции будет у Fe2(SO4)3, т.к. заряд сульфат-иона выше заряда хлорид-иона. Задача 3. Электролиты KCl, K2SO4, K3PO4 по отношению к золю гидроксида железа (III) имеют следующие пороги коагуляции: 7,1; 0,099 и 0,01 ммоль/л. Какой знак заряда имеют частицы золя? Эталон решение По условию задачи пороги коагуляции электролитов KCl, K2SO4, K3PO4 относятся следующим образом: g1 :g2 : g3 = 7,1: 0,099 : 0,01 = 740 : 10 : 1. Это соотношение близко к теоретическому отношению порогов коагуляции (730:11:1). Следовательно, коагуляцию вызывают ионы одного знака, но разной величины заряда.В нашем случае – это Cl–, SO4 2- , PO4 3- . Поскольку коагуляцию вызывают анионы, то знак заряда частиц золя положительный. Задача 1.Рассчитайте относительную молекулярную массу поливинилового спирта, если постоянные в уравнении Марка–Хаувинка–Куна для раствора поливинилового спирта в воде равны: К=4,53×10-5 см3/г, a=0,74; характеристическая вязкость [h]=0,15 см3/г. Дано Эталон решение
Задача 2.Рассчитайте относительную молекулярную массу белка миоглобина, если постоянные в уравнении Марка–Хаувинка–Куна для раствора данного белка в воде равны: К= 2,32×10-2 см3/г, a = 0,5; характеристическая вязкость [h] = 3,1 см3/г. Дано: Эталон решения
Рассчитайте рН ацетатного буферного раствора, приготовленного из 80 мл 0,1 М раствора СН3СООН и 20 мл 0,1 М раствора СН3СООNa. Ка (СН3СООН) = 1,74 · 10– 5. Дано: С (СН3СООН) = 0,1 М Vр (СН3СООН) = 80 мл= 0,08 л С (СН3СООNa) = 0,1 М Vр (СН3СООNa) = 20мл КД (СН3СООН) = 1,74 ·10-5 Решение: 1. Находим рКкислоты: рКкислоты = – lgКа = – lg 1,74 · 10– 5 = 4,76 2. Находим рН ацетатного буферного раствора: рН = рКа + lg (Сс*Vc/Ck*Vk) = 4,76 + lg (0,02 · 0,1/ 0,08 · 0,1=4,16 Ответ: рН = 4,16 Пепсин желудочного сока (ИТЭ=2,0) помещен в буферный раствор, в котором концентрация Н+-ионов в 1000 раз больше, чем в чистой воде. К какому электроду будет перемещаться белок при электрофорезе в этом растворе? Эталон решения Концентрация Н+–ионов в воде равна 10–7 моль/л. Следовательно, в данном растворе [H+] = 10–7×1000 = 10–4 моль/л. Отсюда, рН среды = – lg 10–4 = 4. Поскольку рН среды больше ИТЭ (4 > 2), молекула белка в данной среде приобретает отрицательный заряд согласно следующему уравнению: Белок, имея отрицательный заряд, в электрическом поле будет перемещаться к анод |
