Всем удачи!! Золь иодида серебра AgI получен в избытке раствора йодида калия. Определите заряд частиц полученного золя, напишите формулу его мицеллы и укажите,
 Скачать 0.93 Mb. Скачать 0.93 Mb.
|
|
87. Показаниями к применению хлорида калия являются гипокалиемия, интоксикация наперстянкой, аритмия различного происхождения. Вычислите молярную, моляльную концентрации хлорида калия в растворе, содержащем 245,7 г соли в 1000 г воды (плотность 1, 131 г/ мл), а также мольные доли соли и воды. Рассчитаем количество вещества KCL в растворе: n = m/M M (KCl) = 39 + 35,5 = 74,5 г/моль n (KCl) = 245,7 г / 74,5 г/моль = 3,3 моль Количество воды: n (H2O) = 1000г / 18г/моль = 55,5 моль M (H2O) = 2 + 16 = 18 г/моль Вычислим молярную концентрацию KCl по формуле: c(X) = (1000 * p/M(X)) * w(X) массовая доля KCl равна: w(KCl) = 245,7 / 1245,7 = 0,2 c (KCl) = ((1000 * 1,131) / 74,5) * 0,2 = 3 моль/л Вычислим моляльную концентрацию KCl по формуле: Cm = m (в-ва) / (M(в-ва) * m(растворителя)) Cm = n(в-ва) / m(растворителя) Cm(KCl) = 3,3 моль / 1000г = 0,0033 моль/г = 3,3 моль/ кг w (мольная доля) = n(в-ва) / n(смеси) n(смеси) = n(KCl) + n(H2O) = 3,3 + 55,5 = 58,8 моль Мольная доля KCl равна 3,3/58,8 = 0.056 Мольная доля H2O равна 55,5/58,8 = 0,94 Ответ: Cm(KCl) = 3,3 моль/кг, c (KCl) = 3 моль/л, Мольная доля KCl =0,056, мольная доля H2O=0,94 8. Определите стандартное изменение термодинамического потенциала ΔG при 298К для реакции: S(ромбическая) +3/2O2=SO3 , если ΔHoреакции= -395,72кДж/моль. Величины So298 найдите по справочнику. So298 (S ромб) = 31,88 Дж/(Моль * К) So298 (O2) = 205,03 Дж/(Моль * К) So298 (SO3) = 256,23 Дж/(Моль * К) ΔSoр-ции = ΔSo (SO3) – (ΔSo (S ромб) + 3/2 ΔSo (O2)) = 256,23 – (31,88 + 3/2 * 205,03) = -83,195 Дж/(Моль * К) ΔG = ΔH – TΔS = -395,72 – 298*(-83,195/1000) = -370,9 кДж/моль ΔG < 0, реакция проекает самопроизвольно 89. Раствор буры ( тетрабората натрия) применяется в медицинской практике форме обмываний, примочек при различных воспалениях кожи и слизистых оболочек. Рассчитайте массу навески декагидрата тетрабората натрия (Na2B4O7 ‧10H2O), необходимую для приготовления 100,0 мл раствора с молярной концентрацией эквивалента соли 0,05 моль/л. Вычислим теоретическую массу навески буры, необходимую для приготовления 100 мл растворы с молярной концентрацией эквивалента 0,05 моль/л по формуле Cm (1/z) = m(1/z)/(M(1/z) *V) M (1/z Na2B4O7 ‧10H2O) = M (Na2B4O7 ‧10H2O) / z (Na2B4O7) – соль, образованная двумя атомами одновалентного металла, поэтому число эквивалентности для него будет равно 2. M (Na2B4O7 ‧10H2O) = 23*2 + 11*4 + 16*7 + 10*18 = 382 г/моль f экв (Na2B4O7 ‧10H2O) = 1/2 M (1/2 Na2B4O7 ‧10H2O) = 382 г/моль / 2 = 191 г/моль Vр-ра = 100 мл = 0,1 л m теор (Na2B4O7 ‧10H2O) = Cm (Na2B4O7 ‧10H2O) * M (1/2 Na2B4O7 ‧10H2O) * V m теор (Na2B4O7 ‧10H2O) = 0,05 моль/л * 191 г/моль * 0,1 л = 0,955г Ответ: 0,955г 90. Полное окисление глюкозы протекает по уравнению реакции: C6H12O6 + 6O2 -> 6CO2 + 6H2O Вычислите количество теплоты, которое выделится при окислении 90 г глюкозы при с.у., пользуясь справочными значениями стандартных теплот (энтальпий) образования веществ: ΔH0 обр(CO2) = -393 кДж/моль, ΔH0 обр (H2O) = -286 кДж/моль, ΔH0 обр (C6H12O6) = -1273 кДж/моль, ΔH0 обр (O2) = 0 кДж/моль ΔH0р-ции = (6 * ΔH0 обр (CO2) + 6 * ΔH0 обр (H2O)) – (ΔH0 обр (C6H12O6) + 6 * ΔH0 обр (O2)) ΔH0р-ции = (6 * (-393) + 6 * (-286)) – (-1273 + 6 * 0) = - 2801 кДж/моль 91. Рассчитать калорийность булки хлеба «Бородинский» массой 450 г, если его стограммовый кусочек содержит 7,4 г белков, 57,1 г углеводов и 1,2 г жиров. Коэффициенты калорийности брать по нижней границе. Решение 1. Найти массы белков (mб), углеводов (mу) и жиров (mж) в 450 г хлеба «Бородинский»: mб= 7,4·450:100=33,3г mж = 57,1 ·450:100=256,95г mж =1,2 ·450:100=5,4г 2. Рассчитать калорийность булки хлеба «Бородинский» массой 450 г: К = (mб ·16,5 + mу · 16,5 + mж · 37,7) кДж К = 33,3 16,5 + 256,95 16,5 + 5,4 37,7 = 4992,705 кДж Ответ: К = 4992,705 кДж. Перечень странных задач, которые мы решили оставить на всякий случай. (не знаю, что это. нашла в файле у одной девочки) 1. Какие объемы соляной кислоты плотностью 1,07 г/л и воды необходимо взять для приготовления раствора НС1 объемом 100 мл с молярной концентрацией 0,1 моль/л? Решение: 1. Плотность исходного раствора НС1 измеряют ареометром и в справочниках по плотности определяют массовую долю НС1 в растворе: со (НС1) = 14% или со (НС1) = 0,14. 2. Рассчитывают количество вещества (моль) и массу (г) НСl, необходимые для приготовления заданного раствора: n(HCl) = C(HCl) ·V(p-p) = 0,l·0,1 = 0,01 моль, m(HCl) = М(НС1)·n(HCl) = 36,5 ·0,01 = 0,365 г 3. Рассчитывают массу исходного раствора НС1, содержащего требуемую массу НС1 (0,365 г) m(p-p) = m(НС1)/со (НС1) = 0,365 : 0,14 = 2,6 г. 4. Зная массу и плотность раствора, рассчитают его объем: V(p-p) = m(p-p) /р(НС1) = 2,6 г : 1,07г/мл = 2,5 мл. 2. Определите титр раствора натрия гидроксида, если на тирование 5 мл его раствора израсходовано 5,4 мл раствора Н2SO4, с молярной концентрацией эквивалента Решение: 1. Определить молярную концентрацию эквивалента раствора натрий гидроксида, используя закон эквивалентов: С(NaOH) V(NaOH) = C(½ Н2SO4) V(½ Н2SO4) С(NaOH) = (C(½ Н2SO4) · V(½ Н2SO4)) / V(NaOH) = (0,5 · 5,4)/ 5 = 0,54 моль/л 2. Определить титр раствора натрий гидроксида: Т(NaOH) = (C(NaOH) · M(NaOH))/1000 = (0,54 · 40)/1000= 0,0216 (г/мл) Ответ: Т(NaOH) =0,0216 (г/мл) 3. Титр раствора NaOH, широко используемого в анализе лекарственных препаратов, равен 0,003600г/мл. При взаимодействии с серной кислотой, он образует кислую соль. Какова молярная концентрация эквивалента раствора в реакции его с серной кислотой и массовая доля NaOH(%) в растворе? Рассчитайте навеску NaOH, необходимую для приготовления 1л такого раствора. Эталон решения: Уравнение происходящей реакции: Н2SO4 +NaOH = Na НSO4+H2O f экв(Н2SO4)=1; f экв(NaOH)=1. Таким образом, в данном случае следует говорить о молярной концентрации раствора NaOH. 1. Находим массу NaOH, необходимую для приготовления 1000 мл раствора: mNaOH)= Т(NaOH) / V(p-p) m(NaOH)=0,003800 :1000г/мл=3,8г 2. Находим молярную концентрацию раствора: с(NaOH)= Т(NaOH)·1000/M (NaOH)=· 0,003800 ·1000г/мл)=0,0950моль/ с(NaOH)=0,0950моль/л 3. Находим массу 1 литра раствора: m(р-ра)=ρV(p-pа) m(р-р)=1000мл ·1 г/мл=1000г 4. Находим массовую долю NaOH (%) в растворе : ω%(NaOH)= m(NaOH): m(р-р)·100%=3,8г: 1000г·100% ω%(NaOH)= 3,8г Ответ:с(NaOH)=0,0950моль/л ω%(NaOH)= 0,38% m(NaOH)=3,8г Тоже задачи, но не с сдо и не новые 2.Вопрос: Комплексная соль [Ag(NH3)2]Cl является соединением катионного типа. Определите степень окисления комплексообразователя и координационное число. Составьте уравнение первичной диссоциации соли. Напишите выражение Кн. Ответ: [Ag+1(NH3)02]Cl-1 степень окисления комплексообразователя = +1 Координационное число = 2 Первичная диссоциация [Ag(NH3)2]Cl->[Ag(NH3)2]++Cl- Кн= Кн1+ Кн2=[NH3]2*[Ag+]/[Ag(NH3)2+] 3.Вопрос : Комплексная соль K4[Fe(CN)6] является соединением анионного типа. Определите степень окисления комплексообразователя и координационное число. Составьте уравнение первичной диссоциации соли. Напишите выражение Кн Ответ: K4+[Fe+2(CN)-6] степень окисления комплексообразователя = +2 Координационное число = 6 Первичная диссоциация K4[Fe(CN)6] ->4K++[Fe(CN)6]-4 Кн = [Fe2+]*[CN-]6/ [ [Fe(CN)6]4- ] 4. Вопрос: Напишите структурную формулу ЭДТА. Определите дентатность соединения как лиганда. Укажите области его использования в медицине и в санитарной практике. Ответ: (-OOCCH2)2 – N – CH2 – CH2 – N – (CH2COO-)2 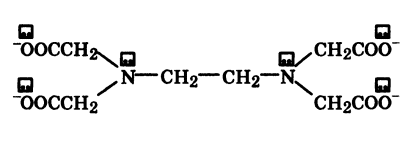 Полидентантный лиганд  10.Вопрос: Поясните, в чем суть процесса желатинирования (застудневания) и определите, какой из электролитов (NH4)2SO4 или NaCl, усилит процесс желатинирования и по какой причине. Ответ: Застудневание, студнеобразование, гелеобразование, желатинирование, желатинизация, превращение легко подвижной или вязкотекучей жидкости в твердообразное (т. е. лишённое текучести) тело, обладающее эластичностью, пластичностью, хрупкостью. Застудневание характерно для растворов высокомолекулярных соединений и коллоидно-дисперсных систем. В лиотропном ряду (ряду анионов) жесткие основания (SO42-) подавляют набухание, а мягкие (Cl-) усиливают. Начальной стадией желатинирования является набухание, поэтому электролит NaCl усилит этот процесс 11.Вопрос: Набухание и растворение ВМС. На примере лабораторной работы поясните термодинамику процесса набухания. Ответ: 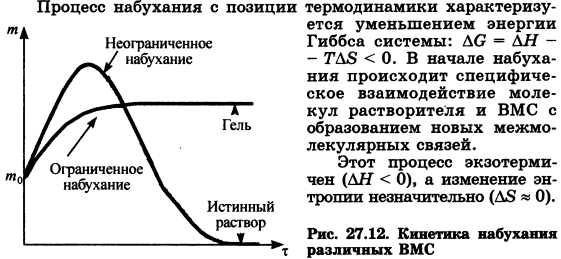  (см. лаб.работу – Набухание желатина) 12.Вопрос: Что такое онкотическое давление? Как оно связанно с возникновением отёков? Ответ:  26.Вопрос: Дайте определение гетерогенным процессам. При каких условиях образуются осадки? Бериллиевый и стронциевый рахиты Ответ: Гетерогенные процессы - процессы протекают на границе раздела двух фаз.    27.Вопрос: Гидрофильные и гидрофобные адсорбенты (приведите примеры). На примере лабораторной работы, объясните адсорбцию фуксина из водного и спиртового растворов. Ответ: Гидрофобные адсорбенты – активированный уголь, сажа, графит. Гидрофильные адсорбенты – алюмогель (Al2O3*xH2O), силикагель (SiO2*xH2O) Фуксин – неполярный краситель. Он лучше адсорбируется активированным углем из полярного растврорителя воды по правилу Ребиндера-Шилова (Неполярные адсорбенты лучше всего адсорбируют неполряные адсорбаты из полярных растворителей). 28.Вопрос: Как изменяется поверхностное натяжение мочи при появлении желчных кислот? Ответ поясните на примере лабораторной работы. Ответ: Присутствие желчных кислот понижает поверхностное натяжение мочи, а при отсутствии их поверхностное натяжение не изменяется. Доказывается это добавлением «серного цвета» при наличии желчных кислот он опускается на дно, а при отсутствии желчных кислот он остается на поверхности. 30.Вопрос: Рассчитайте рН растворов, если: а) [Н+] = 10-3 ; б) [Н+] = 10-9. Укажите характер среды. Ответ: При [Н+ ] = 10-3 pH=-lg[H+]=-lg10-3= 3 Реакция среды - кислая. При [Н+ ] = 10-9 pH=-lg[H+]=-lg10-9= 9 Реакция среды - щелочная. 31.Вопрос: Дайте определение поверхностно-активным веществам (ПАВ). Используя графическую зависимость, покажите, как влияет концентрация ПАВ в растворе на величину поверхностного натяжения. Ответ:  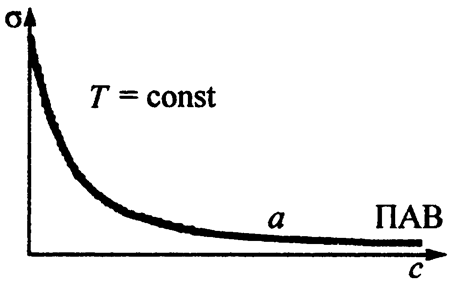 32.Вопрос: Охарактеризуйте понятия ацидоз и алкалоз. Назовите рН крови в норме и изменения этого показателя при ацидозе и алкалозе. Ответ: Ацидоз — смещение кислотно-щелочного баланса организма в сторону увеличения кислотности, из-за накопления в организме кислых продуктов (уменьшению рН). Алкало́з — нарушение кислотно-щелочного равновесия организма, в сторону увеличения основности, характеризующееся абсолютным или относительным избытком оснований(увеличение pH) pH в норме ≈ 7,4 Компенсированный ацидоз 7,35-7,4 Некомпенсированный ацидоз 6,8 -7,35 Компенсированный алкалоз 7,4-7,45 33.Вопрос: Дайте определение буферным растворам. Перечислите буферные системы крови и укажите их состав. Какая из них вносит максимальный вклад в буферную емкость плазмы крови? Ответ: Буферные растворы – растворы, обладающие свойством сохранять определенное значение pH при разбавлении или добавлении небольших количеств кислот и щелочей Гидрокарбонатный буфер является основной буферной системой плазмы крови, обеспечивающей около 55 % от всей буферной емкости крови.
35.Вопрос: Приведите правило валентности-значности (Шульце-Гарди). На основе выполненной лабораторной работы определите, какой анион обладает максимальным коагулирующим действием, если коагуляция золя гидроксида железа Fe(OH)3была вызвана следующими электролитами: KCl, K2SO4, K3[Fe(CN)6]. Ответ:  Максимальное коагулирующее действие на золь гидроксида железа Fe(OH)3 с положительно заряженной гранулой (ПОИ – Fe3+) в соответствии с правилом Шульце-Гарди оказывают ионы [Fe(CN)6]3-, т.к. среди используемых электролитов их заряд наибольший. 39. Вычислить стандартную энергию Гиббса реакции гидратации сывороточного альбумина при 250С, для которой H0 6,08 кДж/моль, S0 5,85 Дж/(мольК). Оценить вклад энтальпийного и энтропийного фактора. Эталон решения Стандартную энергию Гиббса реакции рассчитаем по формуле: G0 H0 TS0. Подставив значения, получим: G0 6,08 кДж/моль 298 К(5,85103) кДж/(мольК) 4,34 кДж/моль. В данном случае энтропийный фактор препятствует протеканию реакции, а энтальпийный благоприятствует. Самопроизвольное протекание реакции возможно при условии, если 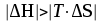 , т.е., при низких температурах , т.е., при низких температурах41. Во сколько раз увеличится скорость химической реакции при повышении температуры от 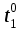 100C до 100C до 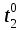 800С, если температурный коэффициент скорости равен 2? 800С, если температурный коэффициент скорости равен 2?Эталон решения По правилу Вант-Гоффа: 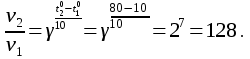 |
