Всем удачи!! Золь иодида серебра AgI получен в избытке раствора йодида калия. Определите заряд частиц полученного золя, напишите формулу его мицеллы и укажите,
 Скачать 0.93 Mb. Скачать 0.93 Mb.
|
|
Эталон решения: Схема равновесия в насыщенном растворе над осадком Са3(РО4)2:  4 Са3(РО4)2⇄ 3Ca2+ + 2PO3- Константа растворимости Са3(РО4)2:  4 Ks(Са3(РО4)2) = [Ca2+]3× [ PO3- ]2 откуда: Из справочника находим, что [ PO3- ]=  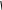 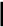  Ks [Ca2+ ]3   4 s K0 (Са3(РО4)2) = 2×10–29.  4 Тогда [ PO3- ]= = 1,41×10–10 моль/л  4 Ответ: осадок образуется при [ PO3- ]> 1,41×10–10моль/л Задача 3. Образуется ли осадок СаС2О4, если к насыщенному раствору CaSO4 добавить равный объем раствора Na2C2O4 с концентрацией 1×10–7 моль/л ? Эталон решения; Схема равновесия в насыщенном растворе над осадком CaSO4:  4 СаSО4⇄Ca2+ + SO2-  4 Обозначим через х концентрацию каждого из ионов [Ca2+] = [ SO2- ] = х моль/л, тогда   Ks(CaSO4) = x2 [Ca2+] = K (CaSO ) моль/л s 4 Поскольку при смешивании исходных растворов общий объем раствора возрастает вдвое, то концентрации ионов уменьшаются в 2 раза. Найдем произведение концентраций ионов Са2+ и C O2- и сравним его с константой растворимости оксалата кальция. Условием образования 2 4 осадка СаС2О4 является: [Ca2+]×[ C O2- ] >Ks 2 4 Из справочника найдем K0 СаSО4 и K0 (СаC2О4) ; s s K0 СаSО4 = 2,5×10–5 ; K0 (СаC2О4) = 2,6×10–9 s  s В разбавленных растворах K0 [Ca = Ks; 2+] = s    2,5 ×10-5 ; [ C O2- ] = 1×10-7 ; 2 2 4 2 [Ca2+]×[ C O2- ]= 1,25×10–10 2 4 Ответ: осадок не образуется, так как 1,25×10–10< 2,6×10–9 Задача 4. Растворимость PbI2 при 250С равна 0,581 г/л. Вычислить Ks(PbI2) при 250С. M(PbI2)= 461,0 г/моль. Эталон решения: Схема равновесия в насыщенном растворе над осадком PbI2 PbI2⇄Pb2+ + 2I– (1) Константа растворимости PbI2 Ks(PbI2) = [Pb2+] [I–]2 (2) Установим связь между Ks и растворимостью PbI2 (S моль/л). Из уравнения (1) видно, что при растворении 1 моль PbI2 в раствор переходит 1 моль Pb2+ и 2 моль I– – ионов. Следовательно, если растворяется S моль/лPbI2, то в насыщенном растворе: [Pb2+] = Sмоль/л; [I–]= 2S моль/л Подставив эти значения в уравнение (2), получим: Ks(PbI2) = S (2S)2 = 4s3 (3) Выразим растворимость PbI2 в моль/л. Поскольку молярная масса (PbI2) равна 461 г/моль, то растворимость PbI2, выраженная в моль/л, равна S = По уравнению (3) найдем Ks(PbI2): 0,581 = 1,2610–3 моль/л 461 Ks(PbI2) = 4(1,2610–3)3 = 810–9 Ответ: Ks(PbI2) =810–9 Задача 5. Константа растворимости Cr(OH)3 равна 5,4×10–31 при 200С. Вычислить растворимость Cr(OH)3 (в моль/л и в г/л) при 200С. M(Cr(OH)3)= 103 г/моль. Эталон решения: Схема равновесия в насыщенном растворе над осадком Cr(OH)3: Cr(OH)3⇄Cr3+ + 3OH– (1) Константа растворимости Cr(OH)3: Ks(Cr(OH)3) = [Cr3+] × [OH–]3 (2) Установим связь между Ks и растворимостью Cr(OH)3 (S моль/л). Из уравнения (1) видно, что при растворении 1 моль Cr(OH)3 в раствор переходят 1 моль Cr3+ и 3 моль ОН– –– ионов. Следовательно, если растворяется S моль/лCr(OH)3, то в насыщенном растворе: [Cr3+] = S моль/л, [OH–] = 3S моль/л Подставив эти значения в уравнение (2), получим: Ks(Cr(OH)3) = S× (3S)3 = 27S4 Откуда: S =  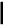          4 Ks Cr(OH)3 27 4 27 5,4 ×10-31 4 2 ×10-32 = = =1,19×10–8 моль/л Поскольку молярная масса Сr(OH)3 равна 103 г/моль, то растворимость Сr(OH)3, выраженная в г/л, составит: 1,19×10–8×103 = 1,22×10–6 г/л Ответ: 1,19×10–8 моль/л; 1,22×10–6 г/л Задача 6. Определить минимальное значение рН, соответствующее началу выпадения осадка Mg(OH)2 из раствора хлорида магния с С(MgCl2) = 0,01 моль/л при добавлении щелочи. Эталон решения:  2 Табличное данное: КsM g(OH) = 6×10-10 . Образование осадка Mg(OH)2 начнется при условии, что ПCi ³ Ks . Поэтому можно запи-сать:  2 C(Mg2+)×C(OH-)2 ³ KsM g(OH) . Концентрация катионов Mg2+ в растворе хлорида магния равна 0,01 моль/л, следовательно: 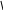       2 C(Mg 2+ ) KsM g(OH) 6×10-10 10- 2 C(OH-) ³ ³ Таким образом: ³ ³ 2,45×10-4 моль/л.    6×10-8 Соответственно, pOH = -lg[OH -] £ -lg2,45 ×10-4 £ 3,61. pH ³14 - 3,61³10,39. Типовые задачи Задача 1. Определите заряд комплексного иона [ Cr+3Br3(H2O)]x. x = 1 · (+3) + 3 · (-1) + 1 · (0) = -2 Ответ: x = -2. Задача 2. Назовите комплексное соединение Ba[ Pt+4(NO2)4(Cl)2]. Ответ:дихлоротетранитритоплатинат (IV) бария Задача 3. Напишите формулу комплексного иона акватригидроксокупрат (II). Ответ: [Cu+2(OH)3(H2O)]– Задача4.На осаждение ионов брома из раствора комплексной соли [Cr+3 (NH3)6 ] Br3 израсходовано 0,5 л раствора AgNO3 с молярной концентрацией вещества в растворе С(AgNO3) = 0,2 моль/л. Сколько граммов комплексной соли содержалось в растворе? Дано: Решение:  m ( AgNO3 ) =m( K .C .) m ( AgNO3 ) =m( K .C .) M( AgNO3) M( 1/3 K.C. ) Vр-ра = 0,5лПо закону эквивалентов: С(AgNO3) = 0,2 моль/дм3n(AgNO3) = n(⅓[Cr+3(NH3)6] Br3) m([Cr+3(NH3)6] Br3) - ? M(AgNO3) = 170 г/моль М(⅓[Cr+3(NH3)6]Br3) = 397 / 3 = 132,3 г/моль m(AgNO3) = C(AgNO3) · M(AgNO3) · Vр-ра m(AgNO3) = 0,2 · 170 · 0,5 = 17 г m ( K . C . )= m( AgNO3) ·M ( 1/3 K . C . ) M ( AgNO3 ) m ( K . C . )= 17 ·132,3 = 13 , 23 г 170 Ответ:m([Cr+3(NH3)6]Br3) = 13,23 г. Задача 5. Вычислить DG0 процесса: [Co(SCN)4]2-«Co2+ + 4 SCN-, если Кнест = 5,5 · 10-3 при 250С. Дано: Решение:  Кнест = 5,5 · 10-3 По уравнению изотермы: Кнест = 5,5 · 10-3 По уравнению изотермы:Т = 298 К DG0 = - RTlnKнест R = 8,314 Дж·моль-1·К-1DG0 = -8,314 · 298 · ln 5,5·10-3 = 12890,8 Дж/моль» DG0 - ? Ответ: DG0 = 12,89кДж/моль. Типовые задачи Задача1. Рассчитать величину О-В потенциала электрода Pt/ Fe3+, Fe2+, если при 25 0 С а (Fe3+) = 0,04 моль/дм3; а (Fe2+) = 0,012 моль/дм3. Е0 (Fe3+/ Fe2+) = + 0, 77 В Решение: Е(Fe3+/ Fe2+) = Е0(Fe3+/ Fe2+)+ 0,059 ·1g[Fe3+] / [Fe2+] Е(Fe3+/ Fe2+) = Е0(Fe3+/ Fe2+) + 0,059 ·lg 0,04 / 0,012 = 0,77 + 0,059·0,52 = 0,77+0,03 = 0,8 B Ответ: Е (Fe3+/ Fe2+) = 0,8 В Задача 2. Электродный потенциал системы Со3+ + 1 е ↔ Со2+ равен Е (Co3+/Co2+)= +1,7 В при Т =298 К. Определите величину соотношения концентраций [Со 3+]/[Со2+], если Е0 (Co3+/Co2+)= +1,81 В Решение: Е (Co3+/Co2+)=Е0(Co3+/Co2+) + 0,059·1g [Со3+] / [Со2+] Подставим значения: 1,7 = 1,81 + 0,059 ·1g [Со3+] / [Со2+] 1,7 – 1,81 = 0,059 ·1g [Со3+] / [Со2+] – 0,1 = 0,059 ·1g [Со 3+] / [Со2+] 1g [Со3+] / [Со 2+] = -0,11 / 0,059 = – 1,86 [Со3+] / [Со2+] = 10 –1,86 = 0,014 Ответ: соотношение концентраций [Со3+] / [Со2+] = 0,014 Задача 3. Определить концентрацию ионов Sn4+ в растворе, содержащем 0,05 моль ионовSn2+, если Е (Sn4+/Sn2+) = 0,21 В, Е0 (Sn4+/ Sn2+) = 0,15 В. Решение: Е (Sn4+/Sn2+) =Е0 (Sn4+/Sn2+) + 0,0295lg [Sn4+] / [Sn2+] 0,21 = 0,15 + 0,0295 ·lg [Sn4+] / 0,05 0,21 – 0,15 = 0,0295 ·lg [Sn4+] / 0,05 lg [Sn4+] / 0,05 = 2,03 [Sn4+] / 0,05 = 10 2,03 [Sn4+] / 0,05 = 107,15 [Sn4+] = 5,36моль/дм3 Ответ: [Sn4+] = 5,36моль/дм3 |