Лекции по химии. Введение Окружающий человека мир материален и, несмотря на все богатство его проявлений, в настоящее время выделяют всего лишь две формы существования материи вещество
 Скачать 0.58 Mb. Скачать 0.58 Mb.
|
|
Химическая связь Химическая связь образуется в большинстве случаев в результате той или иной перегруппировки электронов, содержащихся во взаимодействующих атомах. Важнейшими формами таких перегруппировок являются: 1) передача одного или нескольких электронов от одного атома к другому (так образуется ионная связь) и 2) смещение электронов от одного атома к другому (так образуется ковалентная связь). Во всех случаях образования химической связи внешняя электронная оболочка каждого атома принимает конфигурацию восьмиэлектронной оболочки инертного газа (и только для атомов водорода реализуется двухэлектронная конфигурация гелия). Это правило октета строго соблюдается только для элементов 2 периода (Be, B, C, N, O и F). Атомы элементов последующих периодов могут образовывать также соединения с 10 электронами (в PСl5), с 12 электронами (SF6), а некоторые с 14 электронами (IF7) и даже с 16 электронами, участвующими в образовании ковалентной связи. Комбинации таких двухэлектронных связей, отражающие электронную структуру молекулы, получили название валентных схем. Для наглядного изображения валентных схем пользуются следующим способом. Электроны, находящиеся на внешнем электронном слое, обозначают точками, расположенными вокруг символа атома, например, для атомов водорода (1 электрон) и кислорода (6 электронов) можно записать схемы .. H. :O .. Образование молекулы водорода можно представить следующим образом Н. + Н. = Н:Н Эта схема показывает, что каждый атом водорода дает в общее пользование по одному электрону, в результате вокруг каждого из них образуется устойчивая двухэлектронная оболочка, подобная оболочке инертного газа гелия. При образовании молекулы кислорода из атомов .. .. .. .. : О + : О = О::О .. .. .. .. каждый атом кислорода отдает в общее пользование одну пару своих электронов, в результате вокруг каждого из них образуется оболочка из 8 электронов, подобная оболочке инертного газа. Строение молекулы воды можно изобразить схемой .. Н:О:Н .. Если вместо каждой пары электронов, образующих химическую связь условиться писать черточку, то структурная формула веществ примет вид: H-H, O=O, NN, H-O-H и т.д. В молекуле водорода имеется одинарная связь, в молекуле кислорода двойная, а в молекуле азота тройная связь. Число одинарных ковалентных связей элемента в химическом соединении называется ковалентностью элемента. Так, ковалентность азота в молекулах N2 и NH3 равна трем, ковалентность кислорода в молекулах O2, H2O, CO2 равна двум и т.д. Cвязь между атомами является направленной. Так, экспериментально установлено, что молекула воды не является линейной молекулой, у которой все атомы расположены на одной прямой линии H-O-H а имеет такое строение 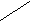  O OH H Угол между связями в молекуле воды равен 109.5о. Молекула борной кислоты B(OH)3 имеет плоское строение, в ней три связи бора одинаковой длины и расположены под углом 120о друг к другу. В молекуле метана CH4 атом углерода находится в центре правильного тетраэдра (т.е. трехранной пирамиды, у которой все грани-равносторонние треугольники), а атомы водорода в его вершинах. Донорно-акцепторная связь Разновидностью ковалентной связи является так называемая донорно-акцепторная связь. Химическая связь, обусловленная парой электронов, принадлежащей до образования связи одному из атомов, называется донорно-акцепторной связью. Атом, поставляющий электронную пару, называется донором, а атом, к которому эта пара перемещается, -акцептором. Смещение электронной пары делает связь полярной. Донорно-акцепторную связь иногда называют также координационной связью. Примером донорно-акцепторной связи может служит образование иона аммония NH4+ из аммиака. Молекула аммиака NH3 имеет электронное строение H H .. H:N: или H-N: .. H H В ней три электронные пары образуют связь N-H, а четвертая пара внешних электронов принадлежит только атому азота. Эта пара может дать связь с ионом водорода, в результате образуется ион аммония     Н H + Н H + .. .. H:N: + H+ = H:N:H .. ..   H H H H Ионнуюсвязь можно рассматривать как предельный случай ковалентной связи, когда пара образующих связь электронов полностью переходит к более электроотрицательному элементу. Типичным примером образования ионной связи является образование хлорида натрия из атомов натрия и хлора .. Na. + .Cl: = Na+Cl- .. В этой реакции атом хлора достраивает свою внешнею электронную оболочку до октета за счет захвата электрона у атома натрия, при этом возникают положительно заряженный ион натрия и отрицательно заряженный ион хлора. Экспериментально доказано, что даже в парах соли натрий, и хлор существуют в ионной форме. Водородная связь Водородный атом обладает той особенностью, отличающей его от всех других элементов, что, отдавая свой электрон, он остается в виде ядра без электронов, т.е. в виде частицы, диаметр которой в тысячи раз меньше диаметров остальных атомов. Кроме того, вследствие отсутствия у него электронов ион Н+ не испытывает отталкивания от электронной оболочки другого атома или иона, а наоборот, притягивается ею. Это позволяет ему ближе подходить к другим атомам и вступать во взаимодействие с их электронами (и даже внедряться в их электронную оболочку). Поэтому в растворах водородный ион большей частью не сохраняется в виде самостоятельной частицы, а связывается с молекулами других веществ. В воде он связывается с молекулами Н2О, образуя ион гидроксония - Н30+. С молекулами аммиака он образует ион аммония NH4+ и т.д. В данных примерах реализуется донорно-акцепторная связь, о которой говорилось выше. Обычно энергия химической связи составляет порядка 30-100 ккал/моль. В полярных молекулах, содержащих ковалентную связь атома водорода с электроотрицательным элементом Н-Э, например, в воде H-O-H, атомы водорода несут на себе некоторый (дробный) положительный заряд +, а электроотрицательный элемент заряд -, что отразим в схеме молекулы в виде НЭ. В растворе две такие молекулы могут притягиваться за счет кулоновских сил и приводить к возникновению водородной связи и ассоциации молекул, например, НЭ ...... НЭ. Водородная связь здесь обозначена многоточием. Энергия водородной связи значительно ниже энергии ковалентной связи и составляет порядка 5-7 ккал/моль. В настоящее время доказано, что в воде могут существовать ассоциаты даже из 3 и более молекул воды. Этим объясняются многие аномальные свойства воды. Аналогичную склонность к образованию водородной связи проявляют и молекулы плавиковой кислоты HF. Металлическая связь В твердом состоянии металлы отличаются от всех остальных веществ своими характерными свойствами - очень высокими теплопроводностью и электропроводностью, почти полной непрозрачностьюи высокой отражательной способностью по отношению к видимому свету благодаря так называемому металлическомублеску. При образовании сплавов они сохраняют свои металлические свойства. Металлы обладают также специфическими механическими свойствами. Они более или менее ковкие, а некоторые из них имеют большую прочность при растяжении или при сжатии. В жидком состоянии большинство из перечисленных свойств металлов сохраняется, которые исчезают при переходе к газообразному состоянию. Пары металлов прозрачны (например, пары ртути, которые к тому же и бесцветны) и не проводят электрический ток. Пары металлов одноатомны, только для паров щелочных металлов была замечена слабая ассоциация в двухатомные молекулы. Например, пары натрия при температуре около 8800 и атмосферном давлении содержат примерно 16% молекул Na2. Металлы могут вытеснять водород из кислот, образуя соли, в которых они содержатся как положительные ионы. В таблице Менделеева металлы расположены под диагональю в левой нижней части. В таблице Менделеева число элементов с металлическими свойствами превышает число неметаллов. Переходные элементы, лантаниды и актиниды являются металлами. Самым замечательным свойством металлов является легкость, с которой они проводят электрический ток. Электрический ток проходит через металл без переноса вещества, в то время как через электролиты ток переносится ионами. Если электропроводность электролитов возрастает с повышением температуры, то для металлов она наоборот падает. Вблизи абсолютного нуля некоторые металлы проявляют свойство сверхпроводимости. Электропроводность металлов давно приписывали свободным или очень подвижным электронам в металле. При высоком напряжении электроны покидают поверхность металла в виде катодных лучей. Раскаленные металлы также испускают электроны. Наличием свободных электронов объясняется также непрозрачность металлов. Большинство металлов почти полностью отражают свет всех длин волн спектра, вследствие чего они имеют белый или серый цвет. Только два металла - медь и золото - поглощают соответственно зеленый и голубой свет сильнее, чем свет других длин волн, и поэтому окрашены. Очень тонкий листок золота в проходящем свете кажется зеленым. Некоторые элементы (полуметалллы), расположенные в таблице Менделеева между неметаллами и металлами, например бор (B), кремний(Si), германий (Ge), мышьяк (As), сурьма (Sb) и теллур (Te), имеют характерный металлический блеск, однако их кристаллическая структура отличается от структуры металлов. Все они являются полупроводниками. Термодинамика Химические реакции могут сопровождаться выделением или поглощением тепла, света, превращениями химической энергии веществ в другие формы энергии, словом - превращениями различных форм энергии. Термодинамика- это наука, изучающая взаимные превращения различных форм энергии. Она вводит в рассмотрение два новых понятия-внутреннюю энергию и энтропию системы. Системой называют тело или группу тел, находящихся во взаимодействии и мысленно обособленных от окружающей среды  система окружающая среда Система называется открытой, если она обменивается веществом и энергией с окружающей средой. Примером открытой системы может служить сам человек. Система называется закрытой, если она обменивается с окружающейсредойтолько энергией. Примером закрытой системы может служить наша планета, если пренебречь массой космической пыли и метеоритов, выпадающих на Землю, и небольшими потерями массы атмосферы, за счет ее постепенного рассеяния в космическом пространстве. Система называется изолированной, если она не обменивается с окружающей средой ни веществом, ни энергией. Под внутренней энергией системы U понимают общий запас энергии cистемы, включая сюда энергию поступательного и вращательного движения молекул, энергию внутримолекулярного колебательного движения атомов и атомных групп, составляющих молекулы, энергию вращения электронов в атомах, энергию, заключающуюся в ядрах атомов, и другие виды энергии, но без учета кинетической энергии тела в целом и его потенциальной энергии положения. Каждая термодинамическая система обладает своим запасом внутренней энергии.  U Общий запас внутренней энергии системы будет тем больше, чем больше масса веществ, входящих в данную систему. Поэтому в химической термодинамике для всех величин, значения которых зависят от количества вещества, вводится понятия мольных величин. В частности, под внутренней энергией вещества понимают внутреннюю энергию 1 моля вещества. В настоящее время пока не имеется возможности определить абсолютную величину внутренней энергии какой-нибудь системы. Однако на основании первого закона термодинамики можно определить изменение внутренней энергии U. Первый закон (постулат) термодинимики устанавливает, что если к закрытой системе подвести количество тепла Q, и при этом система совершит над окружающей средой работу А,   U Q U Q A то изменение внутренней энергии системы U=U2 - U1 (где U2 - внутренняя энергии системы в конечном состоянии, U1- внутренняя энергия системы в начальном состоянии) определяется уравнением U= Q - A Отсюда следует, что в изолированной системе (для которой по определению Q=0, A=0) изменение внутренней энергии равно нулю U=0, т.е. в изолированной системе полный запас внутренней энергии остается постоянным при любых физических или химических процессах, происходящих в этой системе. Первый закон термодинамики является выражением закона сохранения энергии. Через внутреннюю энергию U в термодинамике вводится новая величина H=U + PV которую назвали энтальпией (где P-давление в системе, V- ее объем). В термодинамике доказывается, что тепловой эффект химической реакции (Q) aiAi = bjBj + Q равен убыли энтальпии реакции (Hp), т.е. Q= -Hp , Дж/моль (Q>0, если тепло выделяется). Согласно закону Гесса, тепловой эффект химической реакции Hp зависит только от состояния и тепловых эффектов образования Hf исходных веществ (Hf)i и продуктов реакции (Hf)j Hp=bj(Hf)j - ai(Hf)i, Дж/моль Теплотой образования сложного вещества называется тепловой эффект реакции образования данного соединения из простых веществ, отвечающих, как правило, наиболее устойчивым состояниям рассматриваемых элементов при данной температуре и атмосферном давлении. Теплоты образования для многих сложных веществ приводятся в таблицах. Поэтому, если известных теплоты (энтальпии) образования исходных веществ и продуктов реакции, то можно рассчитать и тепловой эффект реакции, протекающей с участием этих веществ. Зная теплоты образования, например 100 различных соединений, можно рассчитать тепловые эффекты не одной сотни, а многих тысяч различных химических реакций, которые составляются из этих веществ в разных комбинациях. В настоящее время известны теплоты образования для десятка тысяч различных веществ. Таким образом, при постоянном давлении тепловой эффект химической реакции равен изменению энтальпии реакции. Поэтому иногда энтальпию называют теплосодержанием. Один моль каждого индивидуального вещества обладает определенным теплосодержанием. Это теплосодержание является мерой энергии, накапливаемой веществом при его образовании. Если теплосодержание реагирующих веществ больше, чем продуктов реакции, то при реакции тепло выделяется. Если же теплосодержание продуктов реакции больше, чем у реагирующих веществ, при реакции тепло поглощается. То, что в каждом индивидуальном веществе заключено определенное количество энергии, служит объяснением тепловых эффектов реакций. Второй закон термодинамики устанавливает, что для каждой системы существует такая величина S, называемая энтропией, изменение которой связано с приведенной теплотой процесса Q/T соотношением SQ/T , Дж/Кмоль где знак равенства относится к обратимым процессам, а знак неравенства к необратимым. В изолированной системе Q=0, поэтому S0. Это означает, что в изолированной системе самопроизвольно могут протекать только такие процессы, которые сопровождаются возрастанием энтропии системы. Процесс протекает до тех пор, пока система не достигнет состояния равновесия, в котором энтропия достигает максимального значения. Таким образом, в любой изолированной системе при протекании самопроизвольного процесса внутренняя энергия всегда сохраняется, а энтропия стремится к максимуму. В термодинамике доказывается, что если в системе протекает химическая реакция aiAi = bjBj то изменение энтропии реакции Sр выражается через энтропии продуктов реакции и исходных веществ уравнением Sp=bj(S)j - ai(S)i Энтропии для множества веществ также приводятся в таблицах. Через энтальпию и энтропию в термодинамике вводится новая функция- энергия Гиббса (изобарно-изотермический потенциал) G= H -TS, Дж/моль откуда следует уравнение G= H -TS Поскольку в изолированной системе самопроизвольно могут протекать только такие процессы, при которых энтропия стремится к максимуму, то это означает, что при этом свободная энергия Гиббса должна стремиться к минимуму. В системах, находящихся при постоянных температуре и давлении, самопроизвольно могут протекать только процессы, сопровождающиеся уменьшением G, причем пределом их протекания, т.е. условием равновесия, служит достижение некоторого минимального для данных условий значения изобарно-изотермического потенциала. Для химической реакции вида aiAi = bjBj изменение энергии Гиббса реакции определяется через энергию Гиббса образования исходных веществ (Gf)i и продуктов реакции (Gf)j по уравнению Gp=bj(Gf)j - ai(Gf)i или при стандартных условиях G0p=bj(G0f)j - ai(G0f)i При этом свободные энергии образования элементов в стандартном состоянии условно приняты равными нулю. Свободная энергия реакции является движущей силой реакции. При постоянных температуре и давлении протекают самопроизвольно только те реакции, в ходе которых свободная энергии Гиббса снижается (Gp<0). Если Gp >0, то такая реакция термодинамически невозможна (не может протекать самопроизвольно без затраты внешней работы). В состоянии равновесия Gp=0. В 1896 году Больцман дал статистическую трактовку второго закона термодинамики. Любая термодинамическая система состоит из большого количества частиц (молекул), которые находятся в состоянии непрерывного хаотического движения. Энтропия является количественной мерой хаоса в системе, а закон ее возрастания означает, что любая система стремится к равновесию, переходя из менее вероятного в более вероятное состояние. В изолированной системе не могут самопроизвольно протекать процессы, при которых система переходит из более вероятного в менее вероятное состояние. Так, в идеальном кристалле, где между атомами существует дальний порядок, энтропия должна быть меньше, по сравнению с тем же количеством вещества, находящемся в расплавленном, или в газообразном состоянии. Действительно, в жидком состоянии вещества может существовать только ближний порядок между молекулами или атомами, т.е. хаоса в системе больше, а в газообразном состоянии исчезает и ближний порядок. Развитие статистической термодинамики привело к возможности рассчитывать энтропию (и внутреннюю энергию) различных веществ на основе молекулярно кинетической теории и данных о внутреннем строении, характеризующих движение различных частиц, составляющих данное вещество. Статистическая термодинамика показывает, что энтропия может рассматриваться как сумма составляющих энтропии, относящихся к различным формам движения частиц. Принято группировать их по характеру движения частиц, рассматривая следующие составляющие энтропии: энтропию поступательного движения молекул, энтропию вращательного движения молекул, энтропию вращательного движения атомов и атомных групп, содержащихся в молекуле, энтропию колебательного движения атомов и атомных групп, содержащихся в молекуле и энтропию движения электронов. Энтропия зависит от всех видов движения частиц, содержащихся в молекуле. Для каждого данного вещества энтропия возрастает при всех процесса, вызываемых движением частиц (испарение, плавление, расширение газа, диффузия и пр.). Энтропия возрастает при ослаблении связей между атомами в молекулах и при разрыве их, т.е. диссоциации молекул на атомы или атомные группы. Наоборот, упрочнение связей вызывает уменьшение энтропии. |
