Лекции по химии. Введение Окружающий человека мир материален и, несмотря на все богатство его проявлений, в настоящее время выделяют всего лишь две формы существования материи вещество
 Скачать 0.58 Mb. Скачать 0.58 Mb.
|
|
М m= It nF где M- молекулярный (или атомный) вес выделенного вещества, n-число электронов в суммарном уравнении электрохимической реакции. Опыт показал, что зависимость потенциала электрода от плотности тока описывается уравнением Тафеля = a + blg i где a и b- постоянные. В координатах - lg i поляризационная кривая (ПК) представляет собой прямую с наклоном b, который называют тафелевским наклоном. Таким образом, анодная и катодная ПК могут быть представлены парой прямых. Точка пересечения которых отвечает равновесному потенциалу электрода и току обмена реакции (рис. 1) 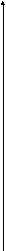   Red = Ox + ne - анодный процесс Red = Ox + ne - анодный процессанодная поляризационная кривая   p pOx + ne = Red -катодный процесс катодная поляризационная кривая  io lg i Рис. 1. Схема поляризационных кривых (ПК). Разность = - р называют перенапряжением. Уравнение Тафеля чаще записывают не через потенциала, а через перенапряжение = а + blg i В электролизере на электродах одновременно протекают две независимые электрохимические реакции Ox1 + ne = Red1 Red2 = Ox2 + ne и для каждой из этих реакций теоретически можно построить свою па- ру анодных и катодных ветвей поляризационных кривых (cм. ниже рис. 2) 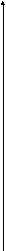    Red1 = Ox1 + ne р(Ox1/Red1) Ox1 + ne = Red2 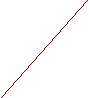  р(Ox2/Red2) Red2 = Ox2 + ne    Ox2 + ne = Red2  lg i Рис.2 Схема поляризационных кривых для двух независимых реакций электролизера . Каждой из этих реакций отвечает свой равновесный потенциал, который определяется уравнением Нернста. Их разность определяет так называемое напряжение разложения Uразлож.= р(Ox1/Red1) - р(Ox2/Red2) т.е. минимальное напряжение, которое необходимо приложить к электролизеру от внешнего источника тока, для того чтобы мог начаться процесс электролиза. Электролизом раствора хлорида натрия в промышленности получают газообразный хлор и щелочь. На аноде протекает реакция окисления хлорид ионов с образованием газообразного хлора 2Сl- = Cl2 + 2e анодный процесс а на катоде восстановление воды с образованием щелочи и выделением водорода 2H2О + 2e = Н2 + 2OH- катодный процесс Электролизом соединений алюминия в промышленности получают алюминий. Аналогичным образом получают и магний. В технологии используется также электрохимическая размерная обработка. Сущность такой обработки состоит в том, что деталь подключается к положительному полюсу источника тока, а обрабатывающий инструмент - к отрицательному. В зазор между деталью и инструментом с большой скоростью пропускают раствор электролита, что обеспечивает анодное растворение металла заготовки и вынос продуктов растворения. Электрохимическая размерная обработка позволяет провести обработку деталей из материалов, трудно обрабатываемых механическими способами, или деталей сложной формы. Гальванические покрытия широко применяются в различных отраслях промышленности для защиты изделий от коррозии, увеличения срока службы и придания им красивого декоративного вида. В технологии широко используются такие процессы нанесения гальванических покрытий, как цинкование, кадмирование, меднение, никелирование, хромирование, лужение, серебрение, золочение, электролитическое осаждение сплавов.. Анодирование- получение оксидов на поверхности металлов и полупроводников при анодной поляризации в кислородсодержащих средах с ионной проводимостью. За счет образования анодного оксида изменяются поверхностные свойства материала: твердость, электрическое сопротивление, термостойкость, изностойкость, каталитическая активность и др. Широко распространена технология анодирования алюминия, титана, тантала, ниобия, кремния, германия, арсенида галлия. В зависимости от вида кислородсодержащей среды, заполняющей межэлектродное пространство, различают анодирование: в водных растворах электролитов, в расплавах солей, в газовой плазме, плазменно-электролитическое. Анодирование в водных растворах электролитов наиболее распространенный и универсальный способ, легко поддающийся автоматизации. Площадь одновременно анодируемых в ванне изделий определяется только вместимостью ванны и мощностью источника тока и достигает 100 м2 и более. В качестве электролитов применяют водные растворы кислот или щелочей. Основное назначение оксидов, полученных этим методом, -защита металлических изделий от коррозии, декоративная отделка, упрочнение поверхности, применение в качестве диэлектрика конденсаторов, основы для фотографического слоя, полупроводниковых переходов, подслоя для лаков и красок и др. В электролитах борной кислоты, буры, нитратов, фосфатов, бикарбонатов получают тонкие (до 1 мкм) плотные оксиды. В электролитах кислот хромовой, серной, щавелевой, фосфорной, а также сульфатов получают оксиды до 250 мкм. Эти оксиды имеют двухслойную структуру: тонкий, прилегающий к металлу слой имеет плотную упаковку; наружный слой-пористый. В растворах хлорида или фторида анодный оксид не возникает; происходит травление металлов. Для получения оксидов толщиной 150-250 мкм обычно требуется охлаждение электролита и изделия. Цветостойкие покрытия получают: - анодированием в двух- и трехкомпонентных электролитах, содержащих ароматические сульфокислоты и серную кислоту; - в растворах неорганических солей реакций двойного обмена-осаждением в порах оксида цветного неорганического соединения; - в растворах неорганических солей с использованием переменного тока. Непрозрачные защитно-декоративные эмаль-покрытия имеют толщину в несколько десятков мкм, обладают высокой твердостью и хорошей адгезией. Их получают в электролитах на основе хромовой и щавелевой кислот и их солей. Установка для анодирования представляет собой ванну, заполненную электролитом, в которую помещены два электрода: катод и окисляемое изделие-анод. Наиболее распространенный электролит при анодировании алюминия - водный раствор серной кислоты. Катод выполняют из свинца, графита или коррозионно-стойкой стали. Часто применяемый режим толстослойного анодирования: концентрация серной кислоты 200 г/л; плотность тока 2.5-5 А/м2; напряжение 15-120 В; температура электролита -4-40С; продолжительность анодирования 240 мин; толщина покрытия до 175 мкм. В радиоэлектронной промышленности анодирование в водных растворах электролитов применяется при производстве конденсаторов. Анодирование в расплавах солей применяют для получения оксидов повышенной толщины и микротвердости, в частности, на меди и железе. В качестве электролита используют расплавы солей с температурой до 4000С. Это метод применяют для создания диэлектрика высоковольтных конденсаторов и электроизоляционных покрытий. Анодирование в газовой плазме. Различают анодирование в плазме тлеющего разряда постоянного тока и в плазме высокочастотного разряда. Анодирование ведут под колпаком вакуумной установки при пониженном давлении. На два электрода, служащие для разряда, подают напряжение 500-1500 В. Анодирование в газовой плазме ведут в среде кислорода или атмосферного воздуха, обычно при давлении 1-100 Па. Максимальная толщина окислов достигает 800 нм. Анодирование в газовой плазме широко применяют в микроэлектронике. Плазменно-электролитическое анодирование имеет особенности, заключающиеся в том, что окисляемый образец - анод помещают в электролит, а катод размещают над анодом выше уровня электролита. Этот способ является промежуточным между анодированием в водных растворах электролитов и плазменным анодированием. Общие представления о коррозии металлов. Под коррозией понимают разрушение металла вследствие его химического и электрохимического взаимодействия с окружающей средой. В терминах окислительно-восстановительных реакций сущность этого взаимодействия сводится к окислению металла и восстановлению окислителя среды. Me - ne = Men+ окисление (ионизация) металла Ox + ne = Red восстановление окислителя среды Коротко можем записать: коррозия = окисление металла + восстановление окислителя. Окислитель- “Ox” всегда принимает электроны. Поэтому в качестве окислителя среды может выступать любое вещество, способное принимать на себя электроны от атомов металла. Ox- окислитель среды= захватчик электронов Red-восстановитель среды= поставщик электронов Примеры коррозии металлов в различных средах: Атмосферная коррозия- окисление железа кислородом воздуха 4Fe + 3O2 = 2Fe2O3 окислитель-кислород В этой реакции железо поставляет электроны, а кислород их захватывает 4Fe - 12e = 4Fe3+ окисление железа 3O2 + 12e = 6O2- восстановление кислорода Коррозия железа в водных средах, содержащих ионы водорода 2Fe + 6H+ = 2Fe3+ + 3H2 окислитель-ионы водорода В этой реакции железо также отдает электроны, а принимают их ионы водорода 2Fe - 6e = 2Fe3+ окисление железа 6H+ + 6e = 3H2 восстановление ионов водорода Коррозия наносит огромный ущерб почти всем отраслям народного хозяйства, при этом основные убытки определяются даже не потерей металла, а порчей дорогостоящих металлических изделий, конструкций, машин и аппаратов, что в первую очередь связано с утратой функциональных возможностей их отдельных узлов. Достаточно упомянуть разрывы нефте- и газопроводов, а также разрывы труб городского водоснабжения. Коррозия металлической арматуры железобетонных конструкций приводит к потере их прочности и разрушению промышленных и жилых зданий. О масштабах коррозии черных металлов можно судить хотя бы по тому, что примерно каждая шестая домна в мире работает на восполнение коррозионных потерь. Классификация различных видов коррозии. По механизму действия коррозия делится на химическую и электрохимическую Химическая коррозия - взаимодействие металла с окружающей средой, при котором окисление металла и восстановление окислителя коррозионной среды происходит в одном акте без перехода заряженных частиц через границу металл-окислительная среда. Химическая коррозия = окисление металла + восстановление окислителя без перехода заряженных частиц через границу металл-коррозионная среда. Скорость химической коррозии не зависит от потенциала металла. Примером химической коррозии может служить окисление железа кислородом воздуха 4Fe + 3O2 = 2Fe2O3 Образующаяся при этом оксидная пленка на металле может предохранять его от дальнейшего окисления, если температура окисления невысока. При высоких температурах химического окисления любое железное изделие превращается в окалину. Химический вид коррозии может также иметь место и в растворах неэлектролитов. Электрохимическая коррозия - взаимодействие металла с окружающей средой, при котором окисление металла и восстановление окислителя коррозионной среды происходит в результате протекания нескольких элементарных актов, сопровождающихся переходом заряженных частиц через границу металл-окислительная среда. Электрохимическая коррозия = окисление металла + восстановление окислителя с переходом заряженных частиц через границу металл-коррозионная среда. Скорость электрохимической коррозии зависит от потенциала металла. Примером может служить растворение цинка в кислоте Zn + 2H+ = Zn2++ Н2 Еще со школы мы привыкли рассматривать эту реакцию, как химическую. На самом деле эта реакция протекает через две сопряженные электрохимические реакции: реакцию окисления атома цинка Zn = Zn2+ + 2e и реакцию восстановления ионов водорода 2H+ + 2е= Zn2++ Н2 Если сложить эти две реакции, то получим суммарную реакцию Zn + 2H+ = Zn2+ + Н2 При этом заряженная частица- ион цинка переходит через границу металл-раствор в объем раствора, а пара электронов остается в металле, заряжая его отрицательно по схеме ¦ ¦ Zn 2е + Zn2+ ¦ ¦ Ионы водорода подходят к отрицательно заряженной поверхности металла, а электроны из металла переходит через границу раздела металл-раствор на ионы водорода, в результате образуется молекула водорода ¦ ¦ 2е + 2Н+ + Н2 ¦ ¦ По характеру коррозионной среды различают следующие типы коррозии К О Р Р О З И Я     газовая атмосферная электролитная грунтовая Другими словами - коррозия в небе, на суше и на море. Газовая коррозия - химическая коррозия металлов в газах при высоких температурах (например, в камере сгорания реактивных двигателей). Атмосферная коррозия- коррозия в атмосфере воздуха (при наличии конденсированной пленки влаги и атмосферных осадков). Электролитная коррозия- коррозия в речной и морской воде, а также в растворах солей, кислот, щелочей. Грунтовая коррозия-коррозия металлических изделий при контакте с грунтом-почвенным электролитом. По условиям эксплуатации различают следующие типы электрохимической коррозии  Э Л Е К Т Р О Х И М И Ч Е С К А Я К О Р Р О З И Я Э Л Е К Т Р О Х И М И Ч Е С К А Я К О Р Р О З И Я     щелевая контактная коррозионное коррозионная коррозия растрескивание усталость при трении Щелевая коррозия-электрохимическая коррозия в щелях и зазорах между двумя металлами, куда попадает электролит. Контактная коррозия-электрохимическая коррозия любых двух контак- тирующих металлов, погруженных в электролит. Она проявляется в усиле- нии коррозии одних металлов при их контакте с другими металлами. Коррозионное растрескивание-коррозия металла при одновременном воздействии коррозионной среды и внешних или внутренних механических напряжений растяжения с образованием транскристаллитных или межкрис- таллитных трещин. Коррозионная усталость- понижение предела усталости металла при одновременном воздействии циклических растягивающих напряжений и кор- розионной среды. Коррозия при трении - разрушение металла, вызываемое одновременным воздействием коррозионной среды и трения. Формы коррозионных разрушений. По форме коррозионных разрушений коррозия делится на виды Э Л Е К Т Р О Х И М И Ч Е С К А Я К О Р Р О З И Я   О Б Щ А Я Л О К А Л Ь Н А Я      равномерная неравномерная пятнами, раскли- межкристаллитная, язвами, нивающая транскристаллитная питтингами Для всех металлических изделий, испытывающих механическую нагрузку,наиболее опасными являются локальные виды коррозии. Это демонстрирует график зависимости потерь прочности детали из дуралимина от коррозионных потерь веса при различных видах коррозионного разрушения. Потери прочности, %   межкристаллитная межкристаллитная80 коррозия неравномерная  коррозия коррозия20 равномерная  коррозия коррозия 0 Потери веса, мг/см2 0 Потери веса, мг/см2При коррозии металла на его поверхности одновременно протекают две независимые электрохимические реакции |
