Зачем врачу нужна биологическая химия
 Скачать 6.47 Mb. Скачать 6.47 Mb.
|
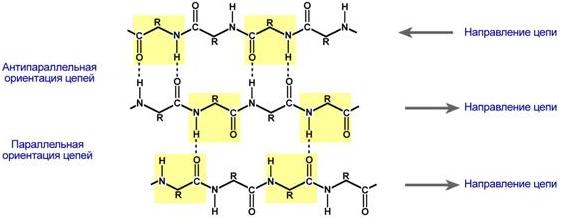
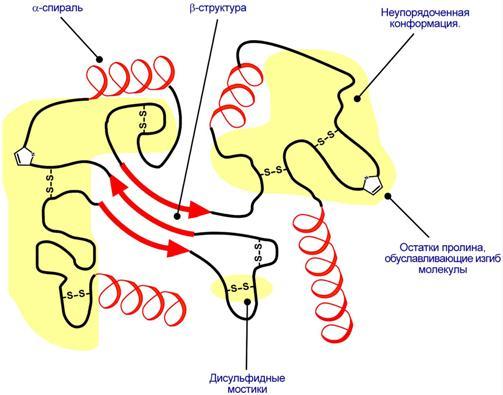
Укладка белка в виде каната и гармошкойВторичная структура белка – это способ укладки полипептидной цепи в более компактную структуру, при которой происходит взаимодействие пептидных групп с образованием между ними водородных связей. Формирование вторичной структуры вызвано стремлением пептида принять конформацию с наибольшим количеством связей между пептидными группами. Тип вторичной структуры зависит от устойчивости пептидной связи, подвижности связи между центральным атомом углерода и углеродом пептидной группы, размером аминокислотного радикала. Все указанное вкупе с аминокислотной последовательностью впоследствии приведет к строго определенной конфигурации белка. Можно выделить два возможных варианта вторичной структуры: α-спираль (α-структура) и β-складчатый слой (β-структура). В одном белке, как правило, присутствуют обе структуры, но в разном долевом соотношении. В глобулярных белках преобладает α-спираль, в фибриллярных – β-структура. Вторичная структура образуется только при участии водородных связей между пептидными группами: атом кислорода одной группы реагирует с атомом водорода второй, одновременно кислород второй пептидной группы связывается с водородом третьей и т.д. 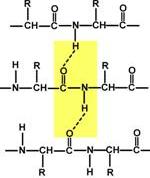 Участие водородных связей в формировании вторичной структурыα-Спираль |
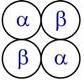 Строение тетрамера гемоглобина взрослых |
Например, гемоглобин – белок эритроцитов, переносящий кислород, состоит из 4 субъединиц – 2 α-субъединицы и 2 β-субъединицы в гемоглобине взрослых, 2 α-субъединицы и 2 γ-субъединицы в фетальном гемоглобине.
Лактатдегидрогеназа – фермент, принимающий активное участие в окислении глюкозы при мышечном сокращении, также включает 4 субъединицы – Н (heart) и М (muscle) в разных сочетаниях: Н4, Н3М1, Н2М2, Н1М3, М4. Всего 5 изоферментов.
Креатинкиназа – фермент, участвующий в регенерации АТФ при мышечном сокращении, состоит из 2 субъединиц – В (brain) и М (muscle) в разных сочетаниях: ВВ, ВМ, ММ. Всего 3 изофермента.
Взаимодействие протомеров друг с другом осуществляется по принципу комплементарности, т.е. их поверхность подходит друг другу по геометрической форме и по функциональным группам аминокислот (возникновение ионных и водородных связей).
Так как субъединицы в олигомерах очень тесно взаимодействуют между собой, то любое изменение конформации какой-либо одной субъединицы обязательно влечет за собой изменение других субъединиц. Этот эффект называется кооперативное взаимодействие. Например, у гемоглобина такое взаимодействие субъединиц в легких ускоряет в 300 раз присоединение кислорода к гемоглобину. В тканях отдача кислорода также ускоряется в 300 раз.
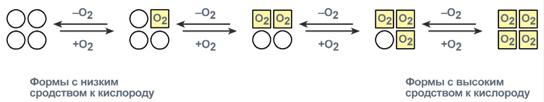
Схема кооперативного взаимодействия субъединиц в гемоглобине.
Присоединение в легких первой молекулы кислорода к одной из субъединиц гемоглобина изменяет ее конформацию. В результате она начинает влиять на следующую убъединицу, облегчая присоединение к ней кислорода. После этого они вдвоем влияют на третью субъединицу и так далее. В тканях первая молекула кислорода отделяется от своей субъединицы не очень легко, вторая уже быстрее и так далее.