Зачем врачу нужна биологическая химия
 Скачать 6.47 Mb. Скачать 6.47 Mb.
|
Печень перекрещивает метаболизм углеводов, липидов и белковПечень, являясь центральным органом метаболизма, участвует в поддержании метаболического гомеостаза и способна осуществлять взаимодействие реакций обмена белков, жиров и углеводов. Местами "соединения" обмена углеводов и белков является пировиноградная кислота, щавелевоуксусная и α-кетоглутаровая кислоты из ЦТК, способных в реакциях трансаминирования превращаться, соответственно, в аланин, аспартат и глутамат. Аналогично протекает процесс превращения аминокислот в кетокислоты. С обменом липидов углеводы связаны еще более тесно:
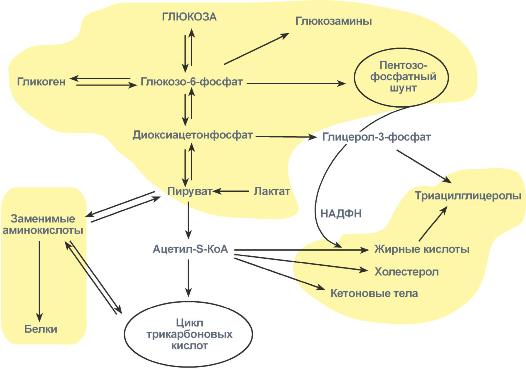 Взаимосвязь обмена белков, жиров и углеводовУглеводный обмен В гепатоцитах активно протекают процессы углеводного обмена. Благодаря синтезу и распаду гликогена печень поддерживает концентрацию глюкозы в крови. Активный синтез гликогена происходит после приема пищи, когда концентрация глюкозы в крови воротной вены достигает 20 ммоль/л. Запасы гликогена в печени составляют от 30 до 100 г. При кратковременном голодании происходит гликогенолиз, в случае длительного голодания основным источником глюкозы крови является глюконеогенезиз аминокислот и глицерина. Печень осуществляет взаимопревращение сахаров, т.е. превращение гексоз (фруктозы, галактозы) в глюкозу. Активные реакции пентозофосфатного пути обеспечивают наработку НАДФН, необходимого для микросомального окисления и синтеза жирных кислот и холестерола из глюкозы. Липидный обменЕсли во время приема пищи в печень поступает избыток глюкозы, который не используется для синтеза гликогена и других синтезов, то она превращается в липиды – холестерол и триацилглицеролы. Поскольку запасать ТАГ печень не может, то их удаление происходит при помощи липопротеинов очень низкой плотности (ЛПОНП). Холестерол используется, в первую очередь, для синтеза желчных кислот, также он включается в состав липопротеинов низкой плотности (ЛПНП) и ЛПОНП. При определенных условиях – голодание, длительная мышечная нагрузка, сахарный диабет I типа, богатая жирами диета – в печени активируется синтез кетоновых тел, используемых большинством тканей как альтернативный источник энергии. Белковый обменБольше половины синтезируемого за сутки в организме белка приходится на печень. Скорость обновления всех белков печени составляет 7 суток, тогда как в других органах эта величина соответствует 17 суткам и более. К ним относятся не только белки собственно гепатоцитов, но и идущие на "экспорт" – альбумины, многие глобулины, ферменты крови, а также фибриноген и факторы свертывания крови. Аминокислоты подвергаются катаболическим реакциям с трансаминированием и дезаминированием, декарбоксилированию с образованием биогенных аминов. Происходят реакции синтеза холина и креатинаблагодаря переносу метильной группы от аденозилметионина. В печени идет утилизация избыточного азота и включение его в состав мочевины. Реакции синтеза мочевины теснейшим образом связаны с циклом трикарбоновых кислот. 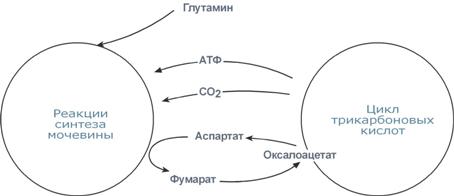 Тесное взаимодействие синтеза мочевины и ЦТКПигментный обменУчастие печени в пигментном обмене заключается в превращении гидрофобного билирубина в гидрофильную форму и секреция его в желчь. Пигментный обмен, в свою очередь, играет важную роль в обмене железа в организме – в гепатоцитах находится железосодержащий белок ферритин. Оценка метаболической функцииВ клинической практике существуют приемы оценки той или иной функции: Участие в углеводномобмене оценивается:
Роль в липидномобмене рассматривается:
Белковыйобмен оценивается:
Пигментныйобмен оценивается:
Большая часть токсинов обезвреживается в печениОбезвреживание (детоксикация, биотрансформация) естественных метаболитов и чужеродных соединений (ксенобиотиков) непрерывно протекает в любом организме. Для попадания токсичных и чужеродных веществ существует три пути: желудочно-кишечный тракт, легкиеикожа. Далее эти вещества либо могут подвергнуться каким-либо превращениям (биотрансформации) в легких и ЖКТ, либо перейти в кровь. С током крови любые соединения попадают в печень и другие органы. Если это водорастворимое вещество, то оно в состоянии профильтроваться в почках, если летучее – оказаться в выдыхаемом воздухе и покинуть организм, если жирорастворимое – оно либо фиксируется в тканях (кожа, нервная система, жировая ткань и т.п.), либо подвергается биотрансформации в печени. После превращений в печени модифицированное соединение направляется либо в желчь и далее в фекалии, либо в кровь и мочу. Кожа также является органом выделения, однако обычно эта функция проявляется слабо. Однако при нарушении выделительной функции почек и печени нагрузка на кожу возрастает.  Места биотрансформации, задержки и выведения ксенобиотиковКсенобиотики– вещества, которые не используются как источник энергии, не встраиваются в структуры организма и не используются для пластических целей. Например, биотрансформации в печени подвергаются следующие вещества:
В целом все реакции биотрансформации делят на две группы или фазы:
 Две фазы биотрансформации ксенобиотиковОба типа реакций совершенно самостоятельныи могут идти независимо друг от друга и в любом порядке. Для некоторых веществ после реакций 1 и 2I фазы вновь могут наступить реакции фазы 1. Примером сочетанного превращения веществ может служить обезвреживание продукта метаболизма триптофана индола в животный индикан. Сначала индол окисляется с участием цитохрома Р450 до индоксила, затем конъюгирует с серной кислотой с образованием индоксилсульфата и далее калиевой соли – животного индикана. 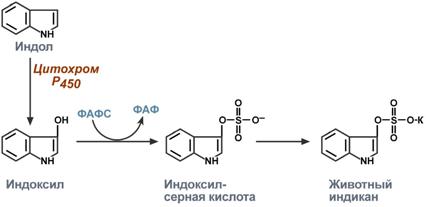 Превращение индола в 1 и 2 фазах биотрансформацииПри повышенном поступлении индола из толстого кишечника образование индикана в печени усиливается, далее он поступает в почки и выводится с мочой. По концентрации животного индикана в моче можно судить об интенсивности процессов гниения белка в кишечнике. Микросомы повышают реакционную способность молекулРеакции микросомального окисления осуществляются несколькими ферментами, расположенными на мембранах эндоплазматического ретикулума (в случае in vitro они называются микросомальные мембраны). Ферменты организуют короткую цепь, которая заканчивается цитохромом P450. Цитохром Р450взаимодействует с молекулярным кислородом и включает один атом кислорода в молекулу субстрата, способоствуя появлению у нее гидрофильности, а другой – в молекулу воды. Реакции микросомального окисления относятся к реакциям фазы 1 и предназначены для придания гидрофобной молекуле полярных свойств и/или для повышения ее гидрофильности, усиления реакционной способности молекул для участия в реакциях 2 фазы. В реакциях окисления происходит образование или высвобождение гидроксильных, карбоксильных, тиоловых и аминогрупп, которые и являются гидрофильными. Ферменты микросомального окисления располагаются в гладком эндоплазматическом ретикулуме и являются оксидазами со смешанной функцией (монооксигеназами). Основным белком этого процесса является гемопротеин – цитохром Р450. В природе существует до 150 изоформ этого белка, окисляющих около 3000 различных субстратов. У млекопитающих идентифицировано 13 подсемейств цитохрома Р450. Считается, что ферменты одних семейств участвуют в биотрансформации ксенобиотиков, других – метаболизируют эндогенные соединения (стероидные гормоны, простагландины, жирные кислоты и др.). Работа цитохрома Р450 обеспечивается двумя ферментами:
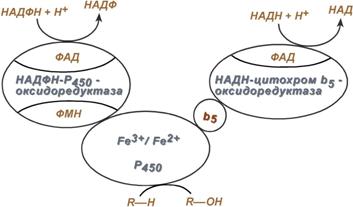 Схема взаиморасположения ферментов микросомального окисления и их функцииОбе оксидоредуктазы получают электроны от соответствующих восстановленных эквивалентов и передают их на цитохром Р450. Этот белок, предварительно присоединив молекулу восстановленного субстрата, связывается с молекулой кислорода. Получив еще один электрон, цитохром P450 осуществляет включение в состав гидрофобного субстрата первого атома кислорода (окисление субстрата). Одновременно происходит восстановление второго атома кислорода до воды. 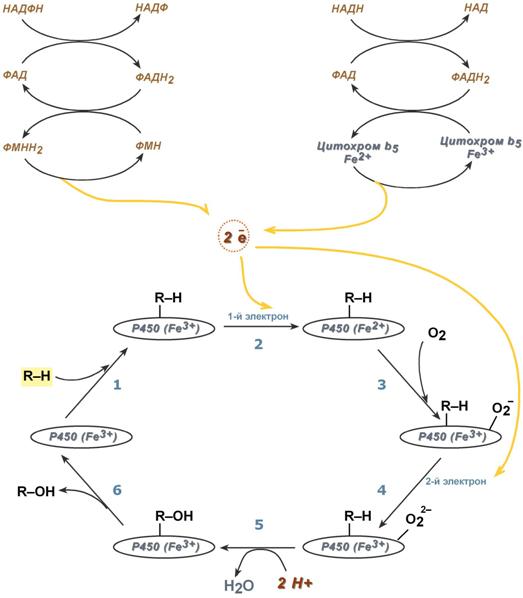 Реакции микросомального окисленияСущественной особенностью микросомального окисления является способность к индукции, т.е. увеличению мощности процесса. Индукторами являются вещества, активирующие синтез цитохрома Р450 и транскрипцию соответствующих мРНК. Классическим индуктором считаются производные барбитуровой кислоты –барбитураты. Поскольку существует много изоформ цитохрома, то имеется избирательность среди индукторов. Ингибиторымикросомального окисления связываются с белковой частью цитохрома или с железом гема – например, спиронолактон, эритромицин. Оценка реакций 1-й фазыОценку микросомального окисления можно проводить следующими способами:
Конъюгирование резко повышает водорастворимостьПродукты метаболизма чужеродных веществ, образовавшихся в первой фазе биотрансформации, подвергаются дальнейшей детоксикации с помощью ряда реакций второй фазы. Конечная цель этих реакций – маскировка токсичных групп в составе молекулы и придание ей большей гидрофильности. Соединения, обладающие активными группами, в гепатоцитах связываются с глутатионом, глюкуроновой, серной и уксусной кислотами, с глицином, глутамином, также они могут метилироваться. Последние в клетках часто находятся в связанном состоянии, например:
Наиболее активны в печени реакции конъюгации, катализируемые глутатион-S-трансферазой,сульфотрансферазойи УДФ-глюкуронилтрансферазой. Конъюгаты веществ с глутатионом, серной и глюкуроновой кислотами выводятся из организма преимущественно с мочой. 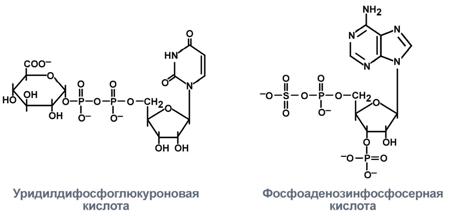 Строение основных кислот реакций конъюгацииКонъюгацию с глутатионом, приводящую к образованию меркаптуровых кислот, принято рассматривать в качестве основного механизма детоксикации. 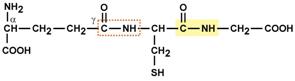 Строение глутатионаИногда от обезвреживания становится хужеРеакции биотрансформации обеспечивают превращение молекул в полярные, гидрофильные вещества, которые лучше удаляются с мочой. Но иногда такие соединения не детоксицируются, а наоборот, становятсяболее реакционно способными и являются более токсичными, чем их предшественники. В обычных условиях подобные ситуации встречаются редко и не выражены, т.к. мощности систем конъюгации и окисления достаточно. Однако при субстратной перегрузкеэтих систем, их истощенииили при заболеваниях печенидоля подобных реакций возрастает и может иметь клиническое значение, что выражается ворганотоксичностии химическом канцерогенезе. ОрганотоксичностьВ качестве примера рассмотрим метаболизм парацетамола. Обычно парацетамол (ацетаминофен) большей частью конъюгирует с глюкуроновой и серной кислотами и небольшая его доля окисляется цитохромом Р450, которая далее связывается с глутатионом. При неблагоприятных ситуациях (например, передозировка) доля окисленного парацетамола возрастает, и он начинает взаимодействовать с клеточными белками и нуклеиновыми кислотами, ингибируя их и вызывая гибель клеток. 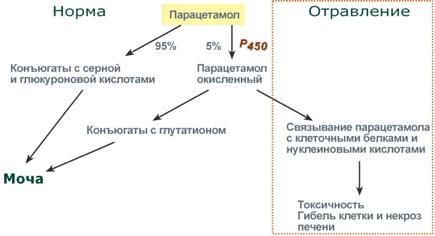 Нормальный метаболизм парацетамола и причины его токсичностиХимический канцерогенезВ настоящее время насчитывают до 150 соединений, могущих вызвать онкологические заболевания, им приписывают от 5% до 20% случаев всех опухолей. Все канцерогены подразделяют на:
В промышленности широко используется около 20 канцерогенных веществ: это амины(рак мочевого пузыря), соединения кадмия(рак простаты), хрома(рак легких), никеля(рак носовой полости и легких). Канцерогены могут быть полные, которые вызывают опухоль в месте нанесения, и проканцерогены, когда безвредное соединение, подвергаясь превращениям, становится токсичным. По одной из теорий канцерогенеза, развитие раковых заболеваний стимулируют ароматические соединения, подвергающиеся микросомальному окислению. К примеру, находящийся в каменноугольной смоле бензантрацен после окисления цитохромом Р450 превращается в канцерогенные эпоксид и бензантрацендиол. 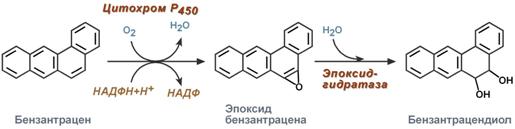 Схема окисления антрацена как прична его токсичности |
