Зачем врачу нужна биологическая химия
 Скачать 6.47 Mb. Скачать 6.47 Mb.
|
Аминокислоты используются в качестве лекарствМетионин, незаменимая кислота, содержит мобильную метильную группу, которая может передаваться на другие соединения. Благодаря этому она участвует в синтезе холина, фосфолипидов, обмене витаминов В12 и фолиевой кислоты. В реакциях биосинтеза белка метионин является инициирующей аминокислотой. Он участвует в процессах обезвреживания токсинов в печени. Метионин ("Ациметион") и его активные производные (как вещество "адеметионин" в составе препарата "Гептрал") используют для профилактики и лечения различных заболеваний печени как липотропный фактор, препятствующий накоплению жира, при токсических поражениях печени, при атеросклерозе и в качестве антидепрессанта для улучшения синтеза нейромедиаторов. Глутаминовая кислота – является предшественником гамма-аминомасляной кислоты (ГАМК), являющейся тормозным медиатором нервной системы. Сам глутамат также является нейромедиатором, стимулирующим передачу возбуждения в синапсах ЦНС. Кроме этого, глутамат участвует в обезвреживании аммиака, синтезе пуриновых и пиримидиновых оснований, играет ведущую роль в обмене других аминокислот, что активно используется в спортивной медицине. Потребность организма в глутаминовой кислоте намного выше потребности в остальных аминокислотах. Глицин является медиатором ЦНС тормозного действия. Улучшает метаболизм в тканях мозга. Оказывает успокаивающее действие. Нормализует сон, уменьшает повышенную раздражительность, депрессивные состояния. Цистеинучаствует в метаболизме хрусталика глаза. Зачастую нарушения хрусталика связаны с недостатком цистеина, поэтому цистеин применяют на начальных стадиях катаракты. Комплексный препарат глутаминовой кислоты, цистеина и глицина "Вицеин" используют в виде глазных капель. Гистидин – условно незаменимая аминокислота. Используется при лечении гепатитов, язв желудка и двенадцатиперстной кишки. Церебролизин – гидролизат вещества мозга свиньи, содержащий низкомолекулярные пептиды (15%) и аминокислоты (85%). Используется при нарушениях функций ЦНС, мозговых травмах, кровоизлияниях, вегетативных дистониях и т.п. Препараты для парентерального питания: полиамин(набор 13 аминокислот), вамин(набор 18 аминокислот), ваминолакт(набор 18 аминокислот, соответствующих составу грудного молока), гидролизин(гидролизат белков крови крупного рогатого скота), аминотроф(гидролизат казеина), фибриносол(гидролизат фибрина крови). 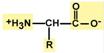 Аминокислоты – это строительные блоки макромолекул белков. По строению они являются органическими карбоновыми кислотами, у которых, как минимум, один атом водорода замещен на аминогруппу. Таким образом, в аминокислотах обязательно присутствует карбоксильная группа (СООН), аминогруппа(NH2),асимметричныйатом углерода и боковая цепь(радикал R). Именно строением боковой цепи аминокислоты и отличаются друг от друга. Аминокислоты – это строительные блоки макромолекул белков. По строению они являются органическими карбоновыми кислотами, у которых, как минимум, один атом водорода замещен на аминогруппу. Таким образом, в аминокислотах обязательно присутствует карбоксильная группа (СООН), аминогруппа(NH2),асимметричныйатом углерода и боковая цепь(радикал R). Именно строением боковой цепи аминокислоты и отличаются друг от друга.Классификация аминокислотИз-за разнообразного строения и свойств классификация аминокислот может быть различной, в зависимости от выбранного качества аминокислот. Аминокислоты подразделяются: 1. В зависимости от положения аминогруппы по отношению к С2 (α-углеродный атом) на α-аминокислоты, β-аминокислоты и др. 2. По абсолютной конфигурации молекулы на L- и D-стереоизомеры. 3. По оптической активности в отношении плоскости поляризованного света – на право- и левовращающие. 4. По участию аминокислот в синтезе белков – протеиногенные и непротеиногенные. 5. По строению бокового радикала – ароматические, алифатические, содержащие дополнительные СООН- и NH2-группы. 6. По кислотно-основным свойствам – нейтральные, кислые, основные. 7. По необходимости для организма – заменимые и незаменимые. Двадцать аминокислот необходимы для синтеза белкаСреди многообразия аминокислот только 20 участвует во внутриклеточном синтезе белков (протеиногенные аминокислоты). Также в организме человека обнаружено еще около 40 непротеиногенных аминокислот. Все протеиногенные аминокислоты являются α-аминокислотами. На их примере можно показать дополнительные способы классификации. Названия аминокислот обычно сокращаются до 3-х буквенного обозначения. Профессионалы в молекулярной биологии также используют однобуквенные символы для каждой аминокислоты. По строению бокового радикалаВыделяют алифатические(аланин,валин,лейцин, изолейцин,пролин,глицин), ароматические(фенилаланин, тирозин, триптофан), серусодержащие(цистеин, метионин), содержащие ОН-группу (серин, треонин, опять тирозин), содержащие дополнительную СООН-группу (аспарагиноваяи глутаминовая кислоты) и дополнительную NH2-группу (лизин, аргинин, гистидин, также глутамин, аспарагин). 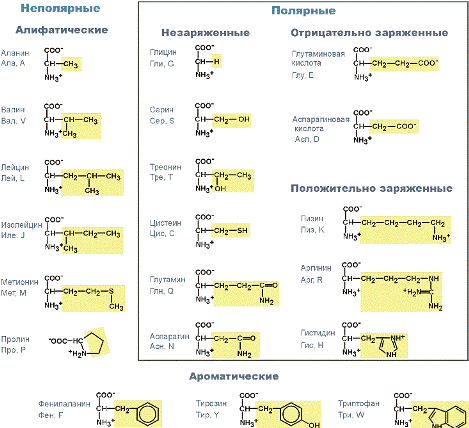 Строение протеиногенных аминокислотПо полярности бокового радикалаСуществуют неполярныеаминокислоты (ароматические, алифатические) и полярные(незаряженные, отрицательно и положительно заряженные). По кислотно-основным свойствамПо кислотно-основным свойствам подразделяют нейтральные(большинство), кислые(аспарагиновая и глутаминовая кислоты) и основные(лизин, аргинин, гистидин) аминокислоты. По незаменимостиПо необходимости для организма выделяют такие, которые не синтезируются в организме и должны поступать с пищей – незаменимыеаминокислоты (лейцин, изолейцин, валин, фенилаланин, триптофан, треонин, лизин, метионин). К заменимымотносят такие аминокислоты, углеродный скелет которых образуется в реакциях метаболизма и способен каким-либо образом получить аминогруппу с образованием соответствующей аминокислоты. Две аминокислоты являются условно незаменимыми (аргинин, гистидин), т.е. их синтез происходит в недостаточном количестве, особенно это касается детей. |
