Зачем врачу нужна биологическая химия
 Скачать 6.47 Mb. Скачать 6.47 Mb.
|
Аминокислоты соединяются пептидной связьюАминокислоты способны соединяться между собой связями, которые называются пептидными, при этом образуется полимерная молекула. Если количество аминокислот не превышает 10, то новое соединение называется пептид; если от 10 до 40 аминокислот – полипептид, если более 40 аминокислот – белок. Пептидная связь –это связь между α-карбоксильной группой одной аминокислоты и α-аминогруппой другой аминокислоты. 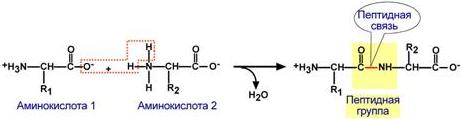 Образование пептидной связиПри необходимости назвать пептид ко всем названиям аминокислот добавляют суффикс "-ил", только последняя аминокислота сохраняет свое название неизменным. Например, аланил-серил-триптофан или γ-глутаминил-цистеинил-глицин (по-другому называемый глутатион). К свойствам пептидной связи относятся:1. Копланарность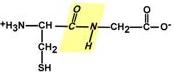 Все атомы, входящие в пептидную группу находятся в одной плоскости, при этом атомы "Н" и "О" расположены по разные стороны от пептидной связи. 2.Транс-положение заместителей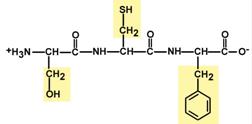 Радикалы аминокислот по отношению к оси C-N связи находятся по "разные" стороны, в транс-положении. 3. Две равнозначные формы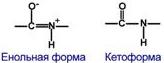 Пептидная связь имеет кетоформу и енольную форму. 4. Способность к образованию водородных связей.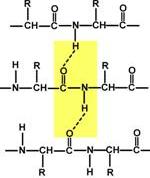 Атомы углерода и азота, входящие в пептидную связь обладают способностью образовывать две водородные связи с другими пептидными группами. 5. Пептидная связь имеет частично характер двойной связи.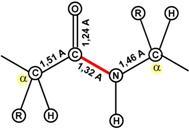 Длина пептидной связи меньше, чем одинарной связи, она является жесткой структурой, и вращение вокруг нее затруднено. Но так как, кроме пептидной, в белке есть и другие связи, цепочка аминокислот способна вращаться вокруг основной оси, что придает белкам различную конформацию (пространственное расположение атомов). Направления метаболизма аминокислотСуществуют три источника аминокислот в клетке – поступление из крови, распад собственных внутриклеточных белков и синтез заменимых аминокислот. Путь дальнейшего превращения аминокислот зависит от вида и функции клетки, условий ее существования и гормональных влияний. Спектр веществ, получаемых клеткой из аминокислот, чрезвычайно широк. 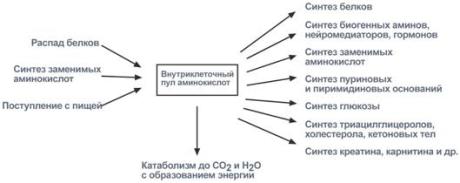 Возможные пути превращений аминокислотРеакции превращения аминокислот в клетке условно разделяют на три части, в зависимости от реагирующей группы: • по боковой цепи (радикалу) (перейти), • по карбоксильной группе (перейти), • с участием аминогруппы (перейти). Аминокислоты надо переносить через мембраныПеренос аминокислот через мембраны клеток, как при всасывании из полости кишечника в энтероциты, так и при переходе из крови в клетки различных тканей, осуществляется при помощи двух механизмов:вторичный активный транспорт и глутатионоваятранспортная система. Транспорт аминокислот через мембраныВторичный активный транспортВторичный активный транспорт – это перенос веществ, в данном случае аминокислот, с использованием градиента концентрации натрия между внутренней и наружной сторонами клеточной мембраны. Вторичный активный транспорт основан на использовании низкой концентрации ионов натрия внутри клеток, создаваемой мембранным ферментом Na+,K+-АТФазой. Специфический белок-транспортер связывает на апикальной поверхности энтероцитов аминокислоту и ион натрия. Важно то, что в отсутствие натрия аминокислота не в состоянии связаться с белком-переносчиком. Затем, изменив свое положение в мембране, белок отдает ион натрия в цитозоль по градиенту концентрации. Сразу после этого аминокислота теряет связь с белком и остается в цитоплазме. 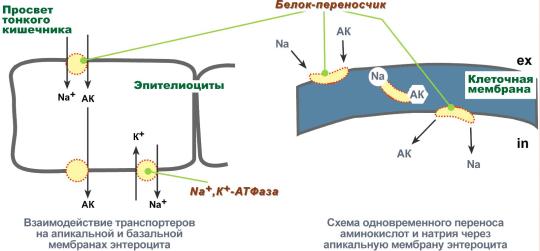 Вторичный активный транспорт аминокислот через мембраныВ настоящее время выделяют 5 транспортных систем:
Глутатионовая система транспортаВторой способ переноса аминокислот внутрь клетки происходит в комплексе с глутатионом при помощи фермента γ-глутамилтрансферазы. . 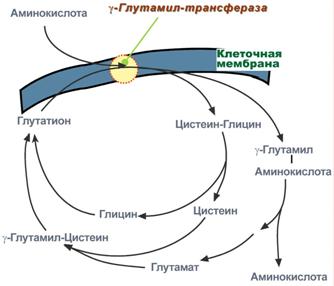 Транспорт аминокислот при участии глутатионаПереносчиком некоторых аминокислот (обычно нейтральных) по этой схеме является трипептид глутатион(γ-глутамилцистеилглицин). При взаимодействии глутатиона с аминокислотой на внешней стороне клеточной мембраны при участии глутамилтрансферазы. γ-Глутамильный остаток связывает аминокислоту и происходит ее перемещение внутрь клетки. Глутатион при этом распадается на составляющие. После отделения аминокислоты происходит ресинтез глутатиона. |
