Зачем врачу нужна биологическая химия
 Скачать 6.47 Mb. Скачать 6.47 Mb.
|
Трансаминирование нуждается в витамине В6Механизм реакции трансаминирования непрост и протекает по типу "пинг-понг". Катализируют реакцию ферменты аминотрансферазы, Они являются сложными ферментами, в качестве кофермента имеют пиридоксальфосфат (активная форма витамина В6). В тканях насчитывают около 10 аминотрансфераз, обладающие групповой специфичностью и вовлекающие в реакции все аминокислоты, кроме пролина, лизина, треонина, которые не подвергаются трансаминированию. Весь перенос аминогруппы совершается в две стадии:
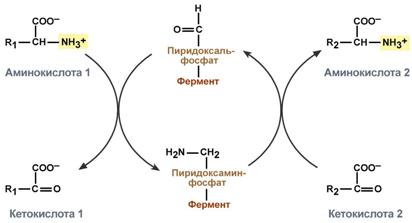 Схема реакции трансаминированияРоль и превращение пиридоксальфосфата сводится к образованию промежуточных соединений –шиффовых оснований (альдимин и кетимин). В первой реакции после отщепления воды образуется иминовая связь между остатком аминокислоты и пиридоксальфосфатом. Полученное соединение называется альдимин. Перемещение двойной связи приводит к образованию кетимина, который гидролизуется водой по месту двойной связи. От фермента отщепляется готовый продукт – кетокислота. 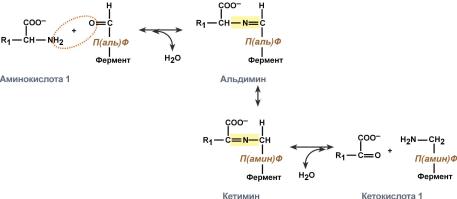 Механизм реакции трансаминированияПосле отщепления кетокислоты к комплексу пиридоксамин-фермент присоединяется новая кетокислота и процесс идет в обратном порядке: образуется кетимин, затем альдимин, после чего отделяется новая аминокислота. 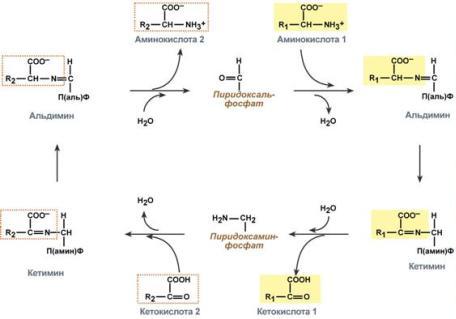 Реакции полного цикла трансаминированияЧаще всего аминокислоты взаимодействуют со следующими кетокислотами:
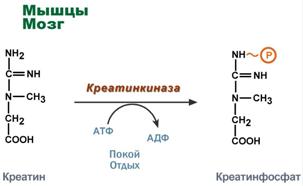
Однако аланин и аспартат в дальнейшем все равно передают свою аминогруппу на α-кетоглутаровую кислоту. Таким образом, в тканях осуществляется поток избыточных аминогрупп на один общий акцептор – α-кетоглутаровую кислоту. В итоге образуется большое количество глутаминовой кислоты. Далее глутаминовая кислота может вовлекается в процессы связывания аммиака (синтез глутамина) либо в прямое окислительное дезаминирование. Аминотрансферазы имеют клиническое значениеВ медицине нашло практическое применение определение активности двух ферментов трансаминирования – аланинаминотрансферазы(АЛТ, АлАТ) и аспартатаминтрансферазы(АСТ). Оба фермента обратимо взаимодействуют с α-кетоглутаровой кислотой и переносят на нее аминогруппы от соответствующих аминокислот с образованием глутаминовой кислоты и кетокислот. 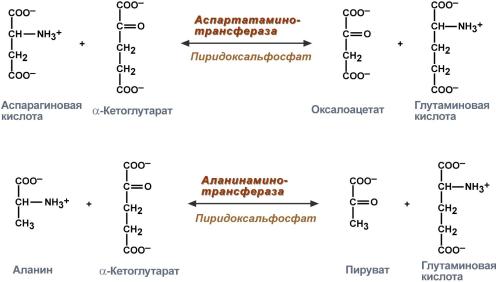 Реакции, катализируемые аланинаминотрансферазой и аспартатаминотрансферазойХотя активность обоих ферментов значительно возрастает при заболеваниях сердечной мышцы и печени, при поражении клеток миокарда наибольшая активность в сыворотке крови обнаруживается для АСТ, при гепатитах – для АЛТ. В клинической практике определение активности АЛТ и АСТ используется для дифференциальной диагностики болезней печени и миокарда, глубины поражения и контроля эффективности их лечения. Креатинфосфат - срочный резерв энергииКреатин – вещество скелетных мышц, миокарда, нервной ткани. В виде креатинфосфата креатин является "депо" макроэргических связей, используется для быстрого ресинтеза АТФ во время работы клетки. 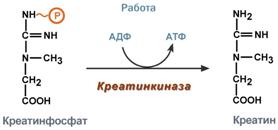 Использование креатинфосфата для ресинтеза АТФОсобенно показательна роль креатина в мышечной ткани. Креатинфосфат обеспечивает ресинтез АТФ в первые секунды работы (5 10 сек), когда ни анаэробный гликолиз, ни аэробное окисление глюкозы и жирных кислот еще не активировано, и кровоснабжение мышцы не увеличено. В клетках нервной ткани креатинфосфат поддерживает жизнеспособность клеток при отсутствии кислорода. При мышечной работе ионы Са2+, высвободившиеся из саркоплазматического ретикулума, являютсяактиваторами креатинкиназы. Реакция еще интересна тем, что на ее примере можно наблюдать обратную положительную связь — активацию фермента продуктом реакции креатином. Это позволяет избежать снижения скорости реакции по ходу работы, которое должно было бы произойти по закону действующих масс из-за снижения концентрации креатинфосфата в работающих мышцах. Около 3% креатинфосфата постоянно в реакции неферментативного дефосфорилирования превращается вкреатинин. Количество креатинина, выделяемое здоровым человеком в сутки, всегда почти одинаково и зависит только от объема мышечной массы. 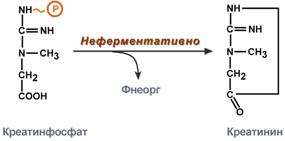 Образование креатинина из креатинфосфатаСинтез креатина идет последовательно в почках и печени в двух трансферазных реакциях. По окончании синтеза креатин с током крови доставляется в мышцы или мозг. 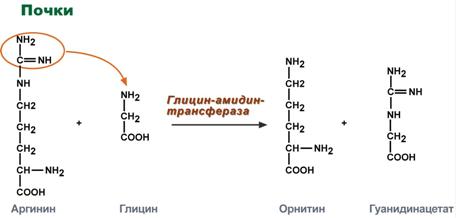 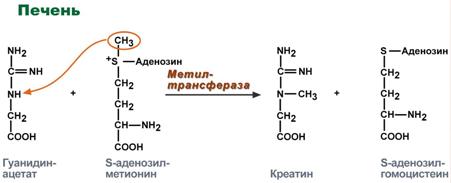 Реакции синтеза креатина в почках и печениЗдесь при наличии энергии АТФ (во время покоя или отдыха) он фосфорилируется с образованием креатинфосфата. |